名校
解题方法
1 . CO是现代化工生产的基础原料,下列有关问题都和CO的使用有关。
(1)工业上可利用CO生产乙醇:
2CO(g)+4H2(g)⇌CH3CH2OH(g)+H2O(g) ΔH1
又已知:H2O(l)= H2O(g) ΔH2
CO(g)+H2O(g)⇌CO2(g)+H2(g) ΔH3
工业上也可利用CO2(g)与H2(g)为原料合成乙醇:
2CO2(g)+6H2(g)⇌CH3CH2OH(g)+3H2O(l) ΔH
则:ΔH与ΔH1、ΔH2、ΔH3之间的关系是:ΔH=_______________________ 。
(2)一定条件下,H2、CO在体积固定的密闭容器中发生如下反应:
4H2(g)+2CO(g)⇌CH3OCH3(g)+H2O(g),
下列选项能判断该反应达到平衡状态的依据的有____。
(3)工业可采用CO与H2反应合成再生能源甲醇,反应如下:
CO(g)+ 2H2(g) CH3OH(g)
CH3OH(g)
在一容积可变的密闭容器中充有10molCO和20mol H2,
在催化剂作用下发生反应生成甲醇。CO的平衡转化率(α)与温度(T)、压强(p)的关系如(图1)所示。
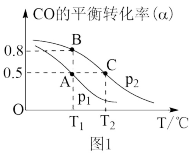
①合成甲醇的反应为_____ (填“放热”或“吸热”)反应。
②A、B、C三点的平衡常数KA、KB、KC的大小关系为_________ 。
③若达到平衡状态A时,容器的体积为10L,则在平衡状态B时容器的体积为______________ L。
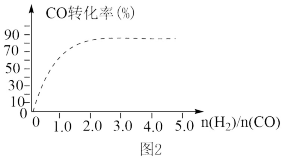
④(图2)中虚线为该反应在使用催化剂条件下关于起始氢气与CO投料比和CO平衡转化率的关系图。当其条件完全相同时,用实线画出不使用催化剂情况下CO平衡转化率的示意图______________ .
⑤CO的平衡转化率(α)与温度(T)、压强(p)的关系如(图3)所示,实际生产时条件控制在250 ℃、1.3×104 kPa左右,选择此压强的理由是________ 。

(1)工业上可利用CO生产乙醇:
2CO(g)+4H2(g)⇌CH3CH2OH(g)+H2O(g) ΔH1
又已知:H2O(l)= H2O(g) ΔH2
CO(g)+H2O(g)⇌CO2(g)+H2(g) ΔH3
工业上也可利用CO2(g)与H2(g)为原料合成乙醇:
2CO2(g)+6H2(g)⇌CH3CH2OH(g)+3H2O(l) ΔH
则:ΔH与ΔH1、ΔH2、ΔH3之间的关系是:ΔH=
(2)一定条件下,H2、CO在体积固定的密闭容器中发生如下反应:
4H2(g)+2CO(g)⇌CH3OCH3(g)+H2O(g),
下列选项能判断该反应达到平衡状态的依据的有____。
| A.2v(H2)= v(CO) |
| B.CO的消耗速率等于CH3OCH3的生成速率 |
| C.容器内的压强保持不变 |
| D.混合气体的密度保持不变 |
| E.混合气体的平均相对分子质量不随时间而变化 |
CO(g)+ 2H2(g)
 CH3OH(g)
CH3OH(g)在一容积可变的密闭容器中充有10molCO和20mol H2,
在催化剂作用下发生反应生成甲醇。CO的平衡转化率(α)与温度(T)、压强(p)的关系如(图1)所示。

①合成甲醇的反应为
②A、B、C三点的平衡常数KA、KB、KC的大小关系为
③若达到平衡状态A时,容器的体积为10L,则在平衡状态B时容器的体积为
④(图2)中虚线为该反应在使用催化剂条件下关于起始氢气与CO投料比和CO平衡转化率的关系图。当其条件完全相同时,用实线画出不使用催化剂情况下CO平衡转化率的示意图

⑤CO的平衡转化率(α)与温度(T)、压强(p)的关系如(图3)所示,实际生产时条件控制在250 ℃、1.3×104 kPa左右,选择此压强的理由是

您最近一年使用:0次
2016-12-09更新
|
1018次组卷
|
3卷引用:2015-2016学年湖北武汉第二中学高二上期中考试化学试卷
2 . 为应对环境污染,使得对如何减少煤燃烧和汽车尾气中各种含碳、氮、硫等气体的排放,及有效地开发利用碳资源的研究显得更加紧迫。
(1)为减少煤燃烧中废气的排放,常将煤转化为清洁气体燃料。请写出焦炭与水蒸气高温下反应的化学方程式:________________________ 。
(2)选择适当的催化剂在高温下可将汽车尾气中的 CO、NO转化为无毒气体。
已知:①2CO(g)+O2(g)=2CO2(g) ∆H1=-566kJ∙mol-1
②2NO(g)+2CO(g) ⇋N2(g)+ 2CO2(g) ∆H2=-746kJ∙mol-1
则反应N2(g)+ O2(g)= 2NO(g)的∆H=___________ kJ∙mol-1。
(3)在一定温度下,向1L密闭容器中充入0.5 mol NO、2 mol CO,发生上述反应②,
20s反应达平衡,此时CO的物质的量为1.6 mol。在该温度下反应的平衡常数K=_______ 。
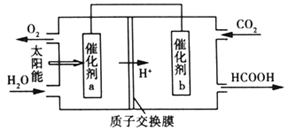
(4)将燃煤产生的二氧化碳回收利用,可达到低碳排放的目的。如图是通过人工光合作用以CO2和H2O为原料制备HCOOH和O2的原理示意图。催化剂b表面发生的电极反应式为_____________________ 。
(5)氮氧化物进入水体可转化为 ,电化学降解法可用于治理水中
,电化学降解法可用于治理水中 的污染。原理如图所示。
的污染。原理如图所示。
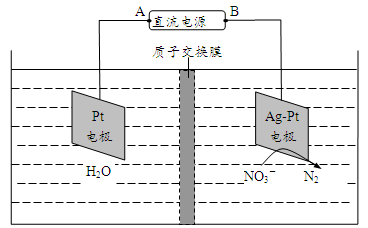
电源正极为_______ (填“A”或“B”),若电解过程中转移了0.4mol电子,则处理掉的 为
为_________ g。
(1)为减少煤燃烧中废气的排放,常将煤转化为清洁气体燃料。请写出焦炭与水蒸气高温下反应的化学方程式:
(2)选择适当的催化剂在高温下可将汽车尾气中的 CO、NO转化为无毒气体。
已知:①2CO(g)+O2(g)=2CO2(g) ∆H1=-566kJ∙mol-1
②2NO(g)+2CO(g) ⇋N2(g)+ 2CO2(g) ∆H2=-746kJ∙mol-1
则反应N2(g)+ O2(g)= 2NO(g)的∆H=
(3)在一定温度下,向1L密闭容器中充入0.5 mol NO、2 mol CO,发生上述反应②,
20s反应达平衡,此时CO的物质的量为1.6 mol。在该温度下反应的平衡常数K=
(4)将燃煤产生的二氧化碳回收利用,可达到低碳排放的目的。如图是通过人工光合作用以CO2和H2O为原料制备HCOOH和O2的原理示意图。催化剂b表面发生的电极反应式为

(5)氮氧化物进入水体可转化为
 ,电化学降解法可用于治理水中
,电化学降解法可用于治理水中 的污染。原理如图所示。
的污染。原理如图所示。
电源正极为
 为
为
您最近一年使用:0次
2016-12-09更新
|
576次组卷
|
2卷引用:2014-2015学年湖北省襄阳市老河口高级中学高二下学期期末化学试卷
3 . 钒是一种重要的合金元素,还用于催化剂和新型电池。从含钒固体废弃物(含有SiO2、Al2O3及其他残渣)中提取钒的一种新工艺主要流程如下:

部分含钒化合物在水中的溶解性如下表:
请回答下列问题:
(1)反应①所得溶液中除H+之外的阳离子有___________ 。
(2)反应②碱浸后滤出的固体主要成分是____________ (写化学式)。
(3)反应④的离子方程式为____________________ 。
(4)25℃、101 kPa时,4Al(s)+3O2(g)==2Al2O3(s) ΔH1=-a kJ/mol
4V(s)+5O2(g)==2V2O5(s) ΔH2=-b kJ/mol
用V2O5发生铝热反应冶炼金属钒的热化学方程式是_____________ 。
(5)钒液流电池(如右上图所示)具有广阔的应用领域和市场前景,该电池中隔膜只允许H+通过。电池放电时负极的电极反应式为__________ ,电池充电时阳极的电极反应式是_________ 。

(6)用硫酸酸化的H2C2O4溶液滴定(VO2)2SO4溶液,以测定反应①后溶液中的含钒量,反应的离子方程式为:2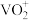 +H2C2O4+2H+=2VO2++2CO2↑+2H2O。取25.00 mL0.1000 mol/LH2C2O4标准溶液于锥形瓶中,加入指示剂,将待测液盛放在滴定管中,滴定到终点时消耗待测液24.0 mL,由此可知,该(VO2)2SO4溶液中钒的含量为
+H2C2O4+2H+=2VO2++2CO2↑+2H2O。取25.00 mL0.1000 mol/LH2C2O4标准溶液于锥形瓶中,加入指示剂,将待测液盛放在滴定管中,滴定到终点时消耗待测液24.0 mL,由此可知,该(VO2)2SO4溶液中钒的含量为______ g/L。

部分含钒化合物在水中的溶解性如下表:
| 物质 | V2O5 | NH4VO3 | VOSO4 | (VO2)2SO4 |
| 溶解性 | 难溶 | 难溶 | 可溶 | 易溶 |
(1)反应①所得溶液中除H+之外的阳离子有
(2)反应②碱浸后滤出的固体主要成分是
(3)反应④的离子方程式为
(4)25℃、101 kPa时,4Al(s)+3O2(g)==2Al2O3(s) ΔH1=-a kJ/mol
4V(s)+5O2(g)==2V2O5(s) ΔH2=-b kJ/mol
用V2O5发生铝热反应冶炼金属钒的热化学方程式是
(5)钒液流电池(如右上图所示)具有广阔的应用领域和市场前景,该电池中隔膜只允许H+通过。电池放电时负极的电极反应式为

(6)用硫酸酸化的H2C2O4溶液滴定(VO2)2SO4溶液,以测定反应①后溶液中的含钒量,反应的离子方程式为:2
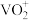 +H2C2O4+2H+=2VO2++2CO2↑+2H2O。取25.00 mL0.1000 mol/LH2C2O4标准溶液于锥形瓶中,加入指示剂,将待测液盛放在滴定管中,滴定到终点时消耗待测液24.0 mL,由此可知,该(VO2)2SO4溶液中钒的含量为
+H2C2O4+2H+=2VO2++2CO2↑+2H2O。取25.00 mL0.1000 mol/LH2C2O4标准溶液于锥形瓶中,加入指示剂,将待测液盛放在滴定管中,滴定到终点时消耗待测液24.0 mL,由此可知,该(VO2)2SO4溶液中钒的含量为
您最近一年使用:0次
2016-12-09更新
|
649次组卷
|
5卷引用:2015届湖北省武汉华中师大一附中高三5月适应性考试化学试卷
4 . 工业燃烧煤、石油等化石燃料释放出大量氮氧化物(NOx)、CO2、SO2等气体,严重污染空气。对废气进行脱硝、脱碳和脱硫处理可实现绿色环保、废物利用。
Ⅰ.脱硝:已知:H2的热值为142.9kJ·g−1
N2(g)+2O2(g)=2NO2(g) △H=+133 kJ∙mol−1
H2O(g)=H2O(l)△H=−44 kJ∙mol−1
(1)催化剂存在下,H2还原NO2生成水蒸气和其它无毒物质的热化学方程式为__________ 。
Ⅱ.脱碳:向2L密闭容器中加入2molCO2、6molH2,在适当的催化剂作用下,发生反应:
CO2(g)+3H2(g) CH3OH(l)+H2O(l)
CH3OH(l)+H2O(l)
(2)①该反应自发进行的条件是_________ (填“低温”、“高温”或“任意温度”)
②下列叙述能说明此反应达到平衡状态的是__________ 。
a、混合气体的平均式量保持不变
b、CO2和H2的体积分数保持不变
c、CO2和H2的转化率相等
d、混合气体的密度保持不变
e、1mol CO2生成的同时有3mol H−H键断裂
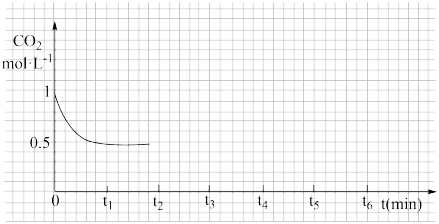
③CO2的浓度随时间(0~t2)变化如下图所示,在t2时将容器容积缩小一倍,t3时达到平衡,t4时降低温度,t5时达到平衡,请画出t2~t6 CO2的浓度随时间的变化___________ 。
(3)改变温度,使反应CO2(g)+3H2(g) CH3OH(g)+H2O(g) △H<0 中的所有物质都为气态。起始温度体积相同(T1℃、2 L密闭容器)。反应过程中部分数据见下表:
CH3OH(g)+H2O(g) △H<0 中的所有物质都为气态。起始温度体积相同(T1℃、2 L密闭容器)。反应过程中部分数据见下表:
① 达到平衡时,反应I、II对比:平衡常数K(I)_________ K(II)(填“>”、“<”或“=”下同);平衡时CH3OH的浓度c(I)__________ c(II)。
②对反应I,前10min内的平均反应速率υ(CH3OH)=__________ ,在其它条件不变下,若30min时只改变温度为T2℃,此时H2的物质的量为3.2mol,则T1_________ T2(填“>”、“<”或“=”)。若30min时只向容器中再充入1 mol CO2(g)和1 mol H2O(g),则平衡________ 移动(填“正向”、“逆向”或“不”)。
Ⅰ.脱硝:已知:H2的热值为142.9kJ·g−1
N2(g)+2O2(g)=2NO2(g) △H=+133 kJ∙mol−1
H2O(g)=H2O(l)△H=−44 kJ∙mol−1
(1)催化剂存在下,H2还原NO2生成水蒸气和其它无毒物质的热化学方程式为
Ⅱ.脱碳:向2L密闭容器中加入2molCO2、6molH2,在适当的催化剂作用下,发生反应:
CO2(g)+3H2(g)
 CH3OH(l)+H2O(l)
CH3OH(l)+H2O(l) (2)①该反应自发进行的条件是
②下列叙述能说明此反应达到平衡状态的是
a、混合气体的平均式量保持不变
b、CO2和H2的体积分数保持不变
c、CO2和H2的转化率相等
d、混合气体的密度保持不变
e、1mol CO2生成的同时有3mol H−H键断裂
③CO2的浓度随时间(0~t2)变化如下图所示,在t2时将容器容积缩小一倍,t3时达到平衡,t4时降低温度,t5时达到平衡,请画出t2~t6 CO2的浓度随时间的变化

(3)改变温度,使反应CO2(g)+3H2(g)
 CH3OH(g)+H2O(g) △H<0 中的所有物质都为气态。起始温度体积相同(T1℃、2 L密闭容器)。反应过程中部分数据见下表:
CH3OH(g)+H2O(g) △H<0 中的所有物质都为气态。起始温度体积相同(T1℃、2 L密闭容器)。反应过程中部分数据见下表:| 反应时间 | CO2(mol) | H2(mol) | CH3OH(mol) | H2O(mol) | |
| 反应I 恒温恒容 | 0 min | 2 | 6 | 0 | 0 |
| 10min | 4.5 | ||||
| 20min | 1 | ||||
| 30min | 1 | ||||
| 反应II 绝热恒容 | 0 min | 0 | 0 | 2 | 2 |
②对反应I,前10min内的平均反应速率υ(CH3OH)=
您最近一年使用:0次
2016-12-09更新
|
0次组卷
|
5卷引用:2015-2016学年湖北省枣阳二中高二下学期期中考试化学试卷
2014·吉林·二模
解题方法
5 . 新近出版的《前沿科学》杂志刊发的中国环境科学研究院研究员的论文《汽车尾气污染及其危害》,其中系统地阐述了汽车尾气排放对大气环境及人体健康造成的严重危害。目前降低尾气的可行方法是在汽车排气管上安装催化转化器。NO和CO气体均为汽车尾气的成分,这两种气体在催化转换器中发生反应:2CO(g)+2NO(g) N2(g)+2CO2(g) △H=-a kJ·mol-1。
N2(g)+2CO2(g) △H=-a kJ·mol-1。
(1)CO2的电子式为______________ 。
(2)已知2NO(g)+O2(g)=2NO2(g) △H=-b kJ·mol-1;CO的燃烧 热△H=-c kJ·mol-1。书写在消除汽车尾气中NO2的污染时,NO2与CO的可逆反应的热化学反应方程式_____________________ 。
(3)在一定温度下,将2.0mol NO、2.4mol气体CO通入到固定容积为2L的容器中,反应过程中部分物质的浓度变化如图所示:
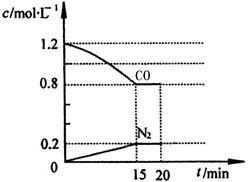
①有害气体NO的转化率为__________ ,0~15min NO的平均速率v(NO)=__________ 。
②20min时,若改变反应条件,导致CO浓度减小,则改变的条件可能是___________ (选填序号)。
a.缩小容器体积 b.增加CO的量 c.降低温度 d.扩大容器体积
③若保持反应体系的温度不变,20min时再向容器中充入NO、N2各0.4mol,化学平衡将__________ 移动(选填“向左”、“向右”或“不”), 移动后在达到平衡时的平衡常数是______________ 。
 N2(g)+2CO2(g) △H=-a kJ·mol-1。
N2(g)+2CO2(g) △H=-a kJ·mol-1。(1)CO2的电子式为
(2)已知2NO(g)+O2(g)=2NO2(g) △H=-b kJ·mol-1;CO的燃烧 热△H=-c kJ·mol-1。书写在消除汽车尾气中NO2的污染时,NO2与CO的可逆反应的热化学反应方程式
(3)在一定温度下,将2.0mol NO、2.4mol气体CO通入到固定容积为2L的容器中,反应过程中部分物质的浓度变化如图所示:

①有害气体NO的转化率为
②20min时,若改变反应条件,导致CO浓度减小,则改变的条件可能是
a.缩小容器体积 b.增加CO的量 c.降低温度 d.扩大容器体积
③若保持反应体系的温度不变,20min时再向容器中充入NO、N2各0.4mol,化学平衡将
您最近一年使用:0次
13-14高二上·湖北·期中
解题方法
6 . 研究燃料的燃烧和对污染气体产物的无害化处理,对于防止大气污染有重要意义。
(1)将煤转化为清洁气体燃料:已知:H2(g)+1/2O2(g)=H2O(g) H= −241.8kJ/mol;C(s)+1/2O2(g)=CO(g)
H= −241.8kJ/mol;C(s)+1/2O2(g)=CO(g) H= −110.5kJ/mol;写出焦炭与水蒸气反应制H2和CO的热化学方程式
H= −110.5kJ/mol;写出焦炭与水蒸气反应制H2和CO的热化学方程式________________________ 。
(2)一定条件下,在密闭容器内,SO2被氧化成SO3的热化学方程式为:2SO2(g)+O2(g) 2SO3(g);△H=−a kJ/mol,在相同条件下要想得到2akJ热量,加入各物质的物质的量可能是
2SO3(g);△H=−a kJ/mol,在相同条件下要想得到2akJ热量,加入各物质的物质的量可能是____________
A.4mol SO2和2mol O2 B.4mol SO2、2mol O2和2mol SO3
C.4mol SO2和4mol O2 D.6mol SO2和4mol O2
(3)汽车尾气中NOx和CO的生成及转化:
①已知气缸中生成NO的反应为:N2(g)+O2(g) 2NO(g)
2NO(g) H>0,在一定温度下的定容密闭容器中,能说明此反应已达平衡的是
H>0,在一定温度下的定容密闭容器中,能说明此反应已达平衡的是__________
A.压强不变B.混合气体平均相对分子质量不变
C.2v正(N2)=v逆(NO) D.N2的体积分数不再改变
②汽车燃油不完全燃烧时产生CO,有人设想按下列反应除去CO:2CO(g)=2C(s)+O2(g) H>0,简述该设想能否实现的依据
H>0,简述该设想能否实现的依据_______________________________________________ 。
(4)燃料CO、H2在一定条件下可以相互转化:CO(g)+H2O(g) CO2(g)+H2(g)。在420℃时,平衡常数K=9。若反应开始时,CO、H2O的浓度均为0.1mol/L,则CO在此反应条件下的转化率为
CO2(g)+H2(g)。在420℃时,平衡常数K=9。若反应开始时,CO、H2O的浓度均为0.1mol/L,则CO在此反应条件下的转化率为______________ 。
(1)将煤转化为清洁气体燃料:已知:H2(g)+1/2O2(g)=H2O(g)
 H= −241.8kJ/mol;C(s)+1/2O2(g)=CO(g)
H= −241.8kJ/mol;C(s)+1/2O2(g)=CO(g) H= −110.5kJ/mol;写出焦炭与水蒸气反应制H2和CO的热化学方程式
H= −110.5kJ/mol;写出焦炭与水蒸气反应制H2和CO的热化学方程式(2)一定条件下,在密闭容器内,SO2被氧化成SO3的热化学方程式为:2SO2(g)+O2(g)
 2SO3(g);△H=−a kJ/mol,在相同条件下要想得到2akJ热量,加入各物质的物质的量可能是
2SO3(g);△H=−a kJ/mol,在相同条件下要想得到2akJ热量,加入各物质的物质的量可能是A.4mol SO2和2mol O2 B.4mol SO2、2mol O2和2mol SO3
C.4mol SO2和4mol O2 D.6mol SO2和4mol O2
(3)汽车尾气中NOx和CO的生成及转化:
①已知气缸中生成NO的反应为:N2(g)+O2(g)
 2NO(g)
2NO(g) H>0,在一定温度下的定容密闭容器中,能说明此反应已达平衡的是
H>0,在一定温度下的定容密闭容器中,能说明此反应已达平衡的是A.压强不变B.混合气体平均相对分子质量不变
C.2v正(N2)=v逆(NO) D.N2的体积分数不再改变
②汽车燃油不完全燃烧时产生CO,有人设想按下列反应除去CO:2CO(g)=2C(s)+O2(g)
 H>0,简述该设想能否实现的依据
H>0,简述该设想能否实现的依据(4)燃料CO、H2在一定条件下可以相互转化:CO(g)+H2O(g)
 CO2(g)+H2(g)。在420℃时,平衡常数K=9。若反应开始时,CO、H2O的浓度均为0.1mol/L,则CO在此反应条件下的转化率为
CO2(g)+H2(g)。在420℃时,平衡常数K=9。若反应开始时,CO、H2O的浓度均为0.1mol/L,则CO在此反应条件下的转化率为
您最近一年使用:0次
2010·湖北武汉·一模
7 . 丙烯是一种重要的化工原料。2000年以来,我国丙烯的使用量已超过乙烯,且一直保持增长趋势。
(1)2010年12月18日位于浙江平湖市独山港区石化工业发展区内一个丙烯储罐突然爆炸起火,大火产生的高温使消防队员难以靠近火场。已知丙烯的燃烧热为2049 kJ/mol,则其燃烧反应的热化学方程式为:___________________ 。
(2)丙烯在酸性催化剂存在下,聚合生成二聚体、三聚体的混合物,将其加入汽油中,可提高汽油的__________ 。在催化剂存在下,丙烯聚合生成聚丙烯树脂,其反应的化学方程式为________________ 。
(3)制取丙烯腈的方法常有如下两种:
方法①CH≡CH+H-CN CH2=CH-CN
CH2=CH-CN
方法②2CH2=CH-CH3+2NH3+3O2 2CH2=CH-CN+6H2O
2CH2=CH-CN+6H2O
相比较而言,方法②的优点是___________________________ 。
(4)现以丙烯为原料,合成环酯J。已知:烯烃复分解反应是指在催化剂作用下,实现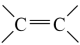 两边基团换位的反应。如两个丙烯分子进行烯烃换位,生成丁烯和乙烯。
两边基团换位的反应。如两个丙烯分子进行烯烃换位,生成丁烯和乙烯。
2CH2=CHCH3 CH3CH=CHCH3+CH2=CH2
CH3CH=CHCH3+CH2=CH2
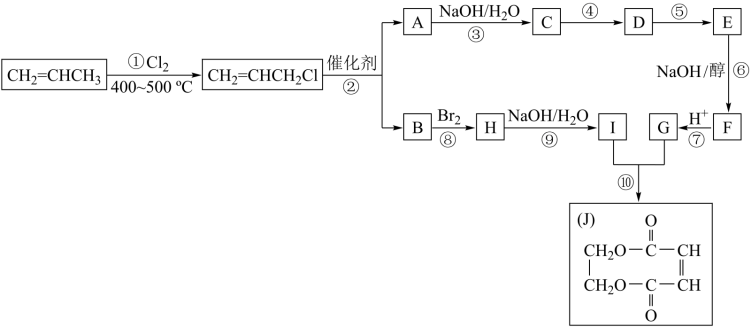
请按要求填空:
(i)写出下列反应的反应类型:①______________ ,⑥_________________ 。
(ii)反应④是与HCl加成,设计这一步反应的目的是_____________ ,物质E的结构简式是____________ 。
(iii)有机化合物C有多种同分异构体,请写出其中属于酯类且能发生银镜反应的所有同分异构体的结构简式_________________ 。
(1)2010年12月18日位于浙江平湖市独山港区石化工业发展区内一个丙烯储罐突然爆炸起火,大火产生的高温使消防队员难以靠近火场。已知丙烯的燃烧热为2049 kJ/mol,则其燃烧反应的热化学方程式为:
(2)丙烯在酸性催化剂存在下,聚合生成二聚体、三聚体的混合物,将其加入汽油中,可提高汽油的
(3)制取丙烯腈的方法常有如下两种:
方法①CH≡CH+H-CN
 CH2=CH-CN
CH2=CH-CN方法②2CH2=CH-CH3+2NH3+3O2
 2CH2=CH-CN+6H2O
2CH2=CH-CN+6H2O相比较而言,方法②的优点是
(4)现以丙烯为原料,合成环酯J。已知:烯烃复分解反应是指在催化剂作用下,实现
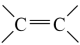 两边基团换位的反应。如两个丙烯分子进行烯烃换位,生成丁烯和乙烯。
两边基团换位的反应。如两个丙烯分子进行烯烃换位,生成丁烯和乙烯。2CH2=CHCH3
 CH3CH=CHCH3+CH2=CH2
CH3CH=CHCH3+CH2=CH2
请按要求填空:
(i)写出下列反应的反应类型:①
(ii)反应④是与HCl加成,设计这一步反应的目的是
(iii)有机化合物C有多种同分异构体,请写出其中属于酯类且能发生银镜反应的所有同分异构体的结构简式
您最近一年使用:0次



