名校
1 . 甲醇是结构最为简单的饱和一元醇,又称“木醇”或“木精”。甲醇是一碳化学基础的原料和优质的燃料,主要应用于精细化工、塑料、能源等领域。已知甲醇制备的有关化学反应如下:
反应①:CO(g)+2H2(g)⇌CH3OH(g) ΔH1=﹣92kJ/mol
反应②:CO2(g)+H2(g)⇌CO(g)+H2O(g) ΔH2
反应③:CO2(g)+3H2(g)⇌CH3OH(g)+H2O(g) ΔH3=﹣49kJ/mol
(1)反应②的ΔH2=_______ kJ/mol
(2)500℃时三个反应的平衡常数依次为K1、K2与K3,则K3=_______ (用K1、K2表示)。已知500℃时,K1=2.5,K2=1.0,并测得该温度下反应③在某时刻H2(g)、CO2(g)、CH3OH(g)、H2O(g)的浓度(mol/L)分别为1.0、0.2、0.6、1.5,则此时 v正_______ v逆(填“>”、“=”或“<”)
反应①:CO(g)+2H2(g)⇌CH3OH(g) ΔH1=﹣92kJ/mol
反应②:CO2(g)+H2(g)⇌CO(g)+H2O(g) ΔH2
反应③:CO2(g)+3H2(g)⇌CH3OH(g)+H2O(g) ΔH3=﹣49kJ/mol
(1)反应②的ΔH2=
(2)500℃时三个反应的平衡常数依次为K1、K2与K3,则K3=
您最近一年使用:0次
名校
解题方法
2 . 回答下列问题
(1)已知:①2Fe2O3(s)+3C(s)=3CO2(g)+4Fe(s) ΔH1=+234.1 kJ·mol-1
②C(s)+O2(g=CO2(g) ΔH2=-393.5 kJ·mol-1
则Fe和O2反应生成Fe2O3的热化学反应方程式为_______ 。
(2)①为了更好的表示溶液的酸碱性,科学家提出了酸度(AG)的概念,AG的定义为AG=lg 。25℃时,溶液的pH与AG的换算公式为AG=
。25℃时,溶液的pH与AG的换算公式为AG=_______ ,若溶液呈中性,则AG=_______ 。
②25℃时,将体积Va、pH=a的某一元强碱与体积为Vb、pH=b的某二元强酸混合;若所得溶液的pH=7,且已知Va>Vb,b=0.5a,b值可否等于4_______ (填“可”或“否”)。
(3)实验室中有一未知浓度的稀盐酸,某学生用0.10 mol·L-1NaOH标准溶液进行测定盐酸的浓度的实验。取20.00 mL待测盐酸放入锥形瓶中,并滴加2~3滴酚酞作指示剂,用自己配制的NaOH标准溶液进行滴定。重复上述滴定操作2~3次,记录数据如表。
请完成下列填空:
①滴定达到终点的标志是_______ 。
②根据上述数据,可计算出该盐酸的浓度约为_______ (保留两位有效数字)。
③在上述实验中,下列操作(其他操作正确)会造成测定结果偏高的有_______ (填字母序号)。
A.滴定终点读数时俯视
B.酸式滴定管使用前,水洗后未用待测盐酸润洗
C.锥形瓶水洗后未干燥
D.称量NaOH固体中混有Na2CO3固体
E.碱式滴定管尖嘴部分有气泡,滴定后消失
(1)已知:①2Fe2O3(s)+3C(s)=3CO2(g)+4Fe(s) ΔH1=+234.1 kJ·mol-1
②C(s)+O2(g=CO2(g) ΔH2=-393.5 kJ·mol-1
则Fe和O2反应生成Fe2O3的热化学反应方程式为
(2)①为了更好的表示溶液的酸碱性,科学家提出了酸度(AG)的概念,AG的定义为AG=lg
 。25℃时,溶液的pH与AG的换算公式为AG=
。25℃时,溶液的pH与AG的换算公式为AG=②25℃时,将体积Va、pH=a的某一元强碱与体积为Vb、pH=b的某二元强酸混合;若所得溶液的pH=7,且已知Va>Vb,b=0.5a,b值可否等于4
(3)实验室中有一未知浓度的稀盐酸,某学生用0.10 mol·L-1NaOH标准溶液进行测定盐酸的浓度的实验。取20.00 mL待测盐酸放入锥形瓶中,并滴加2~3滴酚酞作指示剂,用自己配制的NaOH标准溶液进行滴定。重复上述滴定操作2~3次,记录数据如表。
| 实验编号 | NaOH溶液的浓度(mol·L-1) | 滴定完成时,NaOH溶液滴入的体积(mL) | 待测盐酸的体积(mL) |
| 1 | 0.10 | 22.65 | 20.00 |
| 2 | 0.10 | 22.72 | 20.00 |
| 3 | 0.10 | 22.93 | 20.00 |
①滴定达到终点的标志是
②根据上述数据,可计算出该盐酸的浓度约为
③在上述实验中,下列操作(其他操作正确)会造成测定结果偏高的有
A.滴定终点读数时俯视
B.酸式滴定管使用前,水洗后未用待测盐酸润洗
C.锥形瓶水洗后未干燥
D.称量NaOH固体中混有Na2CO3固体
E.碱式滴定管尖嘴部分有气泡,滴定后消失
您最近一年使用:0次
名校
3 . 利用如图所示装置测定中和热的实验步骤如下:
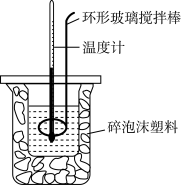
①用量筒量取50mL 0.50mol•L-1盐酸倒入小烧杯中,测出盐酸的温度,然后把温度计上的 酸用水冲洗干净;
②用另一量筒量取50mL 0.55mol•L-1 NaOH溶液,并用同一温度计测出其温度;
③将NaOH溶液倒入小烧杯中,设法使之混合均匀,测得混合液最高温度。回答下列问题:
(1)实验中NaOH溶液稍稍过量的目的是_________________________________________ 。
(2)使盐酸与NaOH溶液混合均匀的正确操作是_______ (填序号).
A.用温度计小心搅拌 B.揭开硬纸片用玻璃棒搅拌
C.轻轻地振荡烧杯 D.用套在温度计上的环形玻璃搅拌棒轻轻地上下搅动
(3)实验中改用60mL 0.50mol·L-1盐酸与50mL 0.55mol·L-1 NaOH溶液进行反应,与上述实验相比,放出的热量______________ (填“ 偏多”“偏少”或“相等”,下同),所求得的中和热ΔH ______________ 。
(4)如果上述实验测得中和热ΔH = -55.6kJ/mol,并已知:Ba2+(aq)+2OH-(aq)+ 2H++SO42- (aq)=BaSO4(s) +2H2O(l) ,ΔH=-1584.2 kJ·mol-1。则生成BaSO4(s)的反应热ΔH=______________ 。

①用量筒量取50mL 0.50mol•L-1盐酸倒入小烧杯中,测出盐酸的温度,然后把温度计上的 酸用水冲洗干净;
②用另一量筒量取50mL 0.55mol•L-1 NaOH溶液,并用同一温度计测出其温度;
③将NaOH溶液倒入小烧杯中,设法使之混合均匀,测得混合液最高温度。回答下列问题:
(1)实验中NaOH溶液稍稍过量的目的是
(2)使盐酸与NaOH溶液混合均匀的正确操作是
A.用温度计小心搅拌 B.揭开硬纸片用玻璃棒搅拌
C.轻轻地振荡烧杯 D.用套在温度计上的环形玻璃搅拌棒轻轻地上下搅动
(3)实验中改用60mL 0.50mol·L-1盐酸与50mL 0.55mol·L-1 NaOH溶液进行反应,与上述实验相比,放出的热量
(4)如果上述实验测得中和热ΔH = -55.6kJ/mol,并已知:Ba2+(aq)+2OH-(aq)+ 2H++SO42- (aq)=BaSO4(s) +2H2O(l) ,ΔH=-1584.2 kJ·mol-1。则生成BaSO4(s)的反应热ΔH=
您最近一年使用:0次
2019-10-23更新
|
79次组卷
|
2卷引用:黑龙江省哈尔滨市依兰县高级中学2021-2022学年高二上学期第一次月考化学试题
名校
4 . 下列与化学反应能量变化相关的叙述正确的是
| A.生成物总能量一定低于反应物总能量 |
| B.ΔH的大小与热化学方程式的计量系数无关 |
| C.应用盖斯定律可计算某些难以直接测量的反应焓变 |
| D.同温同压下,H2(g)+Cl2(g)=2HCl(g)在光照和点燃条件下的ΔH不同 |
您最近一年使用:0次
2016-12-09更新
|
166次组卷
|
3卷引用:黑龙江省哈尔滨市第三十二中学2020-2021学年高二上学期期末考试化学试题
名校
解题方法
5 . 下列描述中正确的是
| A.已知:P4(白磷,s)==4P(红磷,s)ΔH<0,则白磷比红磷稳定 |
| B.由CH3CH2CH2CH3(g)+13/2O2(g)==4CO2(g)+5H2O(g)ΔH=-2658 kJ·mol-1可知正丁烷的标准燃烧热为2658 kJ·mol-1 |
| C.OH-(aq)+H+(aq)==H2O(l) ΔH=-57.3 kJ·mol-1,故1 mol醋酸与1 mol NaOH完全反应,放出的热量为57.3 kJ·mol-1 |
| D.已知:2CO(g)+O2(g)==2CO2(g) ΔH=-566 kJ·mol-1 N2(g)+O2(g)==2NO(g) ΔH=+180 kJ·mol-1则2CO(g)+2NO(g)==N2(g)+2CO2(g) ΔH=-746 kJ·mol-1 |
您最近一年使用:0次
2016-09-20更新
|
197次组卷
|
2卷引用:黑龙江省哈尔滨市第三中学2021-2022学年高二上学期10月阶段性测试化学试题
名校
解题方法
6 . ①CaCO3(s)=CaO+CO2(g);ΔH=177.7kJ/mol
②C(s)+H2O(g)=CO(g)+H2(g);ΔH=-131.3kJ/mol
③1/2H2SO4(l)+NaOH(l)=1/2Na2SO4(l)+H2O(l);ΔH=-57.3kJ/mol
④C(s)+O2(g)=CO2(g);ΔH=-393.5kJ/mol
⑤CO(g)+1/2O2(g)=CO2(g);ΔH=-283kJ/mol
⑥HNO3(aq)+NaOH(aq)=NaNO3(aq)+H2O(l);ΔH=-57.3kJ/mol
⑦2H2(g)+O2(g)=2H2O(l);ΔH=-517.6kJ/mol
(1)上述热化学方程式中,不正确的有( )
(2)根据上述信息,写出C转化为CO的热化学方程式___________________ 。
(3)上述正确的反应中,表示燃烧热的热化学方程式有( ) ;
(4)表示中和热的热化学方程式有( ) 。
②C(s)+H2O(g)=CO(g)+H2(g);ΔH=-131.3kJ/mol
③1/2H2SO4(l)+NaOH(l)=1/2Na2SO4(l)+H2O(l);ΔH=-57.3kJ/mol
④C(s)+O2(g)=CO2(g);ΔH=-393.5kJ/mol
⑤CO(g)+1/2O2(g)=CO2(g);ΔH=-283kJ/mol
⑥HNO3(aq)+NaOH(aq)=NaNO3(aq)+H2O(l);ΔH=-57.3kJ/mol
⑦2H2(g)+O2(g)=2H2O(l);ΔH=-517.6kJ/mol
(1)上述热化学方程式中,不正确的有
(2)根据上述信息,写出C转化为CO的热化学方程式
(3)上述正确的反应中,表示燃烧热的热化学方程式有
(4)表示中和热的热化学方程式有
您最近一年使用:0次
2016-10-31更新
|
108次组卷
|
3卷引用:黑龙江省大兴安岭实验中学(西校区)2021-2022学年高二上学期第一次月考化学试题
解题方法
7 . 工业上合成氨的原理如下:N2(g)+3H2(g) 2NH3(g)△H。
2NH3(g)△H。
(1)已知H-H键的键能为436 kJ•mol-1,N-H键的键能为391kJ•mol-1,N=N键的键能是945.6 kJ•mol-1,则上述反应的△H=________ 。
(2)若上述反应在甲、乙、丙、丁四个同样的密闭容器中进行,在同一段时间内测得容器内的反应速率分别为甲:v(NH3)=3.5 mol•L-1• min-1;乙:v(N2)=2 mol•L-1• min-1;丙:v(H2)=4.5mol•L-1• min-1;丁:v(NH3)=0.075 mol•L-1• min-1。若其他条件相同,温度不同,则温度由高到低的顺序是______________ (填序号)。
(3)在一定温度下,将1 molN2和3 mol H2混合置于体积不变的密闭容器中发生反应,达到平衡状态时,测得气体总物质的量为2.8 mol,容器压强为8 MPa。则平衡常数Kp=________ (用平衡分压代替浓度计算,分压=总压×物质的量分数)。
(4)在773 K时,分别将2 molN2和6 mol H2充入一个固定容积为1 L的密闭容器中,随着反应的进行,气体混合物中各物质的浓度与反应时间t的关系如图所示。
①图中表示c(N2)-t的曲线是________ 。
②该温度下,若向同容积的另一容器中投入的N2、H2、NH3的浓度均为3 mol·L-l,则此时v正________ v逆(填“>”“<”或“=”)。
 2NH3(g)△H。
2NH3(g)△H。(1)已知H-H键的键能为436 kJ•mol-1,N-H键的键能为391kJ•mol-1,N=N键的键能是945.6 kJ•mol-1,则上述反应的△H=
(2)若上述反应在甲、乙、丙、丁四个同样的密闭容器中进行,在同一段时间内测得容器内的反应速率分别为甲:v(NH3)=3.5 mol•L-1• min-1;乙:v(N2)=2 mol•L-1• min-1;丙:v(H2)=4.5mol•L-1• min-1;丁:v(NH3)=0.075 mol•L-1• min-1。若其他条件相同,温度不同,则温度由高到低的顺序是
(3)在一定温度下,将1 molN2和3 mol H2混合置于体积不变的密闭容器中发生反应,达到平衡状态时,测得气体总物质的量为2.8 mol,容器压强为8 MPa。则平衡常数Kp=
(4)在773 K时,分别将2 molN2和6 mol H2充入一个固定容积为1 L的密闭容器中,随着反应的进行,气体混合物中各物质的浓度与反应时间t的关系如图所示。
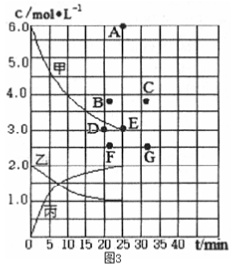
①图中表示c(N2)-t的曲线是
②该温度下,若向同容积的另一容器中投入的N2、H2、NH3的浓度均为3 mol·L-l,则此时v正
您最近一年使用:0次
2017-11-03更新
|
116次组卷
|
2卷引用:黑龙江省五校(嫩江市第一中学、嫩江市职业高中、伊拉哈中学、海江中学等)2021-2022学年高二上学期期中联考化学试题
8 .  的固定和利用对降低温室气体排放具有重要作用,
的固定和利用对降低温室气体排放具有重要作用, 加氢合成甲醇不仅可以有效缓解减排压力,而且还是
加氢合成甲醇不仅可以有效缓解减排压力,而且还是 综合利用的一条新途径。
综合利用的一条新途径。 加氢过程,主要发生的两个竞争反应为:
加氢过程,主要发生的两个竞争反应为:
i.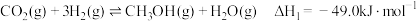
ii.
回答下列问题:
(1)由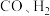 合成甲醇的热化学方程式为
合成甲醇的热化学方程式为___________ 。
(2)在某催化剂作用下, 和
和 除发生反应i外,还发生反应ii.维持压强不变,按固定初始投料比将
除发生反应i外,还发生反应ii.维持压强不变,按固定初始投料比将 和
和 按一定流速通过该催化剂,经过相同时间测得实验数据:
按一定流速通过该催化剂,经过相同时间测得实验数据:
注:甲醇的选择性是指发生反应的 中转化为甲醇的百分比。
中转化为甲醇的百分比。
表中数据说明,升高温度, 的实际转化率提高而甲醇的选择性降低,其原因是
的实际转化率提高而甲醇的选择性降低,其原因是___________ 。
(3)恒温恒压条件下(此时甲醇为气态),发生反应i(此时不考虑反应ii)。在开始为 的密闭容器中充入
的密闭容器中充入 和
和 ,达平衡时
,达平衡时 的转化率为50%,则反应i的
的转化率为50%,则反应i的
___________ 。
(4)反应i可能的反应历程下图所示。
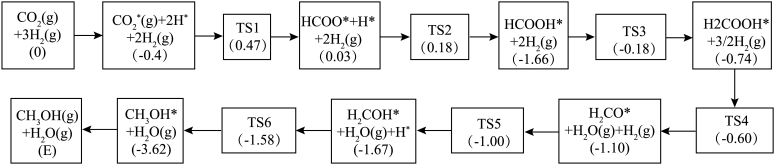
注:方框内包含微粒种类及数目、微粒的相对总能量(括号里的数字或字母,单位: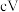 )。其中,
)。其中, 表示过渡态、*表示吸附在催化剂上的微粒。
表示过渡态、*表示吸附在催化剂上的微粒。
①反应历程中,生成甲醇的快速步骤的反应方程式为___________ 。
②相对总能量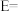
___________  (计算结果保留2位小数)。(已知:
(计算结果保留2位小数)。(已知: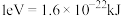 )
)
(5)以纳米二氧化钛膜为工作电极,稀硫酸为电解质溶液,在一定条件下通入 电解,在阴极可制得低密度聚乙烯
电解,在阴极可制得低密度聚乙烯 (简称
(简称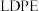 )。
)。
①电解时,阴极的电极反应式是___________ 。
②工业上生产 的
的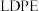 ,理论上需要标准状况下
,理论上需要标准状况下___________ L的 。
。
 的固定和利用对降低温室气体排放具有重要作用,
的固定和利用对降低温室气体排放具有重要作用, 加氢合成甲醇不仅可以有效缓解减排压力,而且还是
加氢合成甲醇不仅可以有效缓解减排压力,而且还是 综合利用的一条新途径。
综合利用的一条新途径。 加氢过程,主要发生的两个竞争反应为:
加氢过程,主要发生的两个竞争反应为:i.
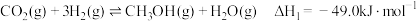
ii.

回答下列问题:
(1)由
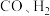 合成甲醇的热化学方程式为
合成甲醇的热化学方程式为(2)在某催化剂作用下,
 和
和 除发生反应i外,还发生反应ii.维持压强不变,按固定初始投料比将
除发生反应i外,还发生反应ii.维持压强不变,按固定初始投料比将 和
和 按一定流速通过该催化剂,经过相同时间测得实验数据:
按一定流速通过该催化剂,经过相同时间测得实验数据: |  实际转化率(%) 实际转化率(%) | 甲醇选择性(%) |
| 673 | 22.3 | 63.2 |
| 773 | 25.7 | 49.1 |
 中转化为甲醇的百分比。
中转化为甲醇的百分比。表中数据说明,升高温度,
 的实际转化率提高而甲醇的选择性降低,其原因是
的实际转化率提高而甲醇的选择性降低,其原因是(3)恒温恒压条件下(此时甲醇为气态),发生反应i(此时不考虑反应ii)。在开始为
 的密闭容器中充入
的密闭容器中充入 和
和 ,达平衡时
,达平衡时 的转化率为50%,则反应i的
的转化率为50%,则反应i的
(4)反应i可能的反应历程下图所示。

注:方框内包含微粒种类及数目、微粒的相对总能量(括号里的数字或字母,单位:
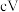 )。其中,
)。其中, 表示过渡态、*表示吸附在催化剂上的微粒。
表示过渡态、*表示吸附在催化剂上的微粒。①反应历程中,生成甲醇的快速步骤的反应方程式为
②相对总能量
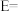
 (计算结果保留2位小数)。(已知:
(计算结果保留2位小数)。(已知: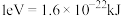 )
)(5)以纳米二氧化钛膜为工作电极,稀硫酸为电解质溶液,在一定条件下通入
 电解,在阴极可制得低密度聚乙烯
电解,在阴极可制得低密度聚乙烯 (简称
(简称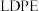 )。
)。①电解时,阴极的电极反应式是
②工业上生产
 的
的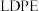 ,理论上需要标准状况下
,理论上需要标准状况下 。
。
您最近一年使用:0次



