1 .  的固定和利用对降低温室气体排放具有重要作用,
的固定和利用对降低温室气体排放具有重要作用, 加氢合成甲醇不仅可以有效缓解减排压力,而且还是
加氢合成甲醇不仅可以有效缓解减排压力,而且还是 综合利用的一条新途径。
综合利用的一条新途径。 加氢过程,主要发生的两个竞争反应为:
加氢过程,主要发生的两个竞争反应为:
i.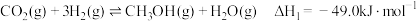
ii.
回答下列问题:
(1)由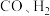 合成甲醇的热化学方程式为
合成甲醇的热化学方程式为___________ 。
(2)在某催化剂作用下, 和
和 除发生反应i外,还发生反应ii.维持压强不变,按固定初始投料比将
除发生反应i外,还发生反应ii.维持压强不变,按固定初始投料比将 和
和 按一定流速通过该催化剂,经过相同时间测得实验数据:
按一定流速通过该催化剂,经过相同时间测得实验数据:
注:甲醇的选择性是指发生反应的 中转化为甲醇的百分比。
中转化为甲醇的百分比。
表中数据说明,升高温度, 的实际转化率提高而甲醇的选择性降低,其原因是
的实际转化率提高而甲醇的选择性降低,其原因是___________ 。
(3)恒温恒压条件下(此时甲醇为气态),发生反应i(此时不考虑反应ii)。在开始为 的密闭容器中充入
的密闭容器中充入 和
和 ,达平衡时
,达平衡时 的转化率为50%,则反应i的
的转化率为50%,则反应i的
___________ 。
(4)反应i可能的反应历程下图所示。
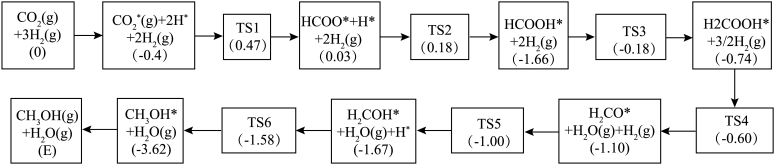
注:方框内包含微粒种类及数目、微粒的相对总能量(括号里的数字或字母,单位: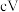 )。其中,
)。其中, 表示过渡态、*表示吸附在催化剂上的微粒。
表示过渡态、*表示吸附在催化剂上的微粒。
①反应历程中,生成甲醇的快速步骤的反应方程式为___________ 。
②相对总能量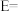
___________  (计算结果保留2位小数)。(已知:
(计算结果保留2位小数)。(已知: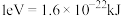 )
)
(5)以纳米二氧化钛膜为工作电极,稀硫酸为电解质溶液,在一定条件下通入 电解,在阴极可制得低密度聚乙烯
电解,在阴极可制得低密度聚乙烯 (简称
(简称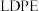 )。
)。
①电解时,阴极的电极反应式是___________ 。
②工业上生产 的
的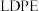 ,理论上需要标准状况下
,理论上需要标准状况下___________ L的 。
。
 的固定和利用对降低温室气体排放具有重要作用,
的固定和利用对降低温室气体排放具有重要作用, 加氢合成甲醇不仅可以有效缓解减排压力,而且还是
加氢合成甲醇不仅可以有效缓解减排压力,而且还是 综合利用的一条新途径。
综合利用的一条新途径。 加氢过程,主要发生的两个竞争反应为:
加氢过程,主要发生的两个竞争反应为:i.
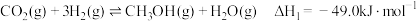
ii.

回答下列问题:
(1)由
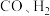 合成甲醇的热化学方程式为
合成甲醇的热化学方程式为(2)在某催化剂作用下,
 和
和 除发生反应i外,还发生反应ii.维持压强不变,按固定初始投料比将
除发生反应i外,还发生反应ii.维持压强不变,按固定初始投料比将 和
和 按一定流速通过该催化剂,经过相同时间测得实验数据:
按一定流速通过该催化剂,经过相同时间测得实验数据: |  实际转化率(%) 实际转化率(%) | 甲醇选择性(%) |
| 673 | 22.3 | 63.2 |
| 773 | 25.7 | 49.1 |
 中转化为甲醇的百分比。
中转化为甲醇的百分比。表中数据说明,升高温度,
 的实际转化率提高而甲醇的选择性降低,其原因是
的实际转化率提高而甲醇的选择性降低,其原因是(3)恒温恒压条件下(此时甲醇为气态),发生反应i(此时不考虑反应ii)。在开始为
 的密闭容器中充入
的密闭容器中充入 和
和 ,达平衡时
,达平衡时 的转化率为50%,则反应i的
的转化率为50%,则反应i的
(4)反应i可能的反应历程下图所示。

注:方框内包含微粒种类及数目、微粒的相对总能量(括号里的数字或字母,单位:
 )。其中,
)。其中, 表示过渡态、*表示吸附在催化剂上的微粒。
表示过渡态、*表示吸附在催化剂上的微粒。①反应历程中,生成甲醇的快速步骤的反应方程式为
②相对总能量
 (计算结果保留2位小数)。(已知:
(计算结果保留2位小数)。(已知: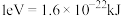 )
)(5)以纳米二氧化钛膜为工作电极,稀硫酸为电解质溶液,在一定条件下通入
 电解,在阴极可制得低密度聚乙烯
电解,在阴极可制得低密度聚乙烯 (简称
(简称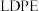 )。
)。①电解时,阴极的电极反应式是
②工业上生产
 的
的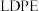 ,理论上需要标准状况下
,理论上需要标准状况下 。
。
您最近一年使用:0次
名校
解题方法
2 . 在298K、101kPa时,已知:



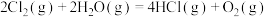

则 与
与 和
和 间的关系正确的是
间的关系正确的是




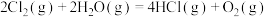

则
 与
与 和
和 间的关系正确的是
间的关系正确的是A.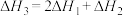 | B. |
C.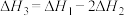 | D.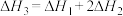 |
您最近一年使用:0次
2023-12-11更新
|
270次组卷
|
11卷引用:黑龙江省伊春市伊美区第二中学2021-2022学年高二上学期期中考试化学试题
黑龙江省伊春市伊美区第二中学2021-2022学年高二上学期期中考试化学试题广东省普宁市第二中学2021-2022学年高二上学期期中考试化学试题宁夏吴忠市盐池高级中学2019-2020学年高二上学期期末检测化学试题陕西省延安市富县高级中学2021-2022学年高一下学期期中考试化学试题天津市第二南开学校2022-2023学年度高二上学期期中质量调查化学试题广东省江门市鹤山市第一中学2022-2023学年高二上学期第二阶段考试化学试题贵州省黔西南布依族苗族自治州2022-2023学年高二上学期期末考试化学试题北京市第五十中学2023-2024学年高二上学期期中考试化学试题广东省广州市第三中学、第四中学、培正中学2023-2024学年高二上学期期中考试化学试题新疆兵团第三师图木舒克市鸿德实验学校2023-2024学年高二上学期第二次月考化学试题福建省龙岩市永定区城关中学2023-2024学年高二上学期期中考试化学试题
解题方法
3 . 利用反应A可将释放的CO2转化为具有工业利用价值的产品。
反应A:CO2+H2O CO+H2+O2
CO+H2+O2
已知:
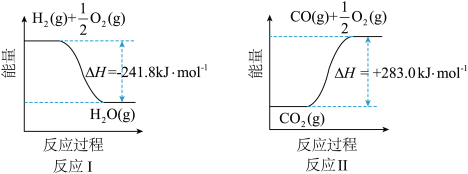
(1)反应Ⅱ是___________ 反应(填“吸热”或“放热”),其原因是___________ 。
(2)反应A的热化学方程式是___________ 。反应A的平衡常数表达式为___________ 。
反应A:CO2+H2O
 CO+H2+O2
CO+H2+O2已知:

(1)反应Ⅱ是
(2)反应A的热化学方程式是
您最近一年使用:0次
名校
解题方法
4 . 二甲醚(DME)被誉为“21世纪的清洁燃料”,由合成气制备二甲醚的主要原理如下:
①CO(g)+2H2(g) CH3OH(g) ΔH1=-90.7 kJ·mol-1 K1
CH3OH(g) ΔH1=-90.7 kJ·mol-1 K1
②2CH3OH(g) CH3OCH3(g)+H2O(g) ΔH2=-23.5 kJ·mol-1 K2
CH3OCH3(g)+H2O(g) ΔH2=-23.5 kJ·mol-1 K2
③CO(g)+H2O(g) CO2(g)+H2(g) ΔH3=-41.2 kJ·mol-1 K3
CO2(g)+H2(g) ΔH3=-41.2 kJ·mol-1 K3
回答下列问题:
(1)反应3H2(g)+3CO(g) CH3OCH3(g)+CO2(g)的ΔH=
CH3OCH3(g)+CO2(g)的ΔH=___________ kJ·mol-1;该反应的平衡常数K=___________ (用K1、K2、K3表示)。
(2)下列措施中,能提高(1)中CH3OCH3产率的有___________ 。
A.使用过量的CO B.升高温度 C.增大压强
(3)一定温度下,将0.2 mol CO和0.1 mol H2O(g)通入2 L恒容密闭容器中,发生反应③,5 min后达到化学平衡,平衡后测得H2的体积分数为0.1.则0~5 min内v(H2O)=___________ ,CO的转化率α(CO)=___________ 。
(4)将合成气以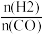 =2通入1 L的反应器中,一定条件下发生反应:4H2(g)+2CO(g)
=2通入1 L的反应器中,一定条件下发生反应:4H2(g)+2CO(g) CH3OCH3(g)+H2O(g) ΔH,其中CO的平衡转化率随温度、压强的变化关系如图1所示,下列说法正确的是
CH3OCH3(g)+H2O(g) ΔH,其中CO的平衡转化率随温度、压强的变化关系如图1所示,下列说法正确的是___________ (填字母)。
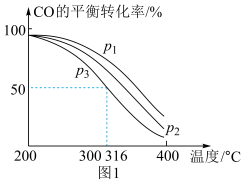
A.ΔH<0 B.p1>p2>p3 C.若在p3和316 ℃时,起始时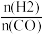 =3,则平衡时,α(CO)小于50%
=3,则平衡时,α(CO)小于50%
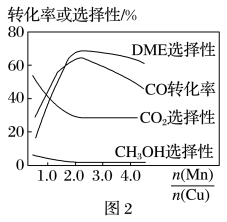
(5)采用一种新型的催化剂(主要成分是CuMn的合金),利用CO和H2制备二甲醚(DME)。观察图2,当 约为
约为___________ 时最有利于二甲醚的合成。
①CO(g)+2H2(g)
 CH3OH(g) ΔH1=-90.7 kJ·mol-1 K1
CH3OH(g) ΔH1=-90.7 kJ·mol-1 K1②2CH3OH(g)
 CH3OCH3(g)+H2O(g) ΔH2=-23.5 kJ·mol-1 K2
CH3OCH3(g)+H2O(g) ΔH2=-23.5 kJ·mol-1 K2③CO(g)+H2O(g)
 CO2(g)+H2(g) ΔH3=-41.2 kJ·mol-1 K3
CO2(g)+H2(g) ΔH3=-41.2 kJ·mol-1 K3回答下列问题:
(1)反应3H2(g)+3CO(g)
 CH3OCH3(g)+CO2(g)的ΔH=
CH3OCH3(g)+CO2(g)的ΔH=(2)下列措施中,能提高(1)中CH3OCH3产率的有
A.使用过量的CO B.升高温度 C.增大压强
(3)一定温度下,将0.2 mol CO和0.1 mol H2O(g)通入2 L恒容密闭容器中,发生反应③,5 min后达到化学平衡,平衡后测得H2的体积分数为0.1.则0~5 min内v(H2O)=
(4)将合成气以
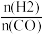 =2通入1 L的反应器中,一定条件下发生反应:4H2(g)+2CO(g)
=2通入1 L的反应器中,一定条件下发生反应:4H2(g)+2CO(g) CH3OCH3(g)+H2O(g) ΔH,其中CO的平衡转化率随温度、压强的变化关系如图1所示,下列说法正确的是
CH3OCH3(g)+H2O(g) ΔH,其中CO的平衡转化率随温度、压强的变化关系如图1所示,下列说法正确的是
A.ΔH<0 B.p1>p2>p3 C.若在p3和316 ℃时,起始时
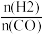 =3,则平衡时,α(CO)小于50%
=3,则平衡时,α(CO)小于50%(5)采用一种新型的催化剂(主要成分是CuMn的合金),利用CO和H2制备二甲醚(DME)。观察图2,当
 约为
约为
您最近一年使用:0次
2023-09-29更新
|
173次组卷
|
15卷引用:黑龙江省八校2021-2022学年高二上学期期中联合考试化学试题
黑龙江省八校2021-2022学年高二上学期期中联合考试化学试题吉林省长春外国语学校2021-2022学年高二上学期第一次月考化学试题山西省吕梁市柳林县2021-2022学年高二上学期期中考试化学试题黑龙江省佳木斯市第一中学2023-2024学年高二上学期10月月考化学试题山东省师范大学附属中学2019-2020学年高二上学期第五次学分认定考试化学试题山东省实验中学2019-2020学年高二上学期期中考试化学试题辽宁省六校协作体2020-2021学年高二上学期期中联考化学试题辽宁省铁岭市六校协作体2021-2022学年高一下学期期末联考化学试题第二章化学反应速率与化学平衡湖南省衡阳市田家炳实验中学2022-2023学年高二上学期9月月考化学试题重庆市璧山来凤中学2023-2024学年高二上学期9月月考化学试题广东省深圳市南山为明学校2023-2024学年高二上学期期中考试化学试题广东省深圳市罗湖外语学校2023-2024学年高二上学期期中考试化学试题陕西省西安市铁一中学2023-2024学年高二上学期期末考试化学试题湖南省长沙市周南中学2023-2024学年高二下学期第一次月考化学试题
解题方法
5 . 温室气体的利用是当前环境和能源领域的研究热点。 与
与 重整可以同时利用两种温室气体,其工艺过程中涉及如下反应:
重整可以同时利用两种温室气体,其工艺过程中涉及如下反应:
反应①
反应②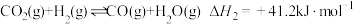
反应③
(1)已知: ,则
,则 =
=______  。
。
(2)一定条件下,向体积为VL的密闭容器中通入 、
、 各1mol及少量
各1mol及少量 ,测得不同温度下反应达到平衡时各产物的产量如图1所示。
,测得不同温度下反应达到平衡时各产物的产量如图1所示。

①图1中a和b分别代表产物______ 和______ ;当温度高于900K, 的产量随温度升高而下降的主要原因是
的产量随温度升高而下降的主要原因是__________ 。
②写出反应①的平衡常数K=___________ (写表达式)。
 与
与 重整可以同时利用两种温室气体,其工艺过程中涉及如下反应:
重整可以同时利用两种温室气体,其工艺过程中涉及如下反应:反应①

反应②
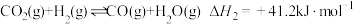
反应③

(1)已知:
 ,则
,则 =
= 。
。(2)一定条件下,向体积为VL的密闭容器中通入
 、
、 各1mol及少量
各1mol及少量 ,测得不同温度下反应达到平衡时各产物的产量如图1所示。
,测得不同温度下反应达到平衡时各产物的产量如图1所示。
①图1中a和b分别代表产物
 的产量随温度升高而下降的主要原因是
的产量随温度升高而下降的主要原因是②写出反应①的平衡常数K=
您最近一年使用:0次
解题方法
6 . 碳、氮是中学化学重要的非金属元素,在生产、生活中有广泛的应用。
(1)治理汽车尾气中NO和CO的一种方法是:在汽车的排气管道上安装一个催化转化装置,使NO与CO反应,产物都是空气中的主要成分。写出该反应的热化学方程式_______ 。
已知:①N2(g)+O2(g)=2NO(g) ∆H=+179.5kJ/mol
②2NO(g)+O2(g)=2NO2(g) ∆H=-112.3kJ/mol
③NO2(g)+CO(g)=NO(g)+CO2(g) ∆H=-234kJ/mol
(2)已知植物光合作用发生的反应如下:6CO2(g)+6H2O(l) C6H12O6(s)+6O2(g) ∆H=+669.62 kJ/mol;该反应达到化学平衡后,若改变下列条件,CO2转化率增大的是_______。
C6H12O6(s)+6O2(g) ∆H=+669.62 kJ/mol;该反应达到化学平衡后,若改变下列条件,CO2转化率增大的是_______。
(3)新的研究表明,可以将CO2转化为炭黑进行回收利用,反应原理如图所示。

①在转化过程中起催化作用的物质是_______ ;
②写出总反应的化学方程式_______ 。
(4)工业上以NH3和CO2为原料合成尿素[CO(NH2)2),反应的化学方程式如下:2NH3(g)+CO2(g)⇌CO(NH2)2(l)+H2O(l);根据上述反应,填写下列空白
①已知该反应可以自发进行,则∆H_______ 0。(填“>”、“<”或“=”);
②一定温度和压强下,若原料气中的NH3和CO2的物质的量之比 =x,如图是x与CO2的平衡转化率(α)的关系。α随着x增大而增大的原因是
=x,如图是x与CO2的平衡转化率(α)的关系。α随着x增大而增大的原因是_______ ;B点处,NH3的平衡转化率为_______ 。

③一定温度下,在3L定容密闭容器中充入NH3和CO2,若x=2,当反应后气体压强变为起始时气体压强的 时达到平衡,测得此时生成尿素90g。该反应的平衡常数K=
时达到平衡,测得此时生成尿素90g。该反应的平衡常数K=_______ 。
(1)治理汽车尾气中NO和CO的一种方法是:在汽车的排气管道上安装一个催化转化装置,使NO与CO反应,产物都是空气中的主要成分。写出该反应的热化学方程式
已知:①N2(g)+O2(g)=2NO(g) ∆H=+179.5kJ/mol
②2NO(g)+O2(g)=2NO2(g) ∆H=-112.3kJ/mol
③NO2(g)+CO(g)=NO(g)+CO2(g) ∆H=-234kJ/mol
(2)已知植物光合作用发生的反应如下:6CO2(g)+6H2O(l)
 C6H12O6(s)+6O2(g) ∆H=+669.62 kJ/mol;该反应达到化学平衡后,若改变下列条件,CO2转化率增大的是_______。
C6H12O6(s)+6O2(g) ∆H=+669.62 kJ/mol;该反应达到化学平衡后,若改变下列条件,CO2转化率增大的是_______。| A.增大CO2的浓度 | B.取走一半C6H12O6 | C.加入催化剂 | D.适当升高温度 |

①在转化过程中起催化作用的物质是
②写出总反应的化学方程式
(4)工业上以NH3和CO2为原料合成尿素[CO(NH2)2),反应的化学方程式如下:2NH3(g)+CO2(g)⇌CO(NH2)2(l)+H2O(l);根据上述反应,填写下列空白
①已知该反应可以自发进行,则∆H
②一定温度和压强下,若原料气中的NH3和CO2的物质的量之比
 =x,如图是x与CO2的平衡转化率(α)的关系。α随着x增大而增大的原因是
=x,如图是x与CO2的平衡转化率(α)的关系。α随着x增大而增大的原因是
③一定温度下,在3L定容密闭容器中充入NH3和CO2,若x=2,当反应后气体压强变为起始时气体压强的
 时达到平衡,测得此时生成尿素90g。该反应的平衡常数K=
时达到平衡,测得此时生成尿素90g。该反应的平衡常数K=
您最近一年使用:0次
7 . 控制CO2的排放是防止温室效应等不良气候现象产生的有效途径。
(1)高炉炼铁中用CO还原Fe2O3得到Fe,同时会排放大量的CO2和烟尘,必须进行严格的控制。已知:①C(石墨,s)+CO2(g)=2CO(g) ΔH=+172.5kJ⋅mol-1;②3C(石墨,s)+Fe2O3(s)=2Fe(s)+3CO(g) ΔH=+489.0kJ⋅mol-1,则CO还原Fe2O3的热化学方程式为___________ 。
(2)在恒温恒容密闭容器中充入一定量CO与Fe2O3发生该反应。
①以下能说明该可逆反应达到平衡状态的是___________ (选填字母)。
A.混合气体的密度不变 B.容器内气体压强一定
C.CO与CO2浓度比为1:1 D.Fe2O3与Fe的质量比不变
②当达到平衡后,再充入一定量CO,平衡___________ (填“正向”、“逆向”或“不”)移动,则达到新平衡后CO的转化率___________ (填“增大”、“减小”或“不变”)。
③下列措施中能使平衡时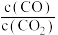 增大的是
增大的是___________ (填字母)。
A.升高温度 B.增大压强 C.充入一定量的CO2 D.再加入一定量铁粉
(3)可将炼铁产生的CO2与CH4反应得到气体燃料,其反应原理为:CO2(g)+CH4(g) 2CO(g)+2H2(g)。某小组向体积是1L的刚性密闭容器中充入物质的量均是1mol的CH4与CO2,反应过程中CO2的平衡转化率与温度、压强的关系如图所示。
2CO(g)+2H2(g)。某小组向体积是1L的刚性密闭容器中充入物质的量均是1mol的CH4与CO2,反应过程中CO2的平衡转化率与温度、压强的关系如图所示。
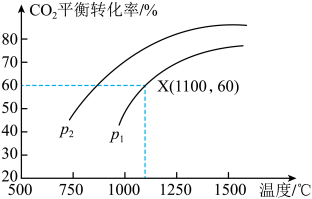
①压强:p1___________ p2(填“>”或“<”)。
②1100℃、p1条件下,20min时反应达到平衡状态,则0-20min内CO的反应速率V(CO)=___________ ,反应的平衡常数Kp=___________ (用含p1的代数式表示,Kp为以分压表示的平衡常数,分压=总压×物质的量分数);
(1)高炉炼铁中用CO还原Fe2O3得到Fe,同时会排放大量的CO2和烟尘,必须进行严格的控制。已知:①C(石墨,s)+CO2(g)=2CO(g) ΔH=+172.5kJ⋅mol-1;②3C(石墨,s)+Fe2O3(s)=2Fe(s)+3CO(g) ΔH=+489.0kJ⋅mol-1,则CO还原Fe2O3的热化学方程式为
(2)在恒温恒容密闭容器中充入一定量CO与Fe2O3发生该反应。
①以下能说明该可逆反应达到平衡状态的是
A.混合气体的密度不变 B.容器内气体压强一定
C.CO与CO2浓度比为1:1 D.Fe2O3与Fe的质量比不变
②当达到平衡后,再充入一定量CO,平衡
③下列措施中能使平衡时
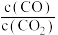 增大的是
增大的是A.升高温度 B.增大压强 C.充入一定量的CO2 D.再加入一定量铁粉
(3)可将炼铁产生的CO2与CH4反应得到气体燃料,其反应原理为:CO2(g)+CH4(g)
 2CO(g)+2H2(g)。某小组向体积是1L的刚性密闭容器中充入物质的量均是1mol的CH4与CO2,反应过程中CO2的平衡转化率与温度、压强的关系如图所示。
2CO(g)+2H2(g)。某小组向体积是1L的刚性密闭容器中充入物质的量均是1mol的CH4与CO2,反应过程中CO2的平衡转化率与温度、压强的关系如图所示。
①压强:p1
②1100℃、p1条件下,20min时反应达到平衡状态,则0-20min内CO的反应速率V(CO)=
您最近一年使用:0次
解题方法
8 . 回答问题:
(1)已知C(s、金刚石)+O2(g)=CO2(g) △H=-395.4 kJ·mol-1,C(s、石墨)+O2(g)=CO2(g) △H=-393.5 kJ·mol-1。则石墨中C-C键键能____ (填“大于”“小于”或“等于”)金刚石中C-C键键能。
(2)已知下列反应的反应热:
CH4(g)+H2O(g)=CO(g)+3H2(g) △H1=+206.2 kJ·mol-1
CH4(g)+CO2(g)=2CO(g)+2H2(g) △H2=-247.4 kJ·mol-1
则CH4(g)与H2O(g)反应生成CO2(g)和H2(g)的热化学方程式为____ 。
(1)已知C(s、金刚石)+O2(g)=CO2(g) △H=-395.4 kJ·mol-1,C(s、石墨)+O2(g)=CO2(g) △H=-393.5 kJ·mol-1。则石墨中C-C键键能
(2)已知下列反应的反应热:
CH4(g)+H2O(g)=CO(g)+3H2(g) △H1=+206.2 kJ·mol-1
CH4(g)+CO2(g)=2CO(g)+2H2(g) △H2=-247.4 kJ·mol-1
则CH4(g)与H2O(g)反应生成CO2(g)和H2(g)的热化学方程式为
您最近一年使用:0次
9 . 请按要求回答下列问题。
(1)写出下列物质在水溶液中的电离方程式
①HClO:_______ ;
②H2SO3:_______ ;
③NaHCO3:_______ ;
④Cu(OH)2:_______ 。
(2)已知拆开1 mol H—H键、1 mol N—H键、1 mol N≡N键分别需要的能量是436 kJ、391 kJ、946 kJ,则N2与H2反应生成NH3的热化学方程式为_______ 。
(3)在25 ℃、101 kPa时,H2在O2中完全燃烧生成2.00 mol H2O(l)放出571.6 kJ的热量,表示H2燃烧热的热化学方程式为_______ 。
(4)高炉冶铁过程中,甲烷在催化反应室中产生水煤气(CO和H2)还原氧化铁,有关反应为:CH4(g)+CO2(g)=2CO(g)+2H2(g) ΔH=+260 kJ·mol-1①
已知:2CO(g)+O2(g)=2CO2(g) ΔH=-566 kJ·mol-1②
则CH4与O2反应生成CO和H2的热化学方程式为_______ 。
(1)写出下列物质在水溶液中的电离方程式
①HClO:
②H2SO3:
③NaHCO3:
④Cu(OH)2:
(2)已知拆开1 mol H—H键、1 mol N—H键、1 mol N≡N键分别需要的能量是436 kJ、391 kJ、946 kJ,则N2与H2反应生成NH3的热化学方程式为
(3)在25 ℃、101 kPa时,H2在O2中完全燃烧生成2.00 mol H2O(l)放出571.6 kJ的热量,表示H2燃烧热的热化学方程式为
(4)高炉冶铁过程中,甲烷在催化反应室中产生水煤气(CO和H2)还原氧化铁,有关反应为:CH4(g)+CO2(g)=2CO(g)+2H2(g) ΔH=+260 kJ·mol-1①
已知:2CO(g)+O2(g)=2CO2(g) ΔH=-566 kJ·mol-1②
则CH4与O2反应生成CO和H2的热化学方程式为
您最近一年使用:0次
解题方法
10 . 请回答下列问题。
(1)液氨作为一种潜在的清洁汽车燃料已越来越被研究人员重视。它在安全性、价格等方面较化石燃料和氢燃料有着较大的优势。氨的燃烧实验涉及下列两个相关的反应:
①4NH3(g)+5O2(g)=4NO(g)+6H2O(l) ΔH1
②4NH3(g)+6NO(g)=5N2(g)+6H2O(l) ΔH2
则反应 4NH3(g)+3O2(g)=2N2(g)+6H2O(l) ΔH=_______ (请用含有ΔH1、ΔH2的式子表示)。
(2)若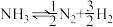 K=a,则N2+3H2
K=a,则N2+3H2 2NH3 K′=
2NH3 K′=_______ (用含a的式子表示)。
(3)在体积为3 L的恒容密闭容器中,进行合成氨N2+3H2 2NH3实验,投入4 mol N2和9 mol H2在一定条件下合成氨,平衡时仅改变温度测得的数据如表所示:
2NH3实验,投入4 mol N2和9 mol H2在一定条件下合成氨,平衡时仅改变温度测得的数据如表所示:
已知:破坏1 mol N2(g)和3 mol H2(g)中的化学键消耗的总能量小于破坏2 mol NH3(g)中的化学键消耗的能量。
①则T1_______ (填“>”“<”或“=”)T2。
②在T2下,经过10 min达到化学平衡状态,平衡时N2的转化率α(N2)=_______ 和K =_______ (分数表示)。
③下列图象分别代表焓变(ΔH)、混合气体平均相对分子质量(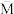 )、N2的体积分数[φ(N2)]和气体密度(ρ)与反应时间的关系,其中正确且能表明该可逆反应达到平衡状态的是
)、N2的体积分数[φ(N2)]和气体密度(ρ)与反应时间的关系,其中正确且能表明该可逆反应达到平衡状态的是_______ (填字母)。
A.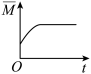 B.
B. 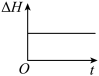 C.
C. 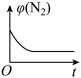 D.
D. 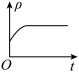
(1)液氨作为一种潜在的清洁汽车燃料已越来越被研究人员重视。它在安全性、价格等方面较化石燃料和氢燃料有着较大的优势。氨的燃烧实验涉及下列两个相关的反应:
①4NH3(g)+5O2(g)=4NO(g)+6H2O(l) ΔH1
②4NH3(g)+6NO(g)=5N2(g)+6H2O(l) ΔH2
则反应 4NH3(g)+3O2(g)=2N2(g)+6H2O(l) ΔH=
(2)若
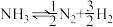 K=a,则N2+3H2
K=a,则N2+3H2 2NH3 K′=
2NH3 K′=(3)在体积为3 L的恒容密闭容器中,进行合成氨N2+3H2
 2NH3实验,投入4 mol N2和9 mol H2在一定条件下合成氨,平衡时仅改变温度测得的数据如表所示:
2NH3实验,投入4 mol N2和9 mol H2在一定条件下合成氨,平衡时仅改变温度测得的数据如表所示:| 温度/K | 平衡时NH3的物质的量/mol |
| T1 | 2.4 |
| T2 | 2.0 |
①则T1
②在T2下,经过10 min达到化学平衡状态,平衡时N2的转化率α(N2)=
③下列图象分别代表焓变(ΔH)、混合气体平均相对分子质量(
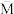 )、N2的体积分数[φ(N2)]和气体密度(ρ)与反应时间的关系,其中正确且能表明该可逆反应达到平衡状态的是
)、N2的体积分数[φ(N2)]和气体密度(ρ)与反应时间的关系,其中正确且能表明该可逆反应达到平衡状态的是A.
 B.
B.  C.
C.  D.
D. 
您最近一年使用:0次



