名校
解题方法
1 . 石油产品中含有H2S及COS、CH3SH等多种有机硫,石油化工催生出多种脱硫技术。请回答下列问题:
(1)已知热化学方程式:①2H2S(g)+SO2(g)=3S(s)+2H2O(l) ∆H1=−362kJ∙mol−1
②2H2S(g)+3O2(g)=2SO2(g)+2H2O(l) ∆H2=−1172kJ∙mol−1
则H2S气体和氧气反应生成固态硫和液态水的热化学方程式为___________ 。
(2)可以用K2CO3溶液吸收H2S,其原理K2CO3+H2S⇌KHS+KHCO3,该反应的平衡常数为___________ (已知H2CO3的Ka1=4.2×10−7,Ka2=5.6×10−11;H2S的Ka1=5.6×10−8,Ka2=1.2×10−15)
(3)在强酸溶液中用H2O2可将COS氧化为硫酸,这一原理可用于COS的脱硫。该反应反应的化学方程式为___________ 。
(4)一定温度下在恒容的密闭容器中发生可逆反应为COS(g)+H2O(g)⇌CO2(g)+H2S(g) ∆H<0.能判断该反应一定达到化学平衡状态的依据是___________(填选项编号)。
(5)某温度时,反应COS(g)+H2O(g)⇌CO2(g)+H2S(g)△H<0用活性α−Al2O3作催化剂,在恒容密闭容器中COS(g)的平衡转化率随不同投料比[n(H2O)/n(COS)]的转化关系如图1所示。
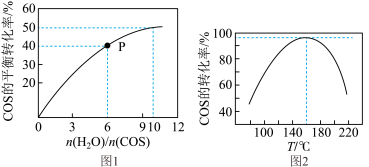
其它条件相同,改变反应温度,测得一定时间内COS水解转化率如图2所示
①该反应的最佳条件为:投料比[n(H2O)/n(COS)]___________ ,温度___________
②P点对应的平衡常数为___________ 。(保留小数点后2位)
③当温度升高到一定值后,发现一定时间内COS(g)的水解转化率降低;猜测可能的原因是___________ (写出两条)
(1)已知热化学方程式:①2H2S(g)+SO2(g)=3S(s)+2H2O(l) ∆H1=−362kJ∙mol−1
②2H2S(g)+3O2(g)=2SO2(g)+2H2O(l) ∆H2=−1172kJ∙mol−1
则H2S气体和氧气反应生成固态硫和液态水的热化学方程式为
(2)可以用K2CO3溶液吸收H2S,其原理K2CO3+H2S⇌KHS+KHCO3,该反应的平衡常数为
(3)在强酸溶液中用H2O2可将COS氧化为硫酸,这一原理可用于COS的脱硫。该反应反应的化学方程式为
(4)一定温度下在恒容的密闭容器中发生可逆反应为COS(g)+H2O(g)⇌CO2(g)+H2S(g) ∆H<0.能判断该反应一定达到化学平衡状态的依据是___________(填选项编号)。
| A.容器中气体的压强不随时间而变化 | B.v正(H2O)=v逆(H2S) |
| C.容器中气体的密度不随时间而变化 | D.消耗n molH2O的同时消耗n molCO2 |

其它条件相同,改变反应温度,测得一定时间内COS水解转化率如图2所示
①该反应的最佳条件为:投料比[n(H2O)/n(COS)]
②P点对应的平衡常数为
③当温度升高到一定值后,发现一定时间内COS(g)的水解转化率降低;猜测可能的原因是
您最近一年使用:0次
2 . 我国力争于2030年前做到碳达峰,2060年前实现碳中和。因此,研发二氧化碳利用技术,降低空气中二氧化碳含量成为研究热点。以CO2、H2为原料合成CH3OH涉及的主要反应如下:
Ⅰ.

Ⅱ.
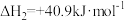
回答下列问题:
(1)已知
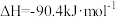 ,请计算
,请计算
_______ 。
(2)在恒温恒容的容器中发生上述反应,下列说法正确的有_______。
(3)研究表明:其他条件相同的情况下,用新型催化剂可以显著提高甲醇的选择性。使用该催化剂,将1molCO2和2.44molH2在1L密闭容器中进行反应,CO2的平衡转化率和甲醇的选择率(甲醇的选择率:转化的CO2中生成甲醇的物质的量分数)随温度的变化趋势如图所示:
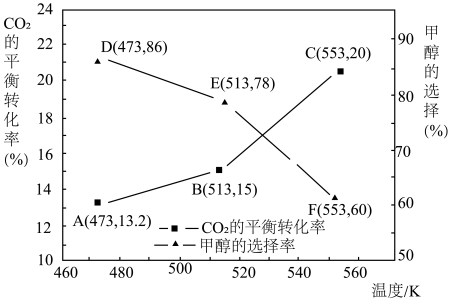
①温度为553K,经10min体系达到平衡,则CO2的平均反应速率为_______ 。
②随着温度的升高,CO2的平衡转化率增加但甲醇的选择率降低,分析其原因_______ 。
(4)以某甲醇燃料电池为电源,回收普通干电池中锌与MnO2,其工作原理如图所示,质子交换膜左右两侧的溶液均为1L2mol/LH2SO4溶液。
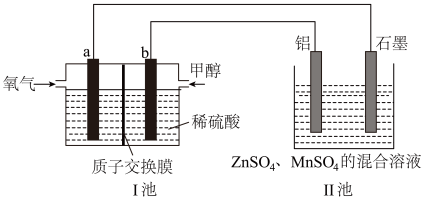
①通入甲醇的电极反应式为_______ ,a电极和石墨电极的电子流向为_______ ,(填“a到石墨”或“石墨到a”),当导线中有2mole-发生转移时,I池的左右两侧溶液的质量差为_______ g(假设反应物耗尽,忽略气体的溶解)。
②II池中回收锌与MnO2的总反应的离子方程式为_______ 。
③若燃料电池中负极消耗4.8g甲醇,且均完全转化为电能,电解池中回收制得19.5g单质Zn,该装置的电流效率η=_______ 。(保留2位小数)(η=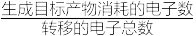 ×100%)
×100%)
Ⅰ.


Ⅱ.

回答下列问题:
(1)已知

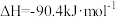 ,请计算
,请计算
(2)在恒温恒容的容器中发生上述反应,下列说法正确的有_______。
| A.气体平均摩尔质量保持不变,反应体系已达平衡 |
| B.加入催化剂,可提高CO2的平衡转化率 |
| C.平衡后缩小体积增大体系压强,有利于提高CH3OH产率 |
| D.平衡后升高温度,反应Ⅱ的正反应速率增大、逆反应速率减小,平衡正移 |

①温度为553K,经10min体系达到平衡,则CO2的平均反应速率为
②随着温度的升高,CO2的平衡转化率增加但甲醇的选择率降低,分析其原因
(4)以某甲醇燃料电池为电源,回收普通干电池中锌与MnO2,其工作原理如图所示,质子交换膜左右两侧的溶液均为1L2mol/LH2SO4溶液。

①通入甲醇的电极反应式为
②II池中回收锌与MnO2的总反应的离子方程式为
③若燃料电池中负极消耗4.8g甲醇,且均完全转化为电能,电解池中回收制得19.5g单质Zn,该装置的电流效率η=
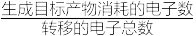 ×100%)
×100%)
您最近一年使用:0次
解题方法
3 . 氧和氮是大气的主要成分,氮的化合物在工业上均有重要的应用。
(1)根据下列反应写出由热化学循环在较低温度下由水分解制备氢气的热化学方程式:___ 。
H2SO4(aq)=SO2(g)+H2O(l)+ O2(g) ΔH1=+327kJ·mol-1
O2(g) ΔH1=+327kJ·mol-1
SO2(g)+I2(s)+2H2O(l)=2HI(aq)+H2SO4(aq) ΔH2=-151kJ·mol-1
2HI(aq)=H2(g)+I2(s) ΔH3=+110kJ·mol-1
(2)在恒容密闭容器中,发生反应N2(g)+3H2(g) 2NH3(g),下列说法可以证明反应已达到平衡状态的是
2NH3(g),下列说法可以证明反应已达到平衡状态的是___ (填序号)。
①单位时间内生成nmolN2的同时生成2nmolNH3
②1个N≡N键断裂的同时,有6个N—H键形成
③1个N≡N键断裂的同时,有3个H—H键形成
④混合气体的密度不再改变的状态
⑤混合气体的压强不再改变的状态
⑥混合气体的平均相对分子质量不再改变的状态
为提高H2的转化率,实际生产中宜采取的措施是___ (填字母)。
A.及时移出氨 B.适当增大压强 C.循环利用和不断补充氮气 D.减小压强 E.降低温度
(3)电厂烟气脱氮的主反应①:4NH3(g)+6NO(g) 5N2(g)+6H2O(g),副反应②:2NH3(g)+8NO(g)
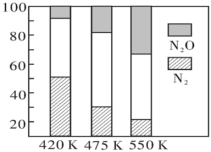
5N2(g)+6H2O(g),副反应②:2NH3(g)+8NO(g) 5N2O(g)+3H2O(g)。平衡混合气中N2与N2O含量与温度的关系如图,请解释在400~600K时,平衡混合气中这两种气体的含量随温度的变化而改变的原因是
5N2O(g)+3H2O(g)。平衡混合气中N2与N2O含量与温度的关系如图,请解释在400~600K时,平衡混合气中这两种气体的含量随温度的变化而改变的原因是__ 。
(4)肼(N2H4)是一种重要的化工原料,既可用于制药,又可用作火箭燃料。向2L的恒容密闭容器中充入2molN2H4,发生反应N2H4(g) N2(g)+2H2(g),
N2(g)+2H2(g), (用x表示)与时间的关系如图1所示,则该温度下,此反应的平衡常数K=
(用x表示)与时间的关系如图1所示,则该温度下,此反应的平衡常数K=__ 。

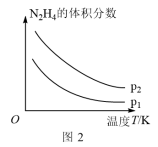
(5)肼在另一条件下也可达到分解平衡,同时生成两种气体,且其中一种气体能使湿润的红色石蕊试纸变蓝。图2为平衡体系中肼的体积分数与温度、压强的关系,则p2___ (填“大于”或“小于”)p1。
(1)根据下列反应写出由热化学循环在较低温度下由水分解制备氢气的热化学方程式:
H2SO4(aq)=SO2(g)+H2O(l)+
 O2(g) ΔH1=+327kJ·mol-1
O2(g) ΔH1=+327kJ·mol-1SO2(g)+I2(s)+2H2O(l)=2HI(aq)+H2SO4(aq) ΔH2=-151kJ·mol-1
2HI(aq)=H2(g)+I2(s) ΔH3=+110kJ·mol-1
(2)在恒容密闭容器中,发生反应N2(g)+3H2(g)
 2NH3(g),下列说法可以证明反应已达到平衡状态的是
2NH3(g),下列说法可以证明反应已达到平衡状态的是①单位时间内生成nmolN2的同时生成2nmolNH3
②1个N≡N键断裂的同时,有6个N—H键形成
③1个N≡N键断裂的同时,有3个H—H键形成
④混合气体的密度不再改变的状态
⑤混合气体的压强不再改变的状态
⑥混合气体的平均相对分子质量不再改变的状态
为提高H2的转化率,实际生产中宜采取的措施是
A.及时移出氨 B.适当增大压强 C.循环利用和不断补充氮气 D.减小压强 E.降低温度
(3)电厂烟气脱氮的主反应①:4NH3(g)+6NO(g)
 5N2(g)+6H2O(g),副反应②:2NH3(g)+8NO(g)
5N2(g)+6H2O(g),副反应②:2NH3(g)+8NO(g) 5N2O(g)+3H2O(g)。平衡混合气中N2与N2O含量与温度的关系如图,请解释在400~600K时,平衡混合气中这两种气体的含量随温度的变化而改变的原因是
5N2O(g)+3H2O(g)。平衡混合气中N2与N2O含量与温度的关系如图,请解释在400~600K时,平衡混合气中这两种气体的含量随温度的变化而改变的原因是
(4)肼(N2H4)是一种重要的化工原料,既可用于制药,又可用作火箭燃料。向2L的恒容密闭容器中充入2molN2H4,发生反应N2H4(g)
 N2(g)+2H2(g),
N2(g)+2H2(g), (用x表示)与时间的关系如图1所示,则该温度下,此反应的平衡常数K=
(用x表示)与时间的关系如图1所示,则该温度下,此反应的平衡常数K=
(5)肼在另一条件下也可达到分解平衡,同时生成两种气体,且其中一种气体能使湿润的红色石蕊试纸变蓝。图2为平衡体系中肼的体积分数与温度、压强的关系,则p2

您最近一年使用:0次
名校
解题方法
4 . 工业上常用 作还原剂还原铁矿石制得铁单质,实验室中可以用
作还原剂还原铁矿石制得铁单质,实验室中可以用 还原
还原 制得铁粉。
制得铁粉。
已知:①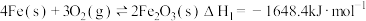
②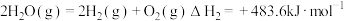
③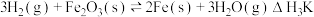
(1)
___________
(2) 可以用碳和水蒸气反应制取,反应的热化学方程式为
可以用碳和水蒸气反应制取,反应的热化学方程式为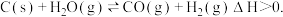 一定条件下该反应达到平衡时,温度、压强对
一定条件下该反应达到平衡时,温度、压强对 产率的影响如图
产率的影响如图 所示。
所示。
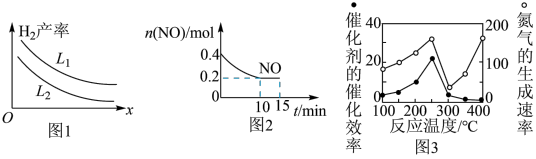
① 表示
表示 ___________ (填“温度”或“压强”); L1___________ L2 (填“ ”、“
”、“ ”或“
”或“ ”)。
”)。
②在一恒容绝热容器中加入一定量的C(s)和 发生反应:
发生反应: ,下列物理量不再改变时一定能说明反应达到平衡状态的是
,下列物理量不再改变时一定能说明反应达到平衡状态的是 ___________ 。(填标号)
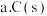 的质量
的质量 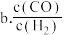
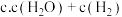
(3)实验证明用活性炭还原法能处理氮的氧化物,有关反应为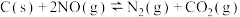 。某研究小组向某
。某研究小组向某 密闭容器中加入足量的活性炭和一定量的
密闭容器中加入足量的活性炭和一定量的 ,保持温度和体积不变,反应过程
,保持温度和体积不变,反应过程 中
中 的物质的量随时间的变化如图
的物质的量随时间的变化如图 所示。
所示。
①从反应开始到 时,以
时,以 表示的平均反应速率
表示的平均反应速率
___________ 。该温度时反应的平衡常数
___________ 。
②固定压强为 ,在不同温度下催化剂的催化效率与氮气的生成速率的关系如图
,在不同温度下催化剂的催化效率与氮气的生成速率的关系如图 所示。当氮气的生成速率主要取决于温度时,其影响范围是
所示。当氮气的生成速率主要取决于温度时,其影响范围是 ___________ 。
 作还原剂还原铁矿石制得铁单质,实验室中可以用
作还原剂还原铁矿石制得铁单质,实验室中可以用 还原
还原 制得铁粉。
制得铁粉。已知:①
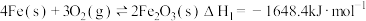
②
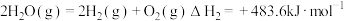
③
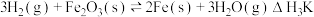
(1)

(2)
 可以用碳和水蒸气反应制取,反应的热化学方程式为
可以用碳和水蒸气反应制取,反应的热化学方程式为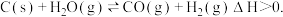 一定条件下该反应达到平衡时,温度、压强对
一定条件下该反应达到平衡时,温度、压强对 产率的影响如图
产率的影响如图 所示。
所示。
①
 表示
表示  ”、“
”、“ ”或“
”或“ ”)。
”)。②在一恒容绝热容器中加入一定量的C(s)和
 发生反应:
发生反应: ,下列物理量不再改变时一定能说明反应达到平衡状态的是
,下列物理量不再改变时一定能说明反应达到平衡状态的是 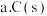 的质量
的质量 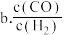
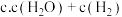
(3)实验证明用活性炭还原法能处理氮的氧化物,有关反应为
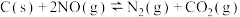 。某研究小组向某
。某研究小组向某 密闭容器中加入足量的活性炭和一定量的
密闭容器中加入足量的活性炭和一定量的 ,保持温度和体积不变,反应过程
,保持温度和体积不变,反应过程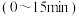 中
中 的物质的量随时间的变化如图
的物质的量随时间的变化如图 所示。
所示。①从反应开始到
 时,以
时,以 表示的平均反应速率
表示的平均反应速率

②固定压强为
 ,在不同温度下催化剂的催化效率与氮气的生成速率的关系如图
,在不同温度下催化剂的催化效率与氮气的生成速率的关系如图 所示。当氮气的生成速率主要取决于温度时,其影响范围是
所示。当氮气的生成速率主要取决于温度时,其影响范围是
您最近一年使用:0次
名校
5 . 碳和碳的化合物在生产、生活中有重要作用,甲醇水蒸气重整制氢系统可能发生下列三个反应:
①CH3OH(g) CO(g)+2H2(g) ΔH1=+90.8kJ·mol-1
CO(g)+2H2(g) ΔH1=+90.8kJ·mol-1
②CH3OH(g)+H2O(g) CO2(g)+3H2(g)ΔH2=+49kJ·mol-1
CO2(g)+3H2(g)ΔH2=+49kJ·mol-1
③CO(g)+H2O(g) CO2(g)+H2(g) ΔH3
CO2(g)+H2(g) ΔH3
请回答下列问题:
(1)ΔH3=___________ 。
(2)温度升高对反应②的影响是___________ 。
(3)控制反应在温度T,压强P0KPa条件下,反应①中的产物也可以用来合成甲醇和二甲醚,其中合成二甲醚的化学方程式为:3H2(g)+3CO(g) CH3OCH3(g)+CO2(g),在相同条件下合成二甲醚和合成甲醇的原料平衡转化率随氢碳比
CH3OCH3(g)+CO2(g),在相同条件下合成二甲醚和合成甲醇的原料平衡转化率随氢碳比 的变化如图所示:
的变化如图所示:
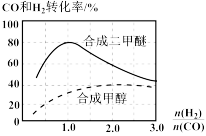
①对于气相反应,用某组分B的平衡分压pB代替物质的量浓度c(B)也可以表示平衡常数(记作Kp),水煤气合成二甲醚反应的平衡常数Kp表达式为___________ 。
②合成二甲醚的最佳氢碳比为___________ 。在此种氢碳比下,Kp=___________
③氢碳比 越大越不利于合成二甲醚的原因:
越大越不利于合成二甲醚的原因:___________ 。
①CH3OH(g)
 CO(g)+2H2(g) ΔH1=+90.8kJ·mol-1
CO(g)+2H2(g) ΔH1=+90.8kJ·mol-1②CH3OH(g)+H2O(g)
 CO2(g)+3H2(g)ΔH2=+49kJ·mol-1
CO2(g)+3H2(g)ΔH2=+49kJ·mol-1③CO(g)+H2O(g)
 CO2(g)+H2(g) ΔH3
CO2(g)+H2(g) ΔH3请回答下列问题:
(1)ΔH3=
(2)温度升高对反应②的影响是
(3)控制反应在温度T,压强P0KPa条件下,反应①中的产物也可以用来合成甲醇和二甲醚,其中合成二甲醚的化学方程式为:3H2(g)+3CO(g)
 CH3OCH3(g)+CO2(g),在相同条件下合成二甲醚和合成甲醇的原料平衡转化率随氢碳比
CH3OCH3(g)+CO2(g),在相同条件下合成二甲醚和合成甲醇的原料平衡转化率随氢碳比 的变化如图所示:
的变化如图所示:
①对于气相反应,用某组分B的平衡分压pB代替物质的量浓度c(B)也可以表示平衡常数(记作Kp),水煤气合成二甲醚反应的平衡常数Kp表达式为
②合成二甲醚的最佳氢碳比为
③氢碳比
 越大越不利于合成二甲醚的原因:
越大越不利于合成二甲醚的原因:
您最近一年使用:0次
名校
解题方法
6 . 页岩气是从页岩层中开采的一种非常重要的天然气资源,页岩气的主要成分是甲烷,是公认的洁净能源。
(1)页岩气不仅能用作燃料,还可用于生产合成气(CO和 ),
), 与
与 通入聚焦太阳能反应器,发生反应
通入聚焦太阳能反应器,发生反应
 。已知:
。已知:
①

②

③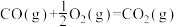

则
___________ (用含 、
、 、
、 的代数式表示)
的代数式表示)
(2)用合成气生成甲醇的反应为
 ,在10L恒容密闭容器中按物质的量之比1:2充入CO和
,在10L恒容密闭容器中按物质的量之比1:2充入CO和 ,测得CO的平衡转化率与温度和压强的关系如图所示:
,测得CO的平衡转化率与温度和压强的关系如图所示:
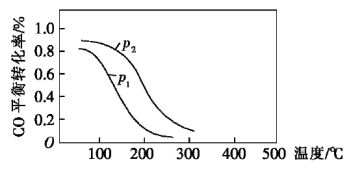
200℃时 随时间的变化如下表所示:
随时间的变化如下表所示:
①该反应的平衡常数表达式为
___________ ;
___________ (填“>”“<”或“=”)0。
②写出一条可同时提高反应速率和CO转化率的措施:___________ 。
③下列说法正确的是___________ (填字母)。
a.温度越高,该反应的平衡常数越大
b.达平衡后再充入稀有气体,CO的转化率提高
c.容器内气体压强不再变化时,反应达到最大限度
d.图中压强: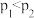
④0~1min内用 表示的反应速率
表示的反应速率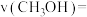
___________  。
。
⑤向上述200℃达到平衡的恒容密闭容器中再加入2 mol CO、4 mol 、2 mol
、2 mol  ,保持温度不变,则化学平衡
,保持温度不变,则化学平衡___________ (填“正向”“逆向”或“不”)移动。
(3)甲烷、氧气和KOH溶液可组成燃料电池。充入22.4L(折算为标准状况下)甲烷,测得电路中转移5.6mol电子,则甲烷的利用率为___________ 。
(1)页岩气不仅能用作燃料,还可用于生产合成气(CO和
 ),
), 与
与 通入聚焦太阳能反应器,发生反应
通入聚焦太阳能反应器,发生反应
 。已知:
。已知:①


②


③
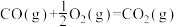

则

 、
、 、
、 的代数式表示)
的代数式表示)(2)用合成气生成甲醇的反应为

 ,在10L恒容密闭容器中按物质的量之比1:2充入CO和
,在10L恒容密闭容器中按物质的量之比1:2充入CO和 ,测得CO的平衡转化率与温度和压强的关系如图所示:
,测得CO的平衡转化率与温度和压强的关系如图所示:
200℃时
 随时间的变化如下表所示:
随时间的变化如下表所示:| t/min | 0 | 1 | 3 | 5 |
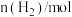 | 8.0 | 5.4 | 4.0 | 4.0 |
①该反应的平衡常数表达式为


②写出一条可同时提高反应速率和CO转化率的措施:
③下列说法正确的是
a.温度越高,该反应的平衡常数越大
b.达平衡后再充入稀有气体,CO的转化率提高
c.容器内气体压强不再变化时,反应达到最大限度
d.图中压强:
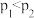
④0~1min内用
 表示的反应速率
表示的反应速率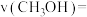
 。
。⑤向上述200℃达到平衡的恒容密闭容器中再加入2 mol CO、4 mol
 、2 mol
、2 mol  ,保持温度不变,则化学平衡
,保持温度不变,则化学平衡(3)甲烷、氧气和KOH溶液可组成燃料电池。充入22.4L(折算为标准状况下)甲烷,测得电路中转移5.6mol电子,则甲烷的利用率为
您最近一年使用:0次
2021-11-23更新
|
222次组卷
|
3卷引用:黑龙江省哈尔滨市第一中学校 2021-2022学年高三上学期期末考试理综化学试题
名校
7 . 用 代替
代替 与燃料CO反应,既可以提高燃烧效率,又能得到高纯
与燃料CO反应,既可以提高燃烧效率,又能得到高纯 ,是一种高效、清洁、经济的新型燃烧技术,反应①为主反应,反应②和③为副反应。
,是一种高效、清洁、经济的新型燃烧技术,反应①为主反应,反应②和③为副反应。
①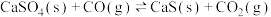
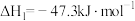
②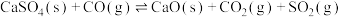
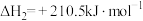
③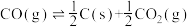
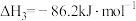
(1)反应①~③的平衡常数的对数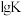 随反应温度T的变化曲线如图中所示,图中曲线b对应反应
随反应温度T的变化曲线如图中所示,图中曲线b对应反应___________ (填①、②或③,判断依据是___________ 。
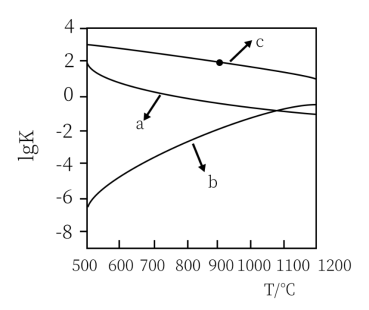
(2)反应①的
___________ (用表达式表示)。向盛有 的真空恒容容器中充入CO,反应①于900℃达到平衡,平衡时测得
的真空恒容容器中充入CO,反应①于900℃达到平衡,平衡时测得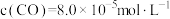 ,结合上图曲线c中相关数据,计算CO的平衡转化率为
,结合上图曲线c中相关数据,计算CO的平衡转化率为___________ (忽略副反应,结果保留2位有效数字)。
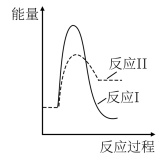
(3)假设某温度下,反应②的速率( )大于反应①的速率(
)大于反应①的速率( ),则下列反应过程能量变化示意图正确的是
),则下列反应过程能量变化示意图正确的是___________ 。
(4)恒温恒容条件下,假设反应①和②同时发生,且 ,则反应体系中
,则反应体系中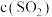 随时间t变化的趋势为
随时间t变化的趋势为___________ 。
 代替
代替 与燃料CO反应,既可以提高燃烧效率,又能得到高纯
与燃料CO反应,既可以提高燃烧效率,又能得到高纯 ,是一种高效、清洁、经济的新型燃烧技术,反应①为主反应,反应②和③为副反应。
,是一种高效、清洁、经济的新型燃烧技术,反应①为主反应,反应②和③为副反应。①
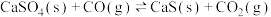
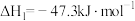
②
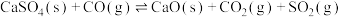
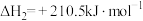
③
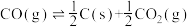
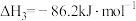
(1)反应①~③的平衡常数的对数
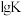 随反应温度T的变化曲线如图中所示,图中曲线b对应反应
随反应温度T的变化曲线如图中所示,图中曲线b对应反应
(2)反应①的

 的真空恒容容器中充入CO,反应①于900℃达到平衡,平衡时测得
的真空恒容容器中充入CO,反应①于900℃达到平衡,平衡时测得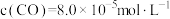 ,结合上图曲线c中相关数据,计算CO的平衡转化率为
,结合上图曲线c中相关数据,计算CO的平衡转化率为(3)假设某温度下,反应②的速率(
 )大于反应①的速率(
)大于反应①的速率( ),则下列反应过程能量变化示意图正确的是
),则下列反应过程能量变化示意图正确的是| A | B | C | D |
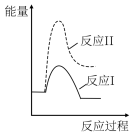 | 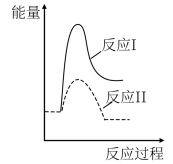 | 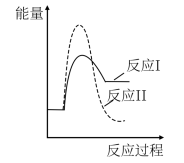 |  |
(4)恒温恒容条件下,假设反应①和②同时发生,且
 ,则反应体系中
,则反应体系中 随时间t变化的趋势为
随时间t变化的趋势为
您最近一年使用:0次
名校
8 . 已知热化学方程式: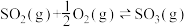
 ,向容器中充入4mol
,向容器中充入4mol 和4mol
和4mol ,当放出157.15kJ热量时,
,当放出157.15kJ热量时, 的转化率最接近于
的转化率最接近于
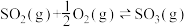
 ,向容器中充入4mol
,向容器中充入4mol 和4mol
和4mol ,当放出157.15kJ热量时,
,当放出157.15kJ热量时, 的转化率最接近于
的转化率最接近于| A.40% | B.50% | C.80% | D.90% |
您最近一年使用:0次
名校
9 . 当今,世界多国相继规划了碳达峰、碳中和的时间节点。因此,研发二氧化碳利用技术,降低空气中二氧化碳含量成为研究热点。
(1)大气中的二氧化碳主要来自于煤、石油及其他含碳化合物的燃烧。已知25℃时,相关物质的燃烧热数据如表:
则25℃时 和C(石墨,s)生成
和C(石墨,s)生成 的热化学方程式为
的热化学方程式为___________ 。
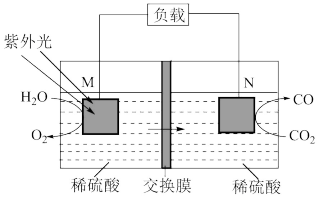
(2)某科研小组用电化学方法将 转化为CO实现再利用,转化的基本原理如图所示。M极的电极反应式
转化为CO实现再利用,转化的基本原理如图所示。M极的电极反应式___________ ,图中箭头所示为___________ 离子(填“ ”或“
”或“ ”)的迁移方向。当转化2mol
”)的迁移方向。当转化2mol 时,外电路转移电子的电量为
时,外电路转移电子的电量为___________ 。(已知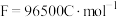 )
)
(3)我国科学家研究 电池,取得了重大科研成果,该电池中,
电池,取得了重大科研成果,该电池中, 为单质锂片,则该电池中的
为单质锂片,则该电池中的 在
在___________ (填“正”或“负”)极发生电化学反应。研究表明,该电池反应产物为碳酸锂和单质碳,且 电还原后与锂离子结合形成碳酸锂按以下4个步骤进行,写出步骤Ⅲ的离子方程式。
电还原后与锂离子结合形成碳酸锂按以下4个步骤进行,写出步骤Ⅲ的离子方程式。
Ⅰ.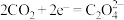 Ⅱ.
Ⅱ.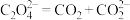
Ⅲ.___________ Ⅳ.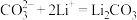
(1)大气中的二氧化碳主要来自于煤、石油及其他含碳化合物的燃烧。已知25℃时,相关物质的燃烧热数据如表:
| 物质 |  (g) (g) | C(石墨,s) |  |
燃烧热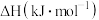 | −285.8 | −393.5 | −3267.5 |
则25℃时
 和C(石墨,s)生成
和C(石墨,s)生成 的热化学方程式为
的热化学方程式为(2)某科研小组用电化学方法将
 转化为CO实现再利用,转化的基本原理如图所示。M极的电极反应式
转化为CO实现再利用,转化的基本原理如图所示。M极的电极反应式 ”或“
”或“ ”)的迁移方向。当转化2mol
”)的迁移方向。当转化2mol 时,外电路转移电子的电量为
时,外电路转移电子的电量为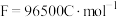 )
)
(3)我国科学家研究
 电池,取得了重大科研成果,该电池中,
电池,取得了重大科研成果,该电池中, 为单质锂片,则该电池中的
为单质锂片,则该电池中的 在
在 电还原后与锂离子结合形成碳酸锂按以下4个步骤进行,写出步骤Ⅲ的离子方程式。
电还原后与锂离子结合形成碳酸锂按以下4个步骤进行,写出步骤Ⅲ的离子方程式。Ⅰ.
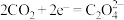 Ⅱ.
Ⅱ.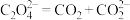
Ⅲ.
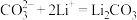
您最近一年使用:0次
10 . O2对人类有着重要的作用。请回答下列问题:
(1)甲醇是一种绿色可再生能源,已知热化学方程式:
ⅰ. 2CO(g)+O2(g)=2CO2(g) ΔH1=-566.0kJ•mol-1
ⅱ. 2H2(g)+O2(g)=2H2O(g) ΔH2=-483.6kJ•mol-1
ⅲ. CO(g)+2H2(g)=CH3OH(g) ΔH3=-574.4kJ•mol-1
则计算CH3OH(g)+ O2(g)=CO2(g)+2H2O(g)的ΔH=
O2(g)=CO2(g)+2H2O(g)的ΔH=_______ kJ•mol-1。
(2)合成硝酸工艺中涉及到反应:2NO(g)+O2(g)=2NO2(g)、2NO2(g) N2O4(g)。T℃时,在恒容密闭容器中以投料比
N2O4(g)。T℃时,在恒容密闭容器中以投料比 =1:1进行投料,容器内总压强p的变化如下表:
=1:1进行投料,容器内总压强p的变化如下表:
已知:a. 2NO2(g) N2O4(g)可认为迅速达到平衡状态。b.时间t=∞时,NO(g)完全反应。
N2O4(g)可认为迅速达到平衡状态。b.时间t=∞时,NO(g)完全反应。
①已知时间为t1min时,测得容器内O2分压p(O2)=10.6 kPa,则此时NO的分压p(NO)_______ kPa。
②T℃时,可逆反应2NO2(g) N2O4(g)的平衡常数Kp=
N2O4(g)的平衡常数Kp=_______ kPa -1(用平衡分压代替平衡浓度计算,分压=总压×体积分数,写出计算式即可),NO2的平衡转化率为_______ %(保留2位有效数字)。
③若将上述反应容器内温度升高至(T+50)℃,达到平衡时,容器内混合气体的平均相对分子质量减小,则2NO2(g) N2O4(g)ΔH
N2O4(g)ΔH_______ 0(填“>”或“<”)。
(3)人体内化学反应时刻需要O2参与,如广泛存在于肌肉中的肌红蛋白(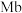 ),具有结合O2的能力,可表示为Mb(aq)+O2(g)
),具有结合O2的能力,可表示为Mb(aq)+O2(g) MbO2(aq)。肌红蛋白的结合度(即转化率α)与平衡时的氧气分压p(O2)密切相关,其变化曲线如图1,37℃时,测得平衡常数K=2(气体和溶液中的溶质分别用分压和物质的量浓度表达)。
MbO2(aq)。肌红蛋白的结合度(即转化率α)与平衡时的氧气分压p(O2)密切相关,其变化曲线如图1,37℃时,测得平衡常数K=2(气体和溶液中的溶质分别用分压和物质的量浓度表达)。
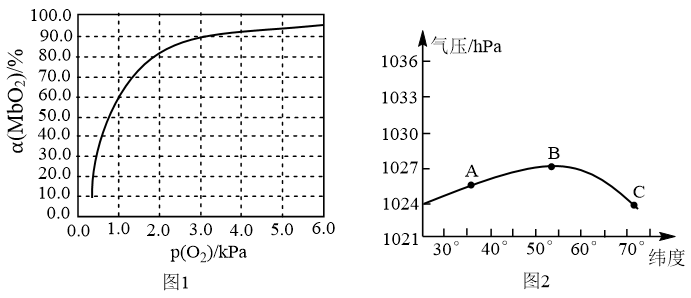
①平衡时,平衡常数表达式K=_______ [用含α和p(O2)的代数式表示];37℃时,测得人正常呼吸时α的最大值为97.7%,则空气中氧气分压p(O2)=_______ kPa(保留3位有效数字)。
②某天不同纬度的大气压变化曲线如图2所示,某运动员处于A、B、C不同位置时,其体内MbO2的浓度最大位置为_______ (填“A”“B”或“C”)。
(1)甲醇是一种绿色可再生能源,已知热化学方程式:
ⅰ. 2CO(g)+O2(g)=2CO2(g) ΔH1=-566.0kJ•mol-1
ⅱ. 2H2(g)+O2(g)=2H2O(g) ΔH2=-483.6kJ•mol-1
ⅲ. CO(g)+2H2(g)=CH3OH(g) ΔH3=-574.4kJ•mol-1
则计算CH3OH(g)+
 O2(g)=CO2(g)+2H2O(g)的ΔH=
O2(g)=CO2(g)+2H2O(g)的ΔH=(2)合成硝酸工艺中涉及到反应:2NO(g)+O2(g)=2NO2(g)、2NO2(g)
 N2O4(g)。T℃时,在恒容密闭容器中以投料比
N2O4(g)。T℃时,在恒容密闭容器中以投料比 =1:1进行投料,容器内总压强p的变化如下表:
=1:1进行投料,容器内总压强p的变化如下表:| t/min | 0 | 40 | 80 | 160 | 260 | 700 |  |
| p/kPa | 33.2 | 28.6 | 27.1 | 26.3 | 25.9 | 25.2 | 22.3 |
已知:a. 2NO2(g)
 N2O4(g)可认为迅速达到平衡状态。b.时间t=∞时,NO(g)完全反应。
N2O4(g)可认为迅速达到平衡状态。b.时间t=∞时,NO(g)完全反应。①已知时间为t1min时,测得容器内O2分压p(O2)=10.6 kPa,则此时NO的分压p(NO)
②T℃时,可逆反应2NO2(g)
 N2O4(g)的平衡常数Kp=
N2O4(g)的平衡常数Kp=③若将上述反应容器内温度升高至(T+50)℃,达到平衡时,容器内混合气体的平均相对分子质量减小,则2NO2(g)
 N2O4(g)ΔH
N2O4(g)ΔH(3)人体内化学反应时刻需要O2参与,如广泛存在于肌肉中的肌红蛋白(
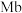 ),具有结合O2的能力,可表示为Mb(aq)+O2(g)
),具有结合O2的能力,可表示为Mb(aq)+O2(g) MbO2(aq)。肌红蛋白的结合度(即转化率α)与平衡时的氧气分压p(O2)密切相关,其变化曲线如图1,37℃时,测得平衡常数K=2(气体和溶液中的溶质分别用分压和物质的量浓度表达)。
MbO2(aq)。肌红蛋白的结合度(即转化率α)与平衡时的氧气分压p(O2)密切相关,其变化曲线如图1,37℃时,测得平衡常数K=2(气体和溶液中的溶质分别用分压和物质的量浓度表达)。
①平衡时,平衡常数表达式K=
②某天不同纬度的大气压变化曲线如图2所示,某运动员处于A、B、C不同位置时,其体内MbO2的浓度最大位置为
您最近一年使用:0次
2021-11-20更新
|
576次组卷
|
2卷引用:黑龙江省大庆铁人中学2021-2022学年高三上学期第二次月考化学试题



