名校
解题方法
1 . 依据事实,写出下列反应的热化学方程式。
(1)在101 kPa时,H2在1.00 mol O2中完全燃烧生成2.00 mol液态H2O,放出571.6 kJ的热量,表示H2燃烧热的热化学方程式为_______ 。
(2)已知CO(g)和CH3OH(l)的燃烧热ΔH分别为-283.0kJ·mol-1和-726.5kJ·mol-1。写出CH3OH(l)不完全燃烧生成CO和液态水的热化学方程式_______ 。
(3)已知稀溶液中,1mol H2SO4与NaOH溶液恰好完全反应时,放出114.6kJ的热量,表示其中和热的热化学方程式_______ 。
(4)NaBH4(s)与H2O(l)反应生成NaBO2(s)和H2(g)。在25℃、101 kPa下,已知每消耗3.8 g NaBH4(s)放热21.6 kJ,该反应的热化学方程式是_______ 。
(1)在101 kPa时,H2在1.00 mol O2中完全燃烧生成2.00 mol液态H2O,放出571.6 kJ的热量,表示H2燃烧热的热化学方程式为
(2)已知CO(g)和CH3OH(l)的燃烧热ΔH分别为-283.0kJ·mol-1和-726.5kJ·mol-1。写出CH3OH(l)不完全燃烧生成CO和液态水的热化学方程式
(3)已知稀溶液中,1mol H2SO4与NaOH溶液恰好完全反应时,放出114.6kJ的热量,表示其中和热的热化学方程式
(4)NaBH4(s)与H2O(l)反应生成NaBO2(s)和H2(g)。在25℃、101 kPa下,已知每消耗3.8 g NaBH4(s)放热21.6 kJ,该反应的热化学方程式是
您最近一年使用:0次
2021高三·全国·专题练习
名校
解题方法
2 . 部分物质的燃烧热如下表,下列关于CH4和水蒸气反应得到H2和CO的热化学方程式正确的是
已知1mol H2O(g)转化生成1mol H2O(l)时放出热量44.0 kJ。
| 物质 | H2(g) | CO(g) | CH4(g) |
| △H/(kJ·mol−1) | −285.8 | −283.0 | −890.3 |
| A.CH4(g)+ H2O(g)=CO(g)+ 3H2(g) △H1=+206.1 kJ·mol−1 |
| B.CH4(g)+ H2O(g)=CO(g)+ 3H2(g) △H2=−206.1 kJ·mol−1 |
| C.CH4(g)+ H2O(g)=CO(g)+ 3H2(g) △H3=+365.5 kJ·mol−1 |
| D.CH4(g)+ H2O(g)=CO(g)+ 3H2(g) △H4=−365.5 kJ·mol−1 |
您最近一年使用:0次
2022-07-12更新
|
389次组卷
|
6卷引用:黑龙江省鹤岗市第一中学2021-2022学年高二上学期开学考试化学试题
黑龙江省鹤岗市第一中学2021-2022学年高二上学期开学考试化学试题(已下线)第15讲 化学反应的热效应(练) — 2022年高考化学一轮复习讲练测(新教材新高考)(已下线)专题18 化学反应与能量(热点讲义)-2022年高三毕业班化学常考点归纳与变式演练湖南省长沙市雅礼中学2021-2022学年高一下学期期末考试化学试题(已下线)第04讲 第一章《化学反应的热效应》单元测试(培优提升)-【帮课堂】2022-2023学年高二化学同步精品讲义(人教2019选择性必修1)(已下线)第1讲 化学能与热能
3 . 二氧化碳加氢制甲醇一般认为通过如下两步反应来实现:
①CO2(g)+H2(g)=CO(g)+H2O(g) △H1=+41kJ·mol-1
②CO(g)+2H2(g)=CH3OH(g) △H2=-90kJ·mol-1
若反应①为慢反应,下列示意图中能体现上述反应能量变化的是
①CO2(g)+H2(g)=CO(g)+H2O(g) △H1=+41kJ·mol-1
②CO(g)+2H2(g)=CH3OH(g) △H2=-90kJ·mol-1
若反应①为慢反应,下列示意图中能体现上述反应能量变化的是
A.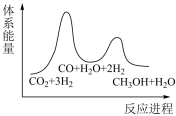 | B. |
C. | D. |
您最近一年使用:0次
2022-06-25更新
|
542次组卷
|
13卷引用:黑龙江省哈尔滨市第三中学校2021-2022学年高三上学期期中考试化学试题
黑龙江省哈尔滨市第三中学校2021-2022学年高三上学期期中考试化学试题山西省运城市2021~2022学年高二上学期10月份月考化学试卷黑龙江省齐齐哈尔市普高联谊校2022-2023学年高二上学期期中考试化学试题黑龙江省佳木斯市第一中学2023-2024学年高二上学期10月月考化学试题黑龙江省哈尔滨市第三中学校2023-2024学年高二上学期期中考试化学试题湖南省衡阳市2022届高三下学期联考 (三模)化学试题湖南省长沙市长沙县第一中学2021-2022学年高三下学期期中考试化学试题(已下线)专题07 化学反应中的能量变化及反应机理-三年(2020-2022)高考真题分项汇编云南省昆明一中教育集团2023届高二升高三诊断性考试化学试题上海市晋元高级中学2022-2023学年高二上学期1月期末考试(等级考)化学试题山西省太原市2022-2023学年高三上学期期末考试化学试题河北省唐山市十县一中联盟2023-2024学年高二上学期期中考试化学试题河北省迁安市2023-2024学年高三上学期期中考试化学试题
名校
解题方法
4 . 我国2030年要实现碳达峰,CO2加氢可缓解CO2带来的环境压力,同时带来巨大的经济效益。CO2加氢过程,主要发生的三个竞争反应为:
反应Ⅰ:CO2(g)+3H2(g) CH3OH(g)+H2O(g) ΔH=-60.0kJ/mol
CH3OH(g)+H2O(g) ΔH=-60.0kJ/mol
反应Ⅱ:CO2(g)+4H2(g) CH4(g)+2H2O(g) ΔH=-165.0kJ/mol
CH4(g)+2H2O(g) ΔH=-165.0kJ/mol
反应Ⅲ:CO2(g)+H2(g) CO(g)+H2O(g) ΔH=+41.18kJ/mol
CO(g)+H2O(g) ΔH=+41.18kJ/mol
回答下列问题:
(1)①由CO、H2合成甲醇的热化学方程式为_______
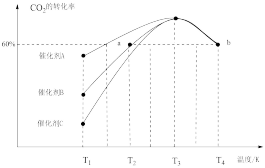
②相同时间内,在不同催化剂下用CO2和H2合成甲醇(其他条件均相同),CO2的转化率随温度变化如图所示,其中活化能最高的反应所用的催化剂是催化剂_______ (填“A”、“B”或“C”)。
(2)我国科学家研究了不同反应温度对含碳产物组成的影响。在反应器中按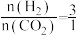 ,通入H2和CO2,分别在0.1MPa和1MPa下进行反应。实验中温度对平衡组成体系的(CO2、CO、CH4)三种物质分析,其CO和CH4的影响如图所示(该反应条件下甲醇产量极低,因此忽略“反应I”,只考虑反应Ⅱ和反应III)。
,通入H2和CO2,分别在0.1MPa和1MPa下进行反应。实验中温度对平衡组成体系的(CO2、CO、CH4)三种物质分析,其CO和CH4的影响如图所示(该反应条件下甲醇产量极低,因此忽略“反应I”,只考虑反应Ⅱ和反应III)。
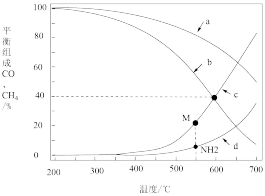
①0.1MPa时,表示CH4和CO平衡组成随温度变化关系的曲线分别是_______ 、_______
②当CH4和CO平衡组成均为40%时,该温度下反应Ⅲ的平衡常数Kp为_______
(3)利用人工光合作用可将CO2转化为甲酸,反应原理为2CO2+2H2O=2HCOOH+O2,装置如图所示:
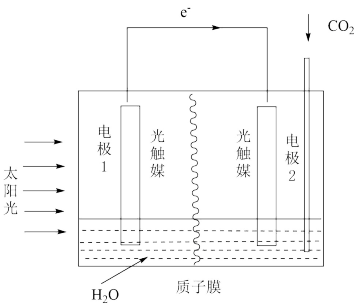
①电极2的电极反应式为_______
②在标准状况下,当电极2室有5.6LCO2反应,则膜两侧电解液质量变化差(Δm右-Δm左)为_______ g
反应Ⅰ:CO2(g)+3H2(g)
 CH3OH(g)+H2O(g) ΔH=-60.0kJ/mol
CH3OH(g)+H2O(g) ΔH=-60.0kJ/mol反应Ⅱ:CO2(g)+4H2(g)
 CH4(g)+2H2O(g) ΔH=-165.0kJ/mol
CH4(g)+2H2O(g) ΔH=-165.0kJ/mol反应Ⅲ:CO2(g)+H2(g)
 CO(g)+H2O(g) ΔH=+41.18kJ/mol
CO(g)+H2O(g) ΔH=+41.18kJ/mol回答下列问题:
(1)①由CO、H2合成甲醇的热化学方程式为
②相同时间内,在不同催化剂下用CO2和H2合成甲醇(其他条件均相同),CO2的转化率随温度变化如图所示,其中活化能最高的反应所用的催化剂是催化剂

(2)我国科学家研究了不同反应温度对含碳产物组成的影响。在反应器中按
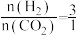 ,通入H2和CO2,分别在0.1MPa和1MPa下进行反应。实验中温度对平衡组成体系的(CO2、CO、CH4)三种物质分析,其CO和CH4的影响如图所示(该反应条件下甲醇产量极低,因此忽略“反应I”,只考虑反应Ⅱ和反应III)。
,通入H2和CO2,分别在0.1MPa和1MPa下进行反应。实验中温度对平衡组成体系的(CO2、CO、CH4)三种物质分析,其CO和CH4的影响如图所示(该反应条件下甲醇产量极低,因此忽略“反应I”,只考虑反应Ⅱ和反应III)。
①0.1MPa时,表示CH4和CO平衡组成随温度变化关系的曲线分别是
②当CH4和CO平衡组成均为40%时,该温度下反应Ⅲ的平衡常数Kp为
(3)利用人工光合作用可将CO2转化为甲酸,反应原理为2CO2+2H2O=2HCOOH+O2,装置如图所示:

①电极2的电极反应式为
②在标准状况下,当电极2室有5.6LCO2反应,则膜两侧电解液质量变化差(Δm右-Δm左)为
您最近一年使用:0次
名校
解题方法
5 . 不同的化学反应具有不同的反应热,人们可以通过多种方法获得反应热的数据,通常用实验进行测定,也可以进行理论推算。
Ⅰ.在科学研究中,科学家常用量热计来测量反应热。我校某化学兴趣小组的同学欲测定盐酸与氢氧化钠溶液反应的反应热,则:
(1)测定中和热的装置如图1所示。
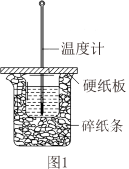
①从实验装置上看,图中尚缺少的一种仪器是____ 。
②做一次完整的中和热测定实验,温度计需使用____ 次。
③现用50mL0.5mol/L的稀盐酸与50mL0.55mol/L氢氧化钠溶液反应测定,以下操作可能会导致测得的中和热数值偏大的是____ 。
A.实验装置保温、隔热效果差
B.量取稀盐酸的体积时仰视读数
C.分多次把氢氧化钠溶液倒入盛有盐酸的小烧杯中
D.用相同浓度和体积的氨水(NH3·H2O)代替NaOH溶液进行上述实验
(2)在25mL1.00mol/LHCl溶液中逐滴加入未知浓度NaOH溶液VmL,将溶液搅拌均匀后,在保温隔热的条件下测量并记录混合溶液的温度,实验结果如图2所示。
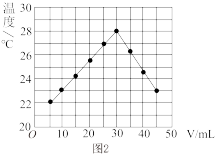
①做该实验时环境温度____ 22℃(填“<”、“>”或“=”)。
②NaOH溶液的物质的量浓度约为____ (保留小数点后两位)。
Ⅱ.并不是所有反应的反应热均可通过实验直接测定。
(3)已知:由气态基态原子形成1mol化学键释放的最低能量叫键能。在化学反应过程中,拆开化学键需要消耗能量,形成化学键又会释放能量。部分化学键键能数据如表:
反应N2(g)+3H2(g) 2NH3(g)ΔH=akJ/mol,根据所列键能数据计算a=
2NH3(g)ΔH=akJ/mol,根据所列键能数据计算a=____ kJ/mol。
(4)甲醇质子交换膜燃料电池中将甲醇蒸气转化为氢气的两种反应原理是:
①CH3OH(g)+H2O(g)=CO2(g)+3H2(g)ΔH=+akJ/mol
②CH3OH(g)+ O2(g)=CO2(g)+2H2(g)ΔH=-bkJ/mol
O2(g)=CO2(g)+2H2(g)ΔH=-bkJ/mol
又知③H2O(g)=H2O(l)ΔH=-ckJ/mol
则甲醇蒸气燃烧的热化学方程式:____ (ΔH用a、b、c表示)。
Ⅰ.在科学研究中,科学家常用量热计来测量反应热。我校某化学兴趣小组的同学欲测定盐酸与氢氧化钠溶液反应的反应热,则:
(1)测定中和热的装置如图1所示。
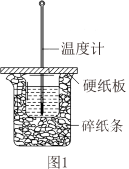
①从实验装置上看,图中尚缺少的一种仪器是
②做一次完整的中和热测定实验,温度计需使用
③现用50mL0.5mol/L的稀盐酸与50mL0.55mol/L氢氧化钠溶液反应测定,以下操作可能会导致测得的中和热数值偏大的是
A.实验装置保温、隔热效果差
B.量取稀盐酸的体积时仰视读数
C.分多次把氢氧化钠溶液倒入盛有盐酸的小烧杯中
D.用相同浓度和体积的氨水(NH3·H2O)代替NaOH溶液进行上述实验
(2)在25mL1.00mol/LHCl溶液中逐滴加入未知浓度NaOH溶液VmL,将溶液搅拌均匀后,在保温隔热的条件下测量并记录混合溶液的温度,实验结果如图2所示。

①做该实验时环境温度
②NaOH溶液的物质的量浓度约为
Ⅱ.并不是所有反应的反应热均可通过实验直接测定。
(3)已知:由气态基态原子形成1mol化学键释放的最低能量叫键能。在化学反应过程中,拆开化学键需要消耗能量,形成化学键又会释放能量。部分化学键键能数据如表:
| 化学键 | H—H | N—H | N≡N |
| 键能(kJ/mol) | 436 | 391 | 945 |
 2NH3(g)ΔH=akJ/mol,根据所列键能数据计算a=
2NH3(g)ΔH=akJ/mol,根据所列键能数据计算a=(4)甲醇质子交换膜燃料电池中将甲醇蒸气转化为氢气的两种反应原理是:
①CH3OH(g)+H2O(g)=CO2(g)+3H2(g)ΔH=+akJ/mol
②CH3OH(g)+
 O2(g)=CO2(g)+2H2(g)ΔH=-bkJ/mol
O2(g)=CO2(g)+2H2(g)ΔH=-bkJ/mol又知③H2O(g)=H2O(l)ΔH=-ckJ/mol
则甲醇蒸气燃烧的热化学方程式:
您最近一年使用:0次
2022-03-16更新
|
204次组卷
|
3卷引用:黑龙江省八校2022届高三上学期期中联合考试化学试题
名校
解题方法
6 . “绿水青山就是金山银山”,研究消除氮氧化物污染对建设美丽家乡,打造宜居环境有重要意义。
(1)已知:2NO(g)+O2(g)=2NO2(g) △H1=-114kJ/mol
C(s)+O2(g)=CO2(g) △H2=-393.5kJ/mol
N2(g)+O2(g)=2NO(g) △H3=+181kJ/mol
若某反应的平衡常数表达式为K= ,该反应的热化学方程式为
,该反应的热化学方程式为___________ 。
(2)T℃时,存在如下平衡:2NO2(g) N2O4(g)。该反应正、逆反应速率与NO2、N2O4的浓度关系为:v正=k正c2(NO2),v逆=k逆c(N2O4)(k正、k逆是速率常数),且lgv正~lgc(NO2)与lgv逆~lgc(N2O4)的关系如图所示。
N2O4(g)。该反应正、逆反应速率与NO2、N2O4的浓度关系为:v正=k正c2(NO2),v逆=k逆c(N2O4)(k正、k逆是速率常数),且lgv正~lgc(NO2)与lgv逆~lgc(N2O4)的关系如图所示。
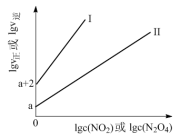
①图中表示lgv正~lgc(NO2)的线是___________ (填“I”或“II”)。
②T℃时,往刚性容器中充入一定量NO2,平衡后测得c(N2O4)为1.0mol/L,则平衡时,v逆=______ (用含a的表达式表示)。
③T℃时,该反应的平衡常数K=___________ L/mol。
(3)原煤经热解、冷却得到的煤焦可用于NO的脱除。将浓度恒定的NO废气以固定流速通过下图的反应器。分别用两种不同热解温度的煤焦,测定NO的脱除率。
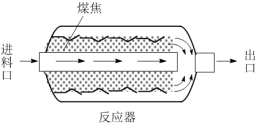
已知:i.两种不同热解温度500℃、900℃下获得的煤焦分别用S—500、S—900表示。
ii.煤焦表面存在的官能团有利于NO的吸附。热解温度高,煤焦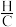 比值小,表面官能团少。
比值小,表面官能团少。
iii.NO的脱除主要含吸附和化学还原两个过程。
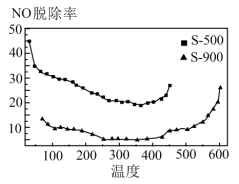
①由图可知:相同温度下,S—500对NO的脱除率比S—900的高,结合表格数据分析其可能原因是_______ 、______ 。
②由图可知:350℃后,随着温度升高,NO的脱除率增大的原因是___________ 。
(1)已知:2NO(g)+O2(g)=2NO2(g) △H1=-114kJ/mol
C(s)+O2(g)=CO2(g) △H2=-393.5kJ/mol
N2(g)+O2(g)=2NO(g) △H3=+181kJ/mol
若某反应的平衡常数表达式为K=
 ,该反应的热化学方程式为
,该反应的热化学方程式为(2)T℃时,存在如下平衡:2NO2(g)
 N2O4(g)。该反应正、逆反应速率与NO2、N2O4的浓度关系为:v正=k正c2(NO2),v逆=k逆c(N2O4)(k正、k逆是速率常数),且lgv正~lgc(NO2)与lgv逆~lgc(N2O4)的关系如图所示。
N2O4(g)。该反应正、逆反应速率与NO2、N2O4的浓度关系为:v正=k正c2(NO2),v逆=k逆c(N2O4)(k正、k逆是速率常数),且lgv正~lgc(NO2)与lgv逆~lgc(N2O4)的关系如图所示。
①图中表示lgv正~lgc(NO2)的线是
②T℃时,往刚性容器中充入一定量NO2,平衡后测得c(N2O4)为1.0mol/L,则平衡时,v逆=
③T℃时,该反应的平衡常数K=
(3)原煤经热解、冷却得到的煤焦可用于NO的脱除。将浓度恒定的NO废气以固定流速通过下图的反应器。分别用两种不同热解温度的煤焦,测定NO的脱除率。

已知:i.两种不同热解温度500℃、900℃下获得的煤焦分别用S—500、S—900表示。
ii.煤焦表面存在的官能团有利于NO的吸附。热解温度高,煤焦
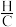 比值小,表面官能团少。
比值小,表面官能团少。iii.NO的脱除主要含吸附和化学还原两个过程。

①由图可知:相同温度下,S—500对NO的脱除率比S—900的高,结合表格数据分析其可能原因是
| 煤焦 | 元素分析(%) | 比表面积 (cm2∙g-1) | |
| H | C | ||
| S-500 | 2.76 | 80.79 | 105.69 |
| S-900 | 0.82 | 84.26 | 8.98 |
②由图可知:350℃后,随着温度升高,NO的脱除率增大的原因是
您最近一年使用:0次
2022-01-03更新
|
314次组卷
|
2卷引用:黑龙江省哈尔滨市第九中学2021-2022学年高三上学期期末考试理科综合化学试题
解题方法
7 . CO、H2、C2H5OH三种物质燃烧的热化学方程式如下:
①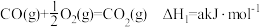
②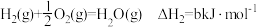
③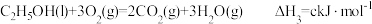 。下列说法正确的是
。下列说法正确的是
①
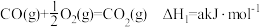
②
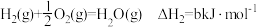
③
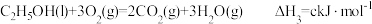 。下列说法正确的是
。下列说法正确的是| A.a>0 |
B.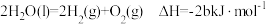 |
| C.由反应③可知乙醇的燃烧热为c kJ/mol |
D.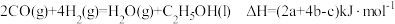 |
您最近一年使用:0次
名校
解题方法
8 . 已知热化学方程式:
①CO(g)+1/2O2(g)=CO2(g) ΔΗ= -283.0kJ/mol
②H2(g)+1/2O2(g)=H2O(g) ΔΗ= -241.8kJ/mol
据此判断下列说法正确的是
①CO(g)+1/2O2(g)=CO2(g) ΔΗ= -283.0kJ/mol
②H2(g)+1/2O2(g)=H2O(g) ΔΗ= -241.8kJ/mol
据此判断下列说法正确的是
| A.H2(g)+1/2O2(g)=H2O(l) ΔΗ>-241.8kJ/mol |
| B.H2(g)的燃烧热ΔΗ =-241.8 kJ/mol |
| C.H2(g)转变成H2O(g)的化学反应一定放出能量 |
| D.CO(g)+ H2O(g)= CO2(g)+ H2(g)的ΔΗ =-41.2kJ/mol |
您最近一年使用:0次
9 . 镁和卤素单质( )反应的相对能量变化如图所示。下列说法不正确的是
)反应的相对能量变化如图所示。下列说法不正确的是
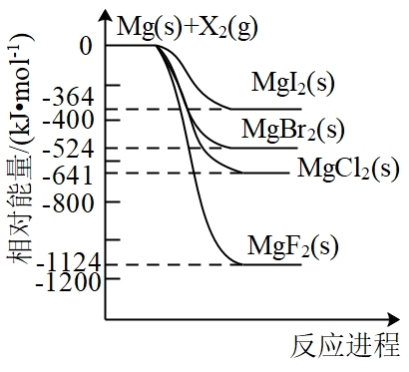
 )反应的相对能量变化如图所示。下列说法不正确的是
)反应的相对能量变化如图所示。下列说法不正确的是
A.热稳定性: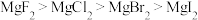 |
B.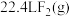 与足量的Mg充分反应,放热1124kJ 与足量的Mg充分反应,放热1124kJ |
C.工业上可用电解 溶液的方法冶炼金属Mg,该过程需要吸收热量 溶液的方法冶炼金属Mg,该过程需要吸收热量 |
D.由图可知, |
您最近一年使用:0次
名校
解题方法
10 . 目前,节约能源,再生资源,减轻环境污染是我们重点关注的科研课题。由CO制备CO2再到制备甲醇可以实现以上的课题。回答下列问题:
I. 可有效降低汽车尾气污染物的排放。一定条件下该反应经历三个基元反应阶段,反应历程如图所示(TS表示过渡态、IM表示中间产物)。
可有效降低汽车尾气污染物的排放。一定条件下该反应经历三个基元反应阶段,反应历程如图所示(TS表示过渡态、IM表示中间产物)。
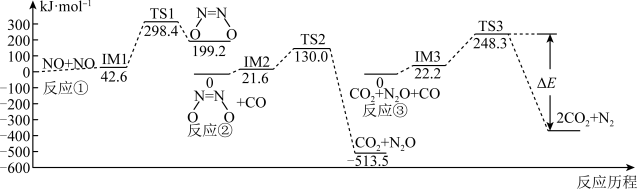
(1)三个基元反应中,属于放热反应的是_______ (填标号);图中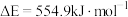 ,则该反应
,则该反应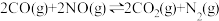 的
的
_______  。
。
(2)探究温度(298K、398K)、压强对反应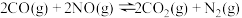 的影响,如图所示,表示398K的是
的影响,如图所示,表示398K的是_______ (填标号)。

II.用H2还原CO2可以在一定条下合成CH3OH(不考虑副反应)可以实现资源的再生: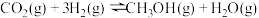

(3)某条件下该反应速率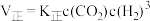 ,
, ,该反应的平衡常数
,该反应的平衡常数 ,则a=
,则a=_______ ,b=_______ 。
(4)某温度下,恒容密闭容器中,CO2和H2的起始浓度分别为a 和3a
和3a ,反应平衡时,CH3OH的产率为b,该温度下反应平衡常数的值为
,反应平衡时,CH3OH的产率为b,该温度下反应平衡常数的值为_______ (用字母a,b表示)。
(5)恒压下,CO2和H2的起始物质的量比为1:3时,该反应在无分子筛膜时甲醇的平衡产率和有分子筛膜时甲醇的产率随温度的变化如图所示,其中分子筛膜能选择性分离出H2O。
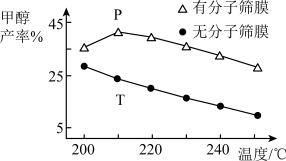
①甲醇平衡产率随温度升高而降低的原因为_______ 。
②P点甲醇产率高于T点的原因为_______ 。
③根据图示,在此条件下采用该分子筛膜时的最佳反应温度为_______ ℃。
(6)调节溶液pH可实现工业废气CO2的捕获和释放,已知25℃碳酸电离常数为Ka1、Ka2,当溶液pH=12时, 1:
1:_______ 。
I.
 可有效降低汽车尾气污染物的排放。一定条件下该反应经历三个基元反应阶段,反应历程如图所示(TS表示过渡态、IM表示中间产物)。
可有效降低汽车尾气污染物的排放。一定条件下该反应经历三个基元反应阶段,反应历程如图所示(TS表示过渡态、IM表示中间产物)。
(1)三个基元反应中,属于放热反应的是
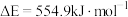 ,则该反应
,则该反应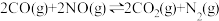 的
的
 。
。(2)探究温度(298K、398K)、压强对反应
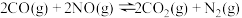 的影响,如图所示,表示398K的是
的影响,如图所示,表示398K的是
II.用H2还原CO2可以在一定条下合成CH3OH(不考虑副反应)可以实现资源的再生:
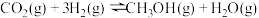

(3)某条件下该反应速率
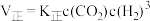 ,
, ,该反应的平衡常数
,该反应的平衡常数 ,则a=
,则a=(4)某温度下,恒容密闭容器中,CO2和H2的起始浓度分别为a
 和3a
和3a ,反应平衡时,CH3OH的产率为b,该温度下反应平衡常数的值为
,反应平衡时,CH3OH的产率为b,该温度下反应平衡常数的值为(5)恒压下,CO2和H2的起始物质的量比为1:3时,该反应在无分子筛膜时甲醇的平衡产率和有分子筛膜时甲醇的产率随温度的变化如图所示,其中分子筛膜能选择性分离出H2O。

①甲醇平衡产率随温度升高而降低的原因为
②P点甲醇产率高于T点的原因为
③根据图示,在此条件下采用该分子筛膜时的最佳反应温度为
(6)调节溶液pH可实现工业废气CO2的捕获和释放,已知25℃碳酸电离常数为Ka1、Ka2,当溶液pH=12时,
 1:
1:
您最近一年使用:0次



