名校
1 . 二硫化碳用于制造人造丝、杀虫剂、促进剂等,也用作溶剂。回答下列问题:
(1)下列反应的焓变及平衡常数如下:
(Ⅰ)


(Ⅱ)
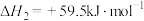
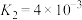
(Ⅲ)
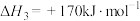
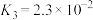
(Ⅳ)
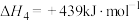

①反应(Ⅳ)自发进行的条件是_______ (填字母)。
A.高温 B.低温 C.任意温度
②
_______  ;
;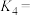
_______ 。
(2)硫化氢替代硫黄生产二硫化碳的原理为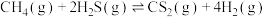 ,起始时,
,起始时,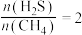 。在100 kPa压强下测得不同温度时的平衡组成如图1所示,在不同压强下测得的平衡组成如图2所示:
。在100 kPa压强下测得不同温度时的平衡组成如图1所示,在不同压强下测得的平衡组成如图2所示:

①该反应的
_______ 0(填“>”或“<”);图2中a、d代表的物质分别是_______ 、_______ 。
②图1中,X点H2S的转化率为_______ %。
③为提高该反应中H2S的平衡转化率,除改变温度和压强外,还可采取的措施是_______ 。
(1)下列反应的焓变及平衡常数如下:
(Ⅰ)



(Ⅱ)

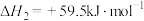
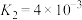
(Ⅲ)

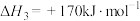
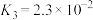
(Ⅳ)

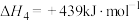

①反应(Ⅳ)自发进行的条件是
A.高温 B.低温 C.任意温度
②

 ;
;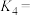
(2)硫化氢替代硫黄生产二硫化碳的原理为
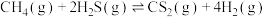 ,起始时,
,起始时,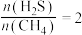 。在100 kPa压强下测得不同温度时的平衡组成如图1所示,在不同压强下测得的平衡组成如图2所示:
。在100 kPa压强下测得不同温度时的平衡组成如图1所示,在不同压强下测得的平衡组成如图2所示:
①该反应的

②图1中,X点H2S的转化率为
③为提高该反应中H2S的平衡转化率,除改变温度和压强外,还可采取的措施是
您最近一年使用:0次
2023-08-14更新
|
130次组卷
|
3卷引用:海南省海口市等5地琼中黎族苗族自治县琼中中学等2校2022-2023学年高三上学期12月期末化学试题
2 . 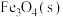 与
与 主要发生反应:①
主要发生反应:①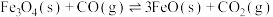
 ;②
;②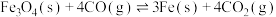
 。其他条件一定时,
。其他条件一定时,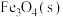 和
和 反应达到平衡时,
反应达到平衡时, 的体积分数随温度的变化关系如图所示:
的体积分数随温度的变化关系如图所示:
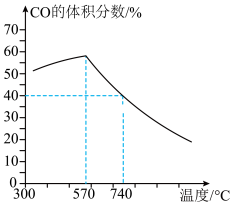
(1)反应的还原产物与温度密切相关,则570~740℃主要发生的反应是___________ (填“①”或“②”),若740℃时CO的平衡体积分数为40%。该温度下反应①的平衡常数
___________ 。反应 的焓变
的焓变
___________ (用含 、
、 的代数式表示)。
的代数式表示)。
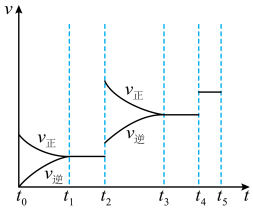
(2)若控制温度在600℃以上,改变外界条件,反应速率v随时间t的变化关系如图所示,则 时刻改变的一个条件可能是
时刻改变的一个条件可能是___________ , 时刻改变的一个条件可能是
时刻改变的一个条件可能是___________ 。
(3)若
 。在T℃、
。在T℃、 恒容密闭容器甲、乙和丙中,分别按下表所示加入物质,反应经过一段时间后达到平衡。
恒容密闭容器甲、乙和丙中,分别按下表所示加入物质,反应经过一段时间后达到平衡。
T℃时,若甲容器中CO的平衡转化率为20%,则平衡时,乙容器中CO的体积分数为___________ ,甲容器和丙容器中气体的压强之比为___________ ,该反应的平衡常数的负对数值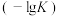 随着温度的升高而
随着温度的升高而___________ (填“增大”或“减小”)。
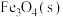 与
与 主要发生反应:①
主要发生反应:①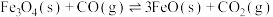
 ;②
;②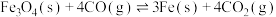
 。其他条件一定时,
。其他条件一定时,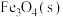 和
和 反应达到平衡时,
反应达到平衡时, 的体积分数随温度的变化关系如图所示:
的体积分数随温度的变化关系如图所示:
(1)反应的还原产物与温度密切相关,则570~740℃主要发生的反应是

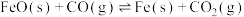 的焓变
的焓变
 、
、 的代数式表示)。
的代数式表示)。(2)若控制温度在600℃以上,改变外界条件,反应速率v随时间t的变化关系如图所示,则
 时刻改变的一个条件可能是
时刻改变的一个条件可能是 时刻改变的一个条件可能是
时刻改变的一个条件可能是
(3)若
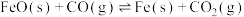
 。在T℃、
。在T℃、 恒容密闭容器甲、乙和丙中,分别按下表所示加入物质,反应经过一段时间后达到平衡。
恒容密闭容器甲、乙和丙中,分别按下表所示加入物质,反应经过一段时间后达到平衡。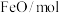 | 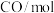 |  | 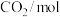 | |
| 甲 | 2.0 | 2.0 | 1.0 | 0 |
| 乙 | 2.0 | 2.0 | 1.0 | 1.0 |
| 丙 | 4.0 | 3.5 | 1.5 | 1.5 |
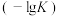 随着温度的升高而
随着温度的升高而
您最近一年使用:0次
名校
3 .  是主要的温室气体。利用
是主要的温室气体。利用 制甲烷(
制甲烷( )、甲醇(
)、甲醇( )、CO等燃料,可实现能源再生和
)、CO等燃料,可实现能源再生和 的资源化利用。
的资源化利用。
Ⅰ.利用太阳能分解水获得氢气,再通过 加氢制甲醇,反应如下:
加氢制甲醇,反应如下:
①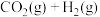



②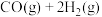


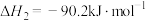
(1)反应①的平衡常数表达式
_______ ;
(2) 催化加氢制取
催化加氢制取 和
和 的热化学方程式是
的热化学方程式是_______ 。
Ⅱ.利用 与氢气反应制取甲烷。对于反应
与氢气反应制取甲烷。对于反应 ,不同温度下经过相同反应时间
,不同温度下经过相同反应时间 转化率的变化曲线如图所示。
转化率的变化曲线如图所示。

(3)请描述曲线( 转化率随着温度)变化趋势:
转化率随着温度)变化趋势:_______ ,该反应是_______ 反应(填“吸热”或“放热”)。
Ⅲ.甲烷的温室效应约为 的25倍,利用
的25倍,利用 重整技术能将二者同时转化为合成气CO和
重整技术能将二者同时转化为合成气CO和 而广受关注。该重整技术涉及的主要反应为:
而广受关注。该重整技术涉及的主要反应为:
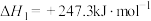 。
。
(4)为提高 的平衡转化率,可采取的措施为
的平衡转化率,可采取的措施为_______ (写出一条即可)。
(5)某温度下,向恒容容器中通入等物质的量的 和
和 ,初始总压强为p,反应达到平衡后,总压强变为1.6p,则该条件下的平衡常数
,初始总压强为p,反应达到平衡后,总压强变为1.6p,则该条件下的平衡常数
_______ (以分压表示,分压=总压×物质的量分数)。
 是主要的温室气体。利用
是主要的温室气体。利用 制甲烷(
制甲烷( )、甲醇(
)、甲醇( )、CO等燃料,可实现能源再生和
)、CO等燃料,可实现能源再生和 的资源化利用。
的资源化利用。Ⅰ.利用太阳能分解水获得氢气,再通过
 加氢制甲醇,反应如下:
加氢制甲醇,反应如下:①
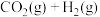



②
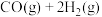


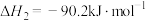
(1)反应①的平衡常数表达式

(2)
 催化加氢制取
催化加氢制取 和
和 的热化学方程式是
的热化学方程式是Ⅱ.利用
 与氢气反应制取甲烷。对于反应
与氢气反应制取甲烷。对于反应 ,不同温度下经过相同反应时间
,不同温度下经过相同反应时间 转化率的变化曲线如图所示。
转化率的变化曲线如图所示。
(3)请描述曲线(
 转化率随着温度)变化趋势:
转化率随着温度)变化趋势:Ⅲ.甲烷的温室效应约为
 的25倍,利用
的25倍,利用 重整技术能将二者同时转化为合成气CO和
重整技术能将二者同时转化为合成气CO和 而广受关注。该重整技术涉及的主要反应为:
而广受关注。该重整技术涉及的主要反应为:
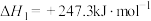 。
。(4)为提高
 的平衡转化率,可采取的措施为
的平衡转化率,可采取的措施为(5)某温度下,向恒容容器中通入等物质的量的
 和
和 ,初始总压强为p,反应达到平衡后,总压强变为1.6p,则该条件下的平衡常数
,初始总压强为p,反应达到平衡后,总压强变为1.6p,则该条件下的平衡常数
您最近一年使用:0次
2023-07-16更新
|
129次组卷
|
2卷引用:福建省宁德市区域性学业质量检测2022-2023学年高二上学期2月期末考试化学试题
4 . 研发二氧化碳的碳捕捉和碳利用有着十分重要的现实意义。一定条件下能发生:CO2(g)+CH4(g) 2CO(g)+2H2(g) △H。
2CO(g)+2H2(g) △H。
(1)已知:CH4(g)+2O2(g)=CO2(g)+2H2O(g) △H1=-802.3kJ•mol-1
C(s)+2H2O(g)=CO(g)+H2(g) △H2=+131.3kJ•mol-1
C(s)+O2(g)=CO2(g) △H3=-393.5kJ•mol-1
则上述反应体系的反应热△H=_______ kJ•mol-1。
(2)对于上述反应体系,下列说法正确的是_______ 。
(3)在恒容密闭容器中通入CH4与CO2,使其物质的量浓度均为1.0mol•L-1,测得CH4的平衡转化率与温度及压强的关系如图所示。

①压强p1、p2、p3、p4由小到大的关系为______ 。
②压强为p4时,在b点:v正_______ v逆(填“<”或“=”或“>”)。
③若p4=3MPa,则1100℃时,该反应的平衡常数Kp=______ (MPa)2。
(4)科学家利用电化学装置实现CH4和CO2两种分子的耦合转化来达到减碳的目的,其原理如图所示:

①电极B上的电极反应式为______ 。
②若生成乙烷和乙烯的物质的量之比为2:1,则消耗CH4和CO2的物质的量之比为______ 。
 2CO(g)+2H2(g) △H。
2CO(g)+2H2(g) △H。(1)已知:CH4(g)+2O2(g)=CO2(g)+2H2O(g) △H1=-802.3kJ•mol-1
C(s)+2H2O(g)=CO(g)+H2(g) △H2=+131.3kJ•mol-1
C(s)+O2(g)=CO2(g) △H3=-393.5kJ•mol-1
则上述反应体系的反应热△H=
(2)对于上述反应体系,下列说法正确的是
| A.升高温度,正反应速率增大,逆反应速率也增大 |
| B.恒容密闭容器中,当气体密度不变时,反应达到平衡状态 |
| C.加入合适催化剂,可提滴CH4的平衡转化率 |
| D.v正(H2)=2v逆(CH4)时,反应体系处于平衡状态 |

①压强p1、p2、p3、p4由小到大的关系为
②压强为p4时,在b点:v正
③若p4=3MPa,则1100℃时,该反应的平衡常数Kp=
(4)科学家利用电化学装置实现CH4和CO2两种分子的耦合转化来达到减碳的目的,其原理如图所示:

①电极B上的电极反应式为
②若生成乙烷和乙烯的物质的量之比为2:1,则消耗CH4和CO2的物质的量之比为
您最近一年使用:0次
5 . I.一定条件下,利用CO2合成甲烷的反应如下:
①CO2(g)+4H2(g) CH4(g)+2H2O(g) ∆H1=-156.9kJ•mol-1
CH4(g)+2H2O(g) ∆H1=-156.9kJ•mol-1
研究表明该反应过程会有副反应:
②CO2(g)+H2(g) CO(g)+H2O(g) ∆H2=+41.1kJ•mol-1
CO(g)+H2O(g) ∆H2=+41.1kJ•mol-1
(1)已知2H2(g)+O2(g)=2H2O(g) ∆H3=-483.6kJ•mol-1,写出表示CO燃烧热的热化学方程式_______ 。
(2)①反应的平衡常数表达式为K=______ ,结合反应分析提高甲烷产率选择性的因素有:______ 。
Ⅱ.丙烷(C3H8)一定条件下可制取丙烯(C3H6),反应如下:C3H8(g) C3H6(g)+H2(g) ∆H=+124kJ•mol-1
C3H6(g)+H2(g) ∆H=+124kJ•mol-1
(3)一定温度下,在刚性容器中充入C3H8,起始压强为10kPa,15min时反应恰好达到平衡,此时总压强为14kPa。用单位时间内气体分压的变化来表示反应速率,即v=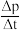 ,则v(C3H8)=
,则v(C3H8)= ____ kPa•min-1,C3H8的平衡转化率为______ 。该反应的压强平衡常数Kp=_______ kPa。(分压=总压 物质的量分数,计算结果小数点后保留2位)。
物质的量分数,计算结果小数点后保留2位)。
(4)总压分别为100kPa和10kPa时发生该反应,平衡体系中C3H8和C3H6的物质的量分数随温度变化关系如图所示。10kPa时C3H8和C3H6的物质的量分数随温度变化关系的曲线分别是______ 、______ 。

(5)高温下,丙烷生成丙烯的反应在初期阶段的速率方程为r=kc(C3H8),其中k为反应速率常数。对于处于初期阶段的该反应,下列说法正确的是______ (填字母)。
A. 增加丙烷浓度,r增大 B. 增加H2浓度,r增大
C. 降低反应温度,k减小 D. 丙烯的生成速率逐渐增大
①CO2(g)+4H2(g)
 CH4(g)+2H2O(g) ∆H1=-156.9kJ•mol-1
CH4(g)+2H2O(g) ∆H1=-156.9kJ•mol-1研究表明该反应过程会有副反应:
②CO2(g)+H2(g)
 CO(g)+H2O(g) ∆H2=+41.1kJ•mol-1
CO(g)+H2O(g) ∆H2=+41.1kJ•mol-1(1)已知2H2(g)+O2(g)=2H2O(g) ∆H3=-483.6kJ•mol-1,写出表示CO燃烧热的热化学方程式
(2)①反应的平衡常数表达式为K=
Ⅱ.丙烷(C3H8)一定条件下可制取丙烯(C3H6),反应如下:C3H8(g)
 C3H6(g)+H2(g) ∆H=+124kJ•mol-1
C3H6(g)+H2(g) ∆H=+124kJ•mol-1(3)一定温度下,在刚性容器中充入C3H8,起始压强为10kPa,15min时反应恰好达到平衡,此时总压强为14kPa。用单位时间内气体分压的变化来表示反应速率,即v=
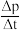 ,则v(C3H8)=
,则v(C3H8)=  物质的量分数,计算结果小数点后保留2位)。
物质的量分数,计算结果小数点后保留2位)。(4)总压分别为100kPa和10kPa时发生该反应,平衡体系中C3H8和C3H6的物质的量分数随温度变化关系如图所示。10kPa时C3H8和C3H6的物质的量分数随温度变化关系的曲线分别是

(5)高温下,丙烷生成丙烯的反应在初期阶段的速率方程为r=kc(C3H8),其中k为反应速率常数。对于处于初期阶段的该反应,下列说法正确的是
A. 增加丙烷浓度,r增大 B. 增加H2浓度,r增大
C. 降低反应温度,k减小 D. 丙烯的生成速率逐渐增大
您最近一年使用:0次
名校
解题方法
6 . 完成下列问题
(1)在 25℃、101 kPa 下,已知 SiH4气体在氧气中完全燃烧后恢复至原状态,平均每转移1 mol 电子放出热量 a kJ,该反应的热化学方程式为___________ 。
(2)燃料的热值是指单位质量某种燃料完全燃烧放出的热量,已知25℃、101kPa下C8H18(辛烷)的热值为b kJ/g,表示辛烷燃烧热的热化学方程式为___________ 。
(3)已知:H2O(l)= H2O(g) ΔH= +44.0kJ·mol-1,甲烷完全燃烧与不完全燃烧的热效应如下图所示。

①写出表示甲烷燃烧热的热化学方程式:___________ 。
②CO的燃烧热ΔH=___________ kJ·mol-1
③已知氢气的燃烧热为-286kJ·mol-1,氧气中O=O键的键能为496kJ·mol-1,水蒸气中H-O键的键能为463kJ·mol-1,则氢气中H-H键的键能为___________ kJ·mol-1。
(1)在 25℃、101 kPa 下,已知 SiH4气体在氧气中完全燃烧后恢复至原状态,平均每转移1 mol 电子放出热量 a kJ,该反应的热化学方程式为
(2)燃料的热值是指单位质量某种燃料完全燃烧放出的热量,已知25℃、101kPa下C8H18(辛烷)的热值为b kJ/g,表示辛烷燃烧热的热化学方程式为
(3)已知:H2O(l)= H2O(g) ΔH= +44.0kJ·mol-1,甲烷完全燃烧与不完全燃烧的热效应如下图所示。

①写出表示甲烷燃烧热的热化学方程式:
②CO的燃烧热ΔH=
③已知氢气的燃烧热为-286kJ·mol-1,氧气中O=O键的键能为496kJ·mol-1,水蒸气中H-O键的键能为463kJ·mol-1,则氢气中H-H键的键能为
您最近一年使用:0次
解题方法
7 . 化学能可以与其他形式的能量发生相互转化。
Ⅰ.化学能与热能的相互转化
(1)在25℃和101 kPa下, 和
和 反应生成
反应生成 时,放出483.6 kJ的热量。
时,放出483.6 kJ的热量。
①断裂1 mol H—H键需要吸收436 kJ的能量,断裂1 mol H—O键需要吸收463 kJ的能量。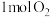 中的化学键断裂需要吸收的能量为
中的化学键断裂需要吸收的能量为_______ 。
②已知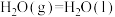
 ,则
,则 的燃烧热的热化学方程式为
的燃烧热的热化学方程式为_______ 。
(2)将煤转化为水煤气是通过化学方法将煤转化为洁净燃料的方法之一。煤转化为水煤气的主要化学反应为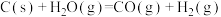
 。
。
已知:
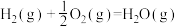

① 和
和 具有的总能量
具有的总能量_______ (填“大于”“等于”或“小于”)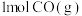 和
和 具有的总能量。
具有的总能量。
②理论上将煤转化为水煤气再燃烧放出的热量_______ (填“大于”“等于”或“小于”)直接燃烧煤放出的热量。
Ⅱ.化学能与电能的相互转化
(3)实验室制作简单的氢氧燃料电池示意图如下图(a)所示。

①闭合 ,一段时间后,
,一段时间后,_______ (填“阳”或“阴”)极区附近的溶液变红。
②断开 ,闭合
,闭合 。电路中每通过2 mol电子,消耗氢气的体积为
。电路中每通过2 mol电子,消耗氢气的体积为_______ (转换为标准状况下的体积)。
(4)离子膜电解法常用于制备金属氧化物或金属氧化物的前驱体。一种电解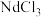 溶液制备难溶物
溶液制备难溶物 的装置示意图如图(b)所示。
的装置示意图如图(b)所示。

①为了获得更多的 ,应选用
,应选用_______ (填“阳”或“阴”)离子交换膜。
②电极B的电极反应式为_______ 。
Ⅰ.化学能与热能的相互转化
(1)在25℃和101 kPa下,
 和
和 反应生成
反应生成 时,放出483.6 kJ的热量。
时,放出483.6 kJ的热量。①断裂1 mol H—H键需要吸收436 kJ的能量,断裂1 mol H—O键需要吸收463 kJ的能量。
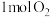 中的化学键断裂需要吸收的能量为
中的化学键断裂需要吸收的能量为②已知
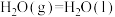
 ,则
,则 的燃烧热的热化学方程式为
的燃烧热的热化学方程式为(2)将煤转化为水煤气是通过化学方法将煤转化为洁净燃料的方法之一。煤转化为水煤气的主要化学反应为
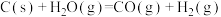
 。
。已知:

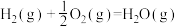

①
 和
和 具有的总能量
具有的总能量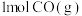 和
和 具有的总能量。
具有的总能量。②理论上将煤转化为水煤气再燃烧放出的热量
Ⅱ.化学能与电能的相互转化
(3)实验室制作简单的氢氧燃料电池示意图如下图(a)所示。

①闭合
 ,一段时间后,
,一段时间后,②断开
 ,闭合
,闭合 。电路中每通过2 mol电子,消耗氢气的体积为
。电路中每通过2 mol电子,消耗氢气的体积为(4)离子膜电解法常用于制备金属氧化物或金属氧化物的前驱体。一种电解
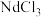 溶液制备难溶物
溶液制备难溶物 的装置示意图如图(b)所示。
的装置示意图如图(b)所示。
①为了获得更多的
 ,应选用
,应选用②电极B的电极反应式为
您最近一年使用:0次
解题方法
8 .  和乙烷反应是实现碳减排目标、利用非常规能源的重要手段。涉及的反应如下:
和乙烷反应是实现碳减排目标、利用非常规能源的重要手段。涉及的反应如下:
(i)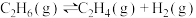

(ii)

(1)反应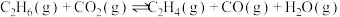 的平衡常数可表示为
的平衡常数可表示为 ,则
,则
_______ (用 、
、 表示)。
表示)。
(2)在恒温恒容条件下, 在密闭容器中发生反应(i)。下列说法中能表明反应体系已达平衡状态的有_______(填标号)。
在密闭容器中发生反应(i)。下列说法中能表明反应体系已达平衡状态的有_______(填标号)。
(3)与反应(i)相比,加入 发生反应(ii)后,
发生反应(ii)后, 的转化率明显增大,其原因为
的转化率明显增大,其原因为_______ 。
(4) 在催化剂表面反应时有多种可能的路径,如图所示。其中最主要的路径为路径
在催化剂表面反应时有多种可能的路径,如图所示。其中最主要的路径为路径_______ (填“Ⅰ”“Ⅱ”或“Ⅲ”),该路径中的速控步为_______ (用方程式表示)。

(5)一定温度和压强下,向密闭容器中充入一定量的 和
和 进行模拟实验,部分物质的相关信息如下表:
进行模拟实验,部分物质的相关信息如下表:
达到平衡时,
_______ , 的物质的量分数为
的物质的量分数为_______ ,反应(ii)的化学平衡常数为_______ 。
 和乙烷反应是实现碳减排目标、利用非常规能源的重要手段。涉及的反应如下:
和乙烷反应是实现碳减排目标、利用非常规能源的重要手段。涉及的反应如下:(i)
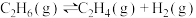

(ii)


(1)反应
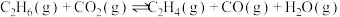 的平衡常数可表示为
的平衡常数可表示为 ,则
,则
 、
、 表示)。
表示)。(2)在恒温恒容条件下,
 在密闭容器中发生反应(i)。下列说法中能表明反应体系已达平衡状态的有_______(填标号)。
在密闭容器中发生反应(i)。下列说法中能表明反应体系已达平衡状态的有_______(填标号)。| A.混合气体的压强不再改变 |
| B.混合气体的平均相对分子质量不变 |
C.每消耗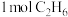 的同时生成 的同时生成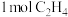 |
D.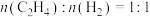 |
 发生反应(ii)后,
发生反应(ii)后, 的转化率明显增大,其原因为
的转化率明显增大,其原因为(4)
 在催化剂表面反应时有多种可能的路径,如图所示。其中最主要的路径为路径
在催化剂表面反应时有多种可能的路径,如图所示。其中最主要的路径为路径
(5)一定温度和压强下,向密闭容器中充入一定量的
 和
和 进行模拟实验,部分物质的相关信息如下表:
进行模拟实验,部分物质的相关信息如下表:| 物质 |  |  |  |
| n(投料)/mol | 1 | 1.5 | 0 |
| n(平衡)/mol | 0.5 | x | 0.2 |
达到平衡时,

 的物质的量分数为
的物质的量分数为
您最近一年使用:0次
解题方法
9 . 将 转化为
转化为 等燃料是有效的减排手段.已知
等燃料是有效的减排手段.已知 与
与 在倠化剂作用下合成甲醇的主要反应如下:
在倠化剂作用下合成甲醇的主要反应如下:
①
②
(1)反应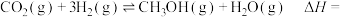
__________  .
.
(2)若反应②正反应的活化能为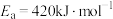 .则其逆反应的活化能
.则其逆反应的活化能
__________  .
.
(3) 与
与 在催化剂表面上的部分反应历程如图,其中吸附在催化剂表面上的物种用·标注,Ts表示过渡态.
在催化剂表面上的部分反应历程如图,其中吸附在催化剂表面上的物种用·标注,Ts表示过渡态.
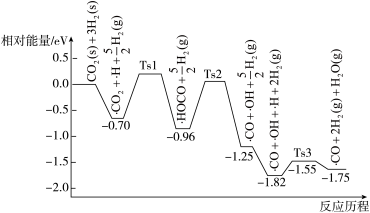
该反应历程中决速步骤的化学方程式为________________ .
(4)在一体积为3 L的恒容密闭容器内充入 和
和 发生反应
发生反应 .测得反应过程中
.测得反应过程中 的平衡转化率
的平衡转化率 与温度和压强的关系如图所示。
与温度和压强的关系如图所示。

①X表示____________ (填“温度”或“压强”)。
②
______________ (填“>”、“<”或“=”,下同) ,反应速率
,反应速率
____________ 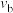 。
。
③a、b、c三点的平衡常数由大到小的顺序是____________ 。
④b点所处状态下的平衡常数
____________ 。
 转化为
转化为 等燃料是有效的减排手段.已知
等燃料是有效的减排手段.已知 与
与 在倠化剂作用下合成甲醇的主要反应如下:
在倠化剂作用下合成甲醇的主要反应如下:①

②

(1)反应
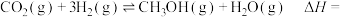
 .
.(2)若反应②正反应的活化能为
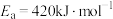 .则其逆反应的活化能
.则其逆反应的活化能
 .
.(3)
 与
与 在催化剂表面上的部分反应历程如图,其中吸附在催化剂表面上的物种用·标注,Ts表示过渡态.
在催化剂表面上的部分反应历程如图,其中吸附在催化剂表面上的物种用·标注,Ts表示过渡态.
该反应历程中决速步骤的化学方程式为
(4)在一体积为3 L的恒容密闭容器内充入
 和
和 发生反应
发生反应 .测得反应过程中
.测得反应过程中 的平衡转化率
的平衡转化率 与温度和压强的关系如图所示。
与温度和压强的关系如图所示。
①X表示
②

 ,反应速率
,反应速率
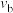 。
。③a、b、c三点的平衡常数由大到小的顺序是
④b点所处状态下的平衡常数

您最近一年使用:0次
解题方法
10 . 有机物A、B、C、D、E、F的转化关系如图。已知A的产量是衡量一个国家石油化工水平的标志,E具有浓郁香味,F常用于制造食物保鲜膜。回答下列问题:

(1)C中官能团的名称为______ ;A→F的反应类型为_____ 。
(2)写出B+D→E的化学方程式:_______ 。
(3)A→B的反应过程中的能量变化如图所示。

写出A→B总反应的热化学方程式:_______ 。
(4)交警对司机“酒驾”进行呼气检测的化学原理是:经硫酸酸化处理的三氧化铬(CrO3)(与重铬酸钾原理类似)硅胶检查司机呼出的气体,根据硅胶颜色的变化(硅胶中的+6价铬能被B蒸气还原为+3价铬,颜色发生变化)判断司机是否饮酒,写出K2Cr2O7的酸性溶液与B反应生成D的离子方程式:______ 。
(5)研究发现,在酸性B燃料电池中加入硝酸,可使电池持续大电流放电,其工作原理如图所示:
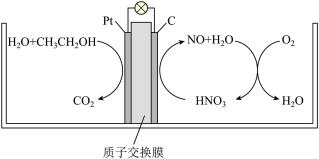
则硝酸的作用为______ ,负极电极反应式为______ 。

(1)C中官能团的名称为
(2)写出B+D→E的化学方程式:
(3)A→B的反应过程中的能量变化如图所示。

写出A→B总反应的热化学方程式:
(4)交警对司机“酒驾”进行呼气检测的化学原理是:经硫酸酸化处理的三氧化铬(CrO3)(与重铬酸钾原理类似)硅胶检查司机呼出的气体,根据硅胶颜色的变化(硅胶中的+6价铬能被B蒸气还原为+3价铬,颜色发生变化)判断司机是否饮酒,写出K2Cr2O7的酸性溶液与B反应生成D的离子方程式:
(5)研究发现,在酸性B燃料电池中加入硝酸,可使电池持续大电流放电,其工作原理如图所示:

则硝酸的作用为
您最近一年使用:0次



