名校
1 . Ⅰ.认识反应条件对化学反应方向,限度及快慢的影响,有利于运用这些规律解决实际问题。
(1)下列有关说法正确的是__________
(2) 与
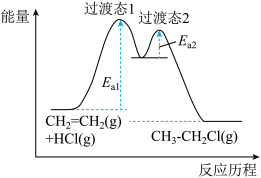
与 的加成反应分为两步,能量与反应历程如图所示。下列说法中正确的是__________
的加成反应分为两步,能量与反应历程如图所示。下列说法中正确的是__________
(3)一定条件下 在催化剂表面与水发生反应
在催化剂表面与水发生反应 ,
, ,如果反应的平衡常数K值变大,该反应__________
,如果反应的平衡常数K值变大,该反应__________
(4)下列有关可逆反应: 的分析中,一定正确的是__________
的分析中,一定正确的是__________
Ⅱ.金属钛(Ti)在工业领域有着重要用途。目前生产钛的方法之一是先将 转化为
转化为 ,再进一步还原得到钛。工业上将
,再进一步还原得到钛。工业上将 转化为
转化为 的方法为:
的方法为:
碳氯化法:
(5)平衡常数表达式
___________ ;恒温恒容时,下列叙述一定能说明该反应达到平衡状态的是___________ 。
A.混合气体的压强保持不变 B.
C.混合气体的密度保持不变 D. 和
和 物质的量相等
物质的量相等
(6)若反应容器的容积为 ,
, 后,测得固体的质量减少
后,测得固体的质量减少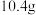 ,则
,则 的平均反应速率为
的平均反应速率为___________ 。从碰撞理论解释升高温度反应速率加快的原因:___________ 。
Ⅲ.工业上将 转化为
转化为 的方法为还有直接氯化法:
的方法为还有直接氯化法:
直接氯化法:
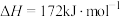
(7)从 和
和 的角度说明碳氯化法的反应趋势远大于直接氯化法的原因:
的角度说明碳氯化法的反应趋势远大于直接氯化法的原因:___________ 。
(8)由 冶炼钛方法有:900℃,
冶炼钛方法有:900℃,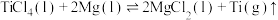 ;从平衡移动角度解释上述冶炼金属钛的反应原理
;从平衡移动角度解释上述冶炼金属钛的反应原理___________ 。
(1)下列有关说法正确的是__________
A.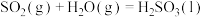 ,该过程熵值增大 ,该过程熵值增大 |
B.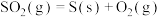 , , ,该反应一定能自发进行 ,该反应一定能自发进行 |
C.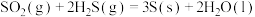 ,该过程熵值增大 ,该过程熵值增大 |
D. , , , , ,此反应低温自发 ,此反应低温自发 |
 与
与 的加成反应分为两步,能量与反应历程如图所示。下列说法中正确的是__________
的加成反应分为两步,能量与反应历程如图所示。下列说法中正确的是__________
| A.决速步骤是第一步 | B.总反应为吸热反应 |
| C.总能量:反应物低于生成物 | D.过渡态1比过渡态2更稳定 |
 在催化剂表面与水发生反应
在催化剂表面与水发生反应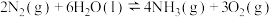 ,
, ,如果反应的平衡常数K值变大,该反应__________
,如果反应的平衡常数K值变大,该反应__________| A.在平衡移动时正反应速率先减小后增大 | B.一定向正反应方向移动 |
| C.在平衡移动时逆反应速率先增大后减小 | D.一定向逆反应方向移动 |
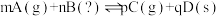 的分析中,一定正确的是__________
的分析中,一定正确的是__________A.增大压强,平衡不移动,则 |
| B.升高温度,A的转化率诚小,则正反应是吸热反应 |
| C.保持容器体积不变,移走C,平衡正向移动,正反应速率增大 |
| D.保持容器体积不变,加入B,容器中D的质量增加,则B是气体 |
Ⅱ.金属钛(Ti)在工业领域有着重要用途。目前生产钛的方法之一是先将
 转化为
转化为 ,再进一步还原得到钛。工业上将
,再进一步还原得到钛。工业上将 转化为
转化为 的方法为:
的方法为:碳氯化法:

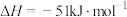
(5)平衡常数表达式

A.混合气体的压强保持不变 B.

C.混合气体的密度保持不变 D.
 和
和 物质的量相等
物质的量相等(6)若反应容器的容积为
 ,
, 后,测得固体的质量减少
后,测得固体的质量减少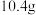 ,则
,则 的平均反应速率为
的平均反应速率为Ⅲ.工业上将
 转化为
转化为 的方法为还有直接氯化法:
的方法为还有直接氯化法:直接氯化法:

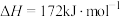
(7)从
 和
和 的角度说明碳氯化法的反应趋势远大于直接氯化法的原因:
的角度说明碳氯化法的反应趋势远大于直接氯化法的原因:(8)由
 冶炼钛方法有:900℃,
冶炼钛方法有:900℃,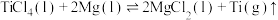 ;从平衡移动角度解释上述冶炼金属钛的反应原理
;从平衡移动角度解释上述冶炼金属钛的反应原理
您最近一年使用:0次
2023-04-30更新
|
354次组卷
|
2卷引用:山东省青岛第十九中学2023-2024学年高二上学期期中考试化学试卷
名校
2 . 已知 和
和 可以相互转化
可以相互转化 ,反应每生成1mol
,反应每生成1mol 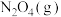 ,放出24.2kJ的热量。在恒温条件下,将一定量的
,放出24.2kJ的热量。在恒温条件下,将一定量的 和
和 混合气体通入容积为2L的密闭容器中,反应物浓度随时间变化关系如下图。下列说法错误的是
混合气体通入容积为2L的密闭容器中,反应物浓度随时间变化关系如下图。下列说法错误的是

 和
和 可以相互转化
可以相互转化 ,反应每生成1mol
,反应每生成1mol 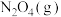 ,放出24.2kJ的热量。在恒温条件下,将一定量的
,放出24.2kJ的热量。在恒温条件下,将一定量的 和
和 混合气体通入容积为2L的密闭容器中,反应物浓度随时间变化关系如下图。下列说法错误的是
混合气体通入容积为2L的密闭容器中,反应物浓度随时间变化关系如下图。下列说法错误的是
A.曲线X表示 浓度的变化 浓度的变化 |
B.前10min内用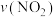 表示的化学反应速率为0.02mol/(L·min) 表示的化学反应速率为0.02mol/(L·min) |
C.图中a、b、c、d四个点中,a、c两点的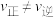 |
| D.反应进行到10min时放出的热量为9.68kJ |
您最近一年使用:0次
2023-04-30更新
|
356次组卷
|
3卷引用:山东省青岛第二中学2022-2023学年高一下学期期中考试化学试题
名校
3 . 如图是氢气和卤素单质( )反应的能量变化示意图。下列说法正确的是
)反应的能量变化示意图。下列说法正确的是
 )反应的能量变化示意图。下列说法正确的是
)反应的能量变化示意图。下列说法正确的是
A.用电子式表示HBr的形成过程: |
| B.热稳定性:HI<HBr<HCl<HF |
C.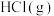 分解生成 分解生成 和 和 需要吸收183kJ的热量 需要吸收183kJ的热量 |
D.由图可知1mol  与 与 反应生成2mol 反应生成2mol 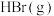 放出的热量为97kJ 放出的热量为97kJ |
您最近一年使用:0次
2023-04-30更新
|
451次组卷
|
6卷引用:山东省青岛第二中学2022-2023学年高一下学期期中考试化学试题
4 . 氯仿(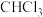 )常用作有机溶剂和麻醉剂,常温下在空气中易被氧化。实验室中可用热还原
)常用作有机溶剂和麻醉剂,常温下在空气中易被氧化。实验室中可用热还原 制备氯仿,装置示意图及有关物质性质如下:
制备氯仿,装置示意图及有关物质性质如下:
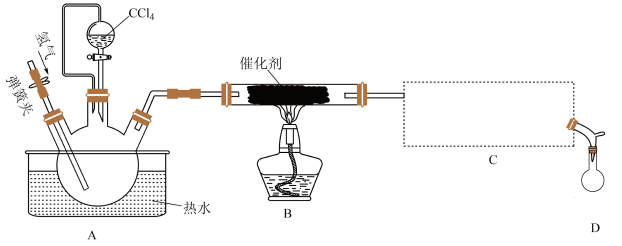
相关实验步骤如下:
①检查装置气密性;②开始通入氢气;③点燃B处酒精灯;④向A处水槽中加入热水,接通C处冷凝装置的冷水;⑤向三颈烧瓶中滴入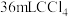 ;⑥反应结束后,停止加热,将D处锥形瓶中收集到的液体分别用适量
;⑥反应结束后,停止加热,将D处锥形瓶中收集到的液体分别用适量 溶液和水洗涤,分离出产物加入少量无水
溶液和水洗涤,分离出产物加入少量无水 ,静止后过滤;⑦对滤液进行蒸馏纯化,得到氯仿28.29g。
,静止后过滤;⑦对滤液进行蒸馏纯化,得到氯仿28.29g。
请回答下列问题:
(1)C处应选用冷凝管为___________ (填字母)。

(2)设计②③先后顺序的目的是___________ 。
(3)向A处水槽中加入热水的目的是___________ 。
(4)装置B处反应为可逆反应,停止加热一段时间后,发现催化剂仍保持红热状态,说明B处生成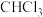 反应的
反应的
___________ (填“<”或“>”)0,B中发生反应的化学方程式为___________ 。
(5)牛角管支管的作用是___________ 。
(6)该实验中氯仿产率为___________ (保留3位有效数字)。
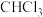 )常用作有机溶剂和麻醉剂,常温下在空气中易被氧化。实验室中可用热还原
)常用作有机溶剂和麻醉剂,常温下在空气中易被氧化。实验室中可用热还原 制备氯仿,装置示意图及有关物质性质如下:
制备氯仿,装置示意图及有关物质性质如下:
| 物质 | 相对分子质量 | 密度/( ) ) | 沸点/℃ | 溶解性 |
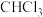 | 119.5 | 1.50 | 61.3 | 难溶于水 |
 | 154 | 1.59 | 76.7 | 难溶于水 |
①检查装置气密性;②开始通入氢气;③点燃B处酒精灯;④向A处水槽中加入热水,接通C处冷凝装置的冷水;⑤向三颈烧瓶中滴入
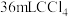 ;⑥反应结束后,停止加热,将D处锥形瓶中收集到的液体分别用适量
;⑥反应结束后,停止加热,将D处锥形瓶中收集到的液体分别用适量 溶液和水洗涤,分离出产物加入少量无水
溶液和水洗涤,分离出产物加入少量无水 ,静止后过滤;⑦对滤液进行蒸馏纯化,得到氯仿28.29g。
,静止后过滤;⑦对滤液进行蒸馏纯化,得到氯仿28.29g。请回答下列问题:
(1)C处应选用冷凝管为

(2)设计②③先后顺序的目的是
(3)向A处水槽中加入热水的目的是
(4)装置B处反应为可逆反应,停止加热一段时间后,发现催化剂仍保持红热状态,说明B处生成
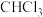 反应的
反应的
(5)牛角管支管的作用是
(6)该实验中氯仿产率为
您最近一年使用:0次
5 . 锂电池有广阔的应用前景。用“循环电沉积”法处理某种锂电池,可使其中的Li电极表面生成只允许 通过的
通过的 和C保护层,工作原理如图1,具体操作如下。
和C保护层,工作原理如图1,具体操作如下。
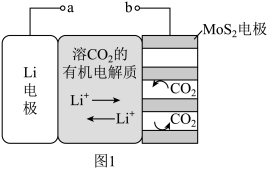
i.将表面洁净的Li电极和 电极浸在溶有
电极浸在溶有 的有机电解质溶液中。
的有机电解质溶液中。
ii.0-5min,a端连接电源正极,b端连接电源负极,电解, 电极上生成
电极上生成 和C。
和C。
iii.5-10min,a端连接电源负极,b端连接电源正极,电解, 电极上消耗
电极上消耗 和C,Li电极上生成
和C,Li电极上生成 和C,步骤ⅱ和步骤iii为1个电沉积循环。
和C,步骤ⅱ和步骤iii为1个电沉积循环。
iv.重复步骤ⅱ和步骤ⅲ的操作,继续完成9个电沉积循环。
(1)步骤ii内电路中的 由
由_______ 向_______ 迁移(填“Li电极”或“ 电极”)。
电极”)。
(2)已知下列反应的热化学方程式。
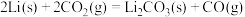


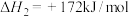
步骤ⅱ电解总反应的热化学方程式为_______ 。
(3)步骤ⅲ中,Li电极的电极反应式为_______ 。
(4) 和C只有在
和C只有在 的催化作用下才能发生步骤ⅲ的电极反应,反应历程中的能量变化如下图。下列说法正确的是
的催化作用下才能发生步骤ⅲ的电极反应,反应历程中的能量变化如下图。下列说法正确的是_______ (填字母序号)。
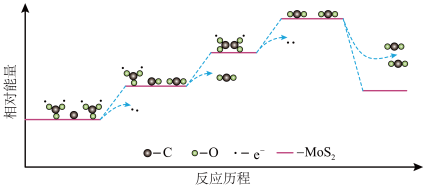
a.反应历程中存在碳氧键的断裂和形成
b.反应历程中涉及电子转移的变化均释放能量
c. 催化剂通过降低电极反应的活化能使反应速率加快
催化剂通过降低电极反应的活化能使反应速率加快
 通过的
通过的 和C保护层,工作原理如图1,具体操作如下。
和C保护层,工作原理如图1,具体操作如下。
i.将表面洁净的Li电极和
 电极浸在溶有
电极浸在溶有 的有机电解质溶液中。
的有机电解质溶液中。ii.0-5min,a端连接电源正极,b端连接电源负极,电解,
 电极上生成
电极上生成 和C。
和C。iii.5-10min,a端连接电源负极,b端连接电源正极,电解,
 电极上消耗
电极上消耗 和C,Li电极上生成
和C,Li电极上生成 和C,步骤ⅱ和步骤iii为1个电沉积循环。
和C,步骤ⅱ和步骤iii为1个电沉积循环。iv.重复步骤ⅱ和步骤ⅲ的操作,继续完成9个电沉积循环。
(1)步骤ii内电路中的
 由
由 电极”)。
电极”)。(2)已知下列反应的热化学方程式。
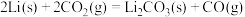


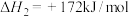
步骤ⅱ电解总反应的热化学方程式为
(3)步骤ⅲ中,Li电极的电极反应式为
(4)
 和C只有在
和C只有在 的催化作用下才能发生步骤ⅲ的电极反应,反应历程中的能量变化如下图。下列说法正确的是
的催化作用下才能发生步骤ⅲ的电极反应,反应历程中的能量变化如下图。下列说法正确的是
a.反应历程中存在碳氧键的断裂和形成
b.反应历程中涉及电子转移的变化均释放能量
c.
 催化剂通过降低电极反应的活化能使反应速率加快
催化剂通过降低电极反应的活化能使反应速率加快
您最近一年使用:0次
名校
6 .  在光照条件下与
在光照条件下与 反应,可得到各种氯代甲烷。
反应,可得到各种氯代甲烷。
(1)写出生成 的化学方程式是
的化学方程式是_______ 。
(2) 氯代的机理为自由基(带有单电子的原子或原子团,如
氯代的机理为自由基(带有单电子的原子或原子团,如 、
、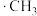 )反应,包括以下几步:
)反应,包括以下几步:
①写出由 生成
生成 过程中链传递的方程式:
过程中链传递的方程式:_______ ,_______ 。
②不同卤原子自由基(X·)均可夺取 中的H,反应通式:
中的H,反应通式: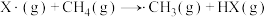 。
。
已知:25℃, 时,断裂
时,断裂 中
中 和
和 中
中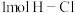 键分别需要吸收
键分别需要吸收 和
和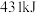 的能量。
的能量。
a.计算当X为 时,上述反应
时,上述反应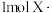 参与反应
参与反应_______ (“吸收”或“放出”)_______ kJ能量。
b.若X依次为F、 、
、 、I,则放出或吸收的能量随着原子序数增大逐渐
、I,则放出或吸收的能量随着原子序数增大逐渐_______ (填“增大”或“减小”),结合原子结构解释原因:_______ 。
③探究光照对 与
与 反应的影响,实验如下。
反应的影响,实验如下。
a.由B和D得出的结论是_______ 。
b.依据上述机理,解释C中几乎没有氯代甲烷的原因:_______ 。
(3)丙烷氯代反应中链传递的一步反应能量变化如下。
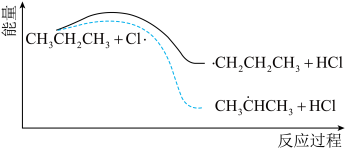
推知断裂 中
中 比断裂
比断裂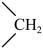 中
中 所需能量
所需能量_______ (填“大”或“小”)。
 在光照条件下与
在光照条件下与 反应,可得到各种氯代甲烷。
反应,可得到各种氯代甲烷。(1)写出生成
 的化学方程式是
的化学方程式是(2)
 氯代的机理为自由基(带有单电子的原子或原子团,如
氯代的机理为自由基(带有单电子的原子或原子团,如 、
、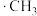 )反应,包括以下几步:
)反应,包括以下几步:| I.链引发 | II.链传递 | III.链终止 |
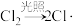 |  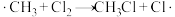 …… |   …… |
 生成
生成 过程中链传递的方程式:
过程中链传递的方程式:②不同卤原子自由基(X·)均可夺取
 中的H,反应通式:
中的H,反应通式: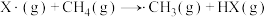 。
。已知:25℃,
 时,断裂
时,断裂 中
中 和
和 中
中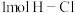 键分别需要吸收
键分别需要吸收 和
和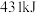 的能量。
的能量。a.计算当X为
 时,上述反应
时,上述反应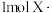 参与反应
参与反应b.若X依次为F、
 、
、 、I,则放出或吸收的能量随着原子序数增大逐渐
、I,则放出或吸收的能量随着原子序数增大逐渐③探究光照对
 与
与 反应的影响,实验如下。
反应的影响,实验如下。| 编号 | 操作 | 结果 |
| A | 将 与 与 混合后,光照 混合后,光照 | 得到氯代甲烷 |
| B | 将 先用光照,然后迅速在黑暗中与 先用光照,然后迅速在黑暗中与 混合 混合 | 得到氯代甲烷 |
| C | 将 先用光照,然后在黑暗中放置一段时间,再与 先用光照,然后在黑暗中放置一段时间,再与 混合 混合 | 几乎无氯代甲烷 |
| D | 将 先用光照,然后迅速在黑暗中与 先用光照,然后迅速在黑暗中与 混合 混合 | 几乎无氯代甲烷 |
b.依据上述机理,解释C中几乎没有氯代甲烷的原因:
(3)丙烷氯代反应中链传递的一步反应能量变化如下。

推知断裂
 中
中 比断裂
比断裂 中
中 所需能量
所需能量
您最近一年使用:0次
名校
7 . 下列说法正确的是
| A.凡是有化学键断裂的变化一定是化学变化 | B.离子化合物中一定只含离子键 |
| C.金属与非金属元素可以形成共价化合物 | D.放热反应一定不需要加热就能发生 |
您最近一年使用:0次
名校
解题方法
8 . Ⅰ.在25℃、101kPa的条件下,已知部分化学键的断裂涉及能量变化如下图所示,请回答下列有关问题:

(1)对于反应 ,经实验测得每生成
,经实验测得每生成
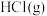 时,反应过程中放出
时,反应过程中放出 的热量,则断开
的热量,则断开
 键所需的能量是
键所需的能量是___________ kJ。
(2)有两个反应:a. ,b.
,b. 。这两个反应中,相同物质的量的
。这两个反应中,相同物质的量的 、
、 反应生成相同质量的
反应生成相同质量的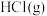 时,放出的能量
时,放出的能量___________ (填“相等”或“不相等”)。
(3)据下图能量转化关系,生成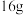

___________ (填“吸收”或“放出”)的能量___________ (填“>”、“=”或“<”) 。
。
Ⅱ.下图为原电池装置示意图,设 为阿伏加德罗常数:
为阿伏加德罗常数:

(4)若A为Zn片,B为石墨棒,电解质溶液为稀硫酸,写出正极的电极反应式___________ ,反应过程中溶液的酸性___________ (填“变大”“变小”或“不变”)。一段时间后,当在电池中放出3.36L(标准状况)气体时,电路中有___________ 个电子通过了导线。
(5)若电池的总反应为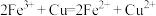 ,负极材料是
,负极材料是___________ (填名称),负极的电极反应式为___________ 。
(6)若A为镁片,B为铝片,电解质为NaOH溶液,则铝片为___________ 极(填“正”或“负”)。

(1)对于反应
 ,经实验测得每生成
,经实验测得每生成
 时,反应过程中放出
时,反应过程中放出 的热量,则断开
的热量,则断开
 键所需的能量是
键所需的能量是(2)有两个反应:a.
 ,b.
,b. 。这两个反应中,相同物质的量的
。这两个反应中,相同物质的量的 、
、 反应生成相同质量的
反应生成相同质量的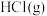 时,放出的能量
时,放出的能量(3)据下图能量转化关系,生成

 。
。
Ⅱ.下图为原电池装置示意图,设
 为阿伏加德罗常数:
为阿伏加德罗常数:
(4)若A为Zn片,B为石墨棒,电解质溶液为稀硫酸,写出正极的电极反应式
(5)若电池的总反应为
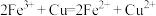 ,负极材料是
,负极材料是(6)若A为镁片,B为铝片,电解质为NaOH溶液,则铝片为
您最近一年使用:0次
名校
9 . 下列图示与对应的叙述相符的是
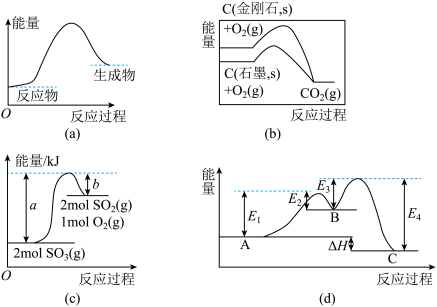

| A.(a)图表示反应物断键吸收的能量小于生成物成键放出的能量 |
B.(b)图是金刚石与石墨分别被氧化生成 的能量关系曲线,说明石墨转化为金刚石为吸热反应 的能量关系曲线,说明石墨转化为金刚石为吸热反应 |
C.由(c)图可知,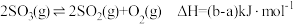 |
D.(d)图是某反应:A→C(由两步反应A→B→C完成,B为中间产物)的能量曲线(E表示能量),整个反应中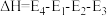 |
您最近一年使用:0次
2023-04-13更新
|
578次组卷
|
2卷引用:山东省青岛市39中2022-2023学年高一下学期期中考试化学试题
名校
解题方法
10 . N2和H2在催化剂表面合成氨的微观历程及能量变化的示意图如图所示,用 、
、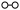 、
、 分别表示N2、H2、NH3,下列说法正确的是
分别表示N2、H2、NH3,下列说法正确的是

 、
、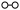 、
、 分别表示N2、H2、NH3,下列说法正确的是
分别表示N2、H2、NH3,下列说法正确的是
| A.使用催化剂时,合成氨的反应放出的热量减少 |
| B.在该过程中,N原子和H原子形成的NH3是电解质 |
| C.在该过程中,N2、H2断键形成N原子和H原子 |
| D.合成氨反应中,反应物断键吸收的能量大于生成物形成新键释放的能量 |
您最近一年使用:0次
2023-03-27更新
|
802次组卷
|
5卷引用:山东省青岛第十九中学2022-2023学年高一4月月考化学试题



