解题方法
1 . 多相催化反应是在催化剂表面通过吸附、解吸过程进行的,我国学者研究发现T℃时,甲醇(CH3OH)与水在铜基催化剂上的反应机理如图所示:
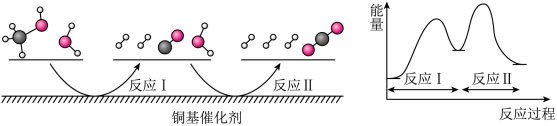
下列说法中正确的是

下列说法中正确的是
A.反应Ⅰ的热化学方程式为  |
B.总反应为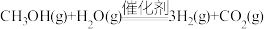  |
| C.从提高转化率的角度考虑,应选择高温高压的条件 |
D.优良的催化剂降低反应的活化能,并减小 ,提高了反应速率 ,提高了反应速率 |
您最近一年使用:0次
2 . 下列反应既属于氧化还原反应,又是吸热反应的是
| A.锌粒与稀硫酸的反应 | B.Ba(OH)2·8H2O晶体与NH4Cl晶体的反应 |
| C.甲烷在氧气中的燃烧反应 | D.灼热的木炭与CO2反应 |
您最近一年使用:0次
2020-12-22更新
|
1684次组卷
|
94卷引用:2015-2016学年山东济南一中高一下期末化学试卷
2015-2016学年山东济南一中高一下期末化学试卷山东省平邑县曾子学校2016-2017学年高一下学期期末考试化学试题(已下线)2010年广东省佛山一中高一下学期期末考试化学试题2014-2015学年江西省新余市高一下学期期末考试化学试卷2014-2015学年四川省绵阳市高中高一第二学期期末化学试卷2015-2016学年四川省雅安市高二上学期期末考试化学试卷2015-2016学年湖南省常德一中高二上学期期末理化学试卷2015-2016学年山东大学附中实验学校高一下第一次月考化学试卷2015-2016学年黑龙江省伊春二中高一下期末化学试卷12015-2016学年黑龙江省伊春二中高一下期末化学试卷2四川省资阳市2016-2017学年高一下学期期末考试化学试题甘肃省武威市第六中学2016-2017学年高一下学期期末化学试题四川省南充高级中学2016-2017学年高一下学期期末考试化学试题安徽省滁州市定远县民族中学2017-2018学年高一下学期期末考试化学试题山东省泰安市宁阳县第一中学2018-2019学年高一下学期期中考试化学试题河北安平中学2018-2019学年高二下学期期末考试化学试题山西省平遥中学2018-2019学年高一下学期期末考试化学试题(已下线)【新东方】 2020-10湖南省娄底市2019-2020学年高一下学期期末考试化学试题湖南省邵东县第一中学2019-2020学年高一下学期期末考试化学试题新疆巴音郭楞蒙古自治州库尔勒市2017-2018学年高一下学期期末考试化学试题河北省秦皇岛市卢龙县木井中学2019-2020学年高一下学期期末考试化学试题安徽省六安市新安中学2020-2021学年高二上学期期末考试(普通班)化学试题河南省商丘市柘城县柘城第四高级中学2020-2021学年高一下学期期末考试化学(理)试题甘肃省永昌县第一高级中学2020-2021学年高一下学期期末考试化学试题(已下线)2010-2011学年吉林省汪清中学高一下学期期中考试化学试卷(已下线)2010-2011学年陕西省大荔县朝邑中学高一下学期期中考试化学试题(已下线)2012-2013学年广东省揭阳一中高一下学期期中考试化学文科试卷2014-2015广东省汕头市南澳中学高一下学期期中考试化学试卷2015-2016学年江苏省泰州中学高一下第一次月考化学试卷2015-2016学年新疆生产建设兵团二中高一下期中化学试卷2015-2016学年云南省曲靖一中高一下期中化学试卷2015-2016学年陕西省西安交大二中南校高一下学期期中考试化学试卷河北省定州市第二中学2016-2017学年高一4月月考化学试题山西省新绛县2016-2017学年高一下学期期中考试化学试题江西省南昌市第二中学2016-2017学年高一下学期期中考试化学试题.新疆生产建设兵团第二中学2016-2017学年高一下学期第二次月考化学试题陕西省西安中学2016-2017学年高一(实验班)下学期期中考试化学试题福建省三明市第一中学2016-2017学年高一下学期半期考试化学试题广西桂林市第一中学2016-2017学年高一下学期期中质量检测化学试题江苏省东台市时堰中学等六校2016-2017学年高一下学期期中联考化学试题天津市静海县第一中学2017-2018学年高一4月学生学业能力调研测试化学试题安徽省滁州市定远县育才学校2018-2019学年高二(实验班)上学期第一次月考化学试题【全国百强校】四川省双流县棠湖中学2018-2019学年高一上学期第三次月考化学试题山西省阳泉市第二中学2018-2019学年高一下学期期中考试化学试题广东省佛山市三水区实验中学2018-2019学年高一下学期第三学段考试化学试题甘肃省靖远县第四中学2018-2019学年高一下学期期中考试化学试题湖南省邵东县第一中学、娄底三中2019-2020学年高二上学期第一次月考化学试题新疆乌鲁木齐市第四中学2019-2020学年高二上学期期中考试化学试题人教版 高中化学 必修2 第二章 《化学反应与能量》 测试卷广东省广州市天河区华南师范大学附属中学2020届高三化学专题训练(7)山西省芮城市2019-2020学年高一下学期3月月考化学试题四川省绵阳南山中学实验学校2019-2020学年高一下学期开学考试化学试题湖南省常德市桃花源一中2019-2020学年高一下学期期中考试化学试题天津市静海区第一中学2019-2020学年高一下学期期中考试(等级班)化学试题河北省唐山市第一中学2019-2020学年高一下学期期中考试化学试题北京市第八十中学2019-2020学年高一下学期期中考试化学试题吉林省辽源市辽县第一高级中学2019-2020高一下学期期中考试化学试题四川省遂宁市船山区第二中学校2019-2020学年高一下学期期中考试化学试题陕西省西安中学2019-2020学年高一下学期期中考试(平行班)化学试题四川省射洪中学校2019-2020学年高一下学期期中考试化学试题(已下线)第09练 化学反应与能量的变化-2020年【衔接教材·暑假作业】新高二化学(人教版)河北省衡水市桃城区第十四中学2019-2020学年高一下学期第三次综合测试化学试题甘肃省定西市岷县第一中学2019-2020学年高一下学期第二次月考化学试题江苏省清江中学2019-2020学年高一下学期期中考试化学试题河北省邢台市第二中学2020-2021学年高二上学期开学摸底考试化学试题贵州省遵义市航天高级中学2020-2021学年高二上学期第一次月考化学(文)试题江西省宜丰二中2021届高三上学期第一次月考化学试题河北省沧州市任丘市第一中学2020-2021学年高二上学期第一次阶段考试化学试题高中化学苏教2019版必修第二册-专题6 本专题达标检测人教版2019必修第二册 第六章 第一节 第1课时 化学反应与热能(已下线)6.2.1 放热反应与吸热反应 练习-2020-2021学年下学期高一化学同步精品课堂(苏教版2019必修第二册)安徽省六安市新安中学2020-2021学年高二下学期入学考试(普通班)化学试题江苏省盐城市伍佑中学2020-2021学年高一下学期第一次阶段考试化学试题甘肃省兰州市第一中学2020-2021学年高一下学期4月月考化学试题浙江省淳安县汾口中学2020-2021学年高一3月月考化学试题福建省南平市浦城县2020-2021学年高一下学期期中考试化学试题四川省南充高级中学2020-2021学年高一下学期期中考试化学试题河北省/唐山市第十一中学2020-2021学年高一下学期期中考试化学试题新疆阿克苏沙雅县沙雅一中2020-2021学年高一下学期期中考试化学试题江苏省盐城市华东师范大学盐城实验中学2020-2021学年高一下学期第二次质量监测化学试题云南省丽江市玉龙纳西族自治县田家炳民族中学2020-2021学年高一下学期第一次月考化学(文)试题河北省石家庄私立第一中学2020-2021学年高一下学期第二次调研考试化学试题福建省南安市柳城中学2020-2021学年高一下学期期中考试化学试题甘肃省武威第十八中学2020-2021学年高一下学期期中考试化学试题甘肃省静宁县第一中学2020-2021学年高一下学期第二次月考化学(普通班)试题山西省实验中学2021-2022学年高二下学期开学分班素质测试化学试题河北省张家口市第一中学2020-2021学年高一下学期期中考试化学试题(已下线)选择性必修1 期中检测(基础过关卷)-【高效检测】2021-2022学年高二化学章末测试卷(人教版2019选择性必修1)吉林省永吉县第四中学2021-2022学年高二上学期第一次月考化学试题甘肃省永昌县第一高级中学2020-2021学年高二上学期期中考试化学(理)试题福建省三明市第二中学2021-2022学年高一下学期第二阶段期中考试化学试题宁夏吴忠中学2021-2022学年高一下学期期中考试化学试题吉林省长春北师大附属学校2021-2022学年高二上学期期中考试化学试题
名校
解题方法
3 . HCOOH在Pd催化剂表面脱氢的反应机理、反应历程与能量的关系如图所示:
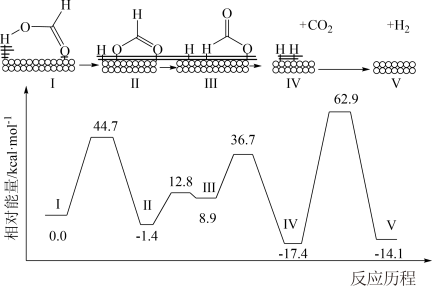
下列说法正确的是

下列说法正确的是
| A.在Pd催化剂表面HCOOH脱氢反应的∆H<0 |
| B.在Pd催化剂表面离解O-H键比C-H键的活化能低 |
| C.用DCOOH或HCOOD代替HCOOH,得到的产物都有HD和CO2 |
| D.在历程Ⅰ~Ⅴ中,生成Ⅴ的反应速率最快 |
您最近一年使用:0次
2020-12-15更新
|
240次组卷
|
2卷引用:山东省滨州市2021届高三上学期期末考试化学试题
12-13高一下·江西抚州·期末
名校
解题方法
4 . 化学能与热能、电能等能相互转化。关于化学能与其他能量相互转化的说法正确的是( )
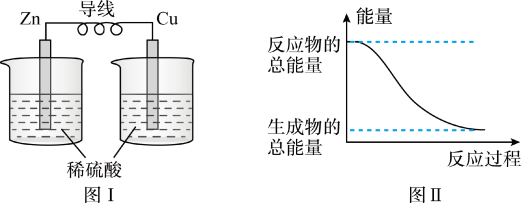

| A.化学反应中能量变化的主要原因是化学键的断裂 |
| B.铝热反应中,反应物的总能量比生成物的总能量低 |
| C.图I所示的装置能将化学能转变为电能 |
| D.图II所示的反应为放热反应 |
您最近一年使用:0次
2020-09-29更新
|
775次组卷
|
22卷引用:2012-2013学年山东省聊城市四县六校高一下学期期末联考化学试卷
(已下线)2012-2013学年山东省聊城市四县六校高一下学期期末联考化学试卷(已下线)2012-2013学年江西省抚州市高一下学期期末考试化学试卷2014-2015学年湖北省宜昌市一般高中高一期末化学试卷2015-2016学年陕西省宝鸡市岐山县高一下期末质检化学试卷山东省曲阜市第一中学2016-2017学年高一下学期期中考试化学试题山西省朔州市第二中学2016-2017学年高一下学期期末考试化学试题江西省南昌市第二中学2019-2020学年高一下学期期末考试化学试题山东省泰安市新泰中学2019级高二上学期期中考试试题山东省新泰第一中学老校区(新泰中学)2020-2021学年高二上学期期中考试化学试题广东省揭阳市惠来一中、揭东一中2016-2017学年高一下学期期末联考化学试题【全国校级联考】辽宁省六校协作体2018-2019学年高二上学期期初考试化学试题辽宁省阜新市第二高级中学2019-2020学年高二上学期第一次月考化学试题辽宁省大连市普兰店区第三十八中学2020-2021学年高二上学期开学考试化学试题(鲁科版2019)必修第二册 阶段性综合评估测试卷(一)山西省忻州市岢岚县中学2020-2021学年高一下学期4月月考化学试题(已下线)第4章 化学反应与电能(章末检测)-2021-2022学年高二化学课时过关提优AB练(人教版2019选择性必修1)(已下线)4.1.1 原电池的工作原理(基础过关A练)-2021-2022学年高二化学课时过关提优AB练(人教版2019选择性必修1)(已下线)第4章 电化学基础(选拔卷)-【单元测试】2021-2022学年高二化学尖子生选拔卷(人教版选修4)甘肃省会宁县第一中学2021-2022学年高一下学期期中(等级考)化学试题黑龙江省伊春市伊美区第二中学2021-2022学年高一下学期期中考试化学试题河北省石家庄市第四十二中学2022-2023高二上学期10月月考化学试题福建省连城县第一中学2022-2023学年高一下学期5月月考化学试题
5 . 下列关于热化学反应的描述中正确的是( )
| A.CO(g)的燃烧热是283.0kJ/mol,则2CO2(g)=2CO(g)+O2(g)反应的△H=+566kJ/mol |
| B.H2SO4和NaOH反应的中和热△H=-57.3kJ/mol,则H2SO4和Ca(OH)2反应的中和热△H=-114.6kJ/mol |
| C.需要加热才能发生的反应一定是吸热反应 |
| D.1mol甲烷燃烧生成气态水和二氧化碳所放出的热量是甲烷燃烧热 |
您最近一年使用:0次
2020-09-05更新
|
167次组卷
|
11卷引用:山东省济宁市特殊教育学校2023-2024学年高三上学期期末化学试卷
山东省济宁市特殊教育学校2023-2024学年高三上学期期末化学试卷(已下线)2011-2012学年浙江省北仑中学高二下学期期中考试化学试卷2014-2015浙江省杭州市西湖中学高二12月月考化学试卷2016-2017学年河北省望都中学高二8月月考化学试卷(已下线)【百强校】2016-2017学年浙江省温州中学高二上期中化学卷(带解析)【全国百强校】广西自治区桂林市第十八中学2018-2019学年高二下学期开学考试化学试题浙江省丽水四校2019-2020学年高三10月联考化学试题甘肃省定西市岷县第二中学2019-2020学年高二上学期期中考试化学试题内蒙古自治区呼和浩特市内蒙古师范大学附属中学2019-2020学年高二上学期期中考试化学试题甘肃省岷县第二中学2020-2021学年高二上学期第一次月考化学试题(已下线)第1章基础巩固测评卷-【帮课堂】2022-2023学年高二化学同步精品讲义(沪科版2020选择性必修第一册)
6 . 某温度时,在2L的密闭容器中,X、Y、Z(均为气体)三种物质的量随时间的变化曲线如图所示:_________ 。
(2)若上述反应中X、Y、Z分别为H2、N2、NH3,某温度下,在容积恒定为2.0L的密闭容器中充入2.0molN2和2.0mol H2,一段时间后反应达平衡状态,实验数据如表所示:
0~50s内的平均反应速率v(N2)=__________ 。
(3)已知:键能指在标准状况下,将lmol气态分子AB(g)解离为气态原子A(g)、B(g)所需的能量,用符号E表示,单位为kJ/mol。H-H的键能为436kJ/mol,N-H的键能为391kJ/mol,生成lmol NH3过程中放出46kJ的热量。则N≡N的键能为_________ kJ/mol。
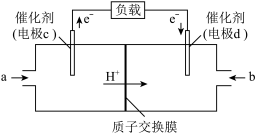
(4)CO与H2反应可制备CH3OH,由CH3OH和O2构成的质子交换膜燃料电池的结构示意图如下。________ (填“正极”或“负极”),c电极的电极反应式为___________ 。若外电路中转移2 mol电子,则上述燃料电池所消耗的O2在标准状况下的体积为______ L。
(5)下列反应中,属于吸热反应的是__________ (填序号)
①物质燃烧 ②炸药爆炸 ③酸碱中和反应 ④二氧化碳通过炽热的碳 ⑤食物因氧化而腐败 ⑥Ba(OH)2·8H2O与NH4Cl反应 ⑦铁粉与稀盐酸反应
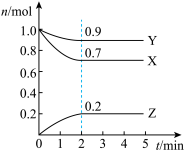
(2)若上述反应中X、Y、Z分别为H2、N2、NH3,某温度下,在容积恒定为2.0L的密闭容器中充入2.0molN2和2.0mol H2,一段时间后反应达平衡状态,实验数据如表所示:
| t/s | 0 | 50 | 150 | 250 | 350 |
| n(NH3) | 0 | 0.36 | 0.48 | 0.50 | 0.50 |
(3)已知:键能指在标准状况下,将lmol气态分子AB(g)解离为气态原子A(g)、B(g)所需的能量,用符号E表示,单位为kJ/mol。H-H的键能为436kJ/mol,N-H的键能为391kJ/mol,生成lmol NH3过程中放出46kJ的热量。则N≡N的键能为
(4)CO与H2反应可制备CH3OH,由CH3OH和O2构成的质子交换膜燃料电池的结构示意图如下。
(5)下列反应中,属于吸热反应的是
①物质燃烧 ②炸药爆炸 ③酸碱中和反应 ④二氧化碳通过炽热的碳 ⑤食物因氧化而腐败 ⑥Ba(OH)2·8H2O与NH4Cl反应 ⑦铁粉与稀盐酸反应
您最近一年使用:0次
2020-09-04更新
|
530次组卷
|
3卷引用:山东省烟台市第二中学2019-2020学年高一下学期期末考试化学试题
7 . 下列实验事实能得出相应结论的是
| 选项 | 实验事实 | 实验结论 |
| A | 将打磨后的镁条放入盛有稀盐酸的试管中,用手触摸试管外壁感觉变热 | 镁条与稀盐酸反应是放热反应 |
| B | 向某酸雨样品中加入Ba(OH)2溶液,有白色沉淀生成 | 酸雨试样中一定含SO |
| C | 将浓硫酸滴到蔗糖表面,固体变黑膨胀,有刺激性气味的气体产生 | 浓硫酸只有脱水性 |
| D | 将某气体通入酸性高锰酸钾溶液,溶液褪色 | 该气体一定是乙烯 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2020-08-14更新
|
238次组卷
|
3卷引用:山东省济宁市2019-2020学年高一下学期期末考试化学试题
8 . 下列反应既是氧化还原反应又是放热反应的是
| A.NaOH和HCl反应 | B.Zn和HCl反应 |
| C.Ba(OH)2•8H2O和NH4Cl反应 | D.H2与Cl2反应 |
您最近一年使用:0次
9 .  ,是工业制硫酸的主要反应之一,研究该反应的速率和限度有着重要的现实意义。
,是工业制硫酸的主要反应之一,研究该反应的速率和限度有着重要的现实意义。
(1)反应过程的能量变化如图所示:

该反应为________ (填“放热”或“吸热”)反应。
(2)一定条件下,在 的密闭容器中加入
的密闭容器中加入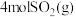 、
、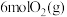 和
和 ,在
,在 末达到平衡,测得
末达到平衡,测得 。
。
① 时间段的化学反应速率为
时间段的化学反应速率为
_________ 。
② 末
末
__________  。
。
③若改变下列一个条件,写出该反应速率的变化(填“增大”、“不变”或“减小”)。
a.升高温度________
b.再充入
________
c.再充入 氩气,使容器压强增大
氩气,使容器压强增大_________
d.将容器的容积扩大至
_______
④下列情况能说明该反应达到化学平衡状态的是___________ ,
a.
b.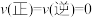
c.混合气体的压强不再变化
d. 、
、 和
和 不再变化
不再变化
e.单位时间内生成 的同时生成
的同时生成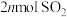
 ,是工业制硫酸的主要反应之一,研究该反应的速率和限度有着重要的现实意义。
,是工业制硫酸的主要反应之一,研究该反应的速率和限度有着重要的现实意义。(1)反应过程的能量变化如图所示:

该反应为
(2)一定条件下,在
 的密闭容器中加入
的密闭容器中加入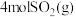 、
、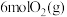 和
和 ,在
,在 末达到平衡,测得
末达到平衡,测得 。
。①
 时间段的化学反应速率为
时间段的化学反应速率为
②
 末
末
 。
。③若改变下列一个条件,写出该反应速率的变化(填“增大”、“不变”或“减小”)。
a.升高温度
b.再充入

c.再充入
 氩气,使容器压强增大
氩气,使容器压强增大d.将容器的容积扩大至

④下列情况能说明该反应达到化学平衡状态的是
a.

b.
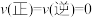
c.混合气体的压强不再变化
d.
 、
、 和
和 不再变化
不再变化e.单位时间内生成
 的同时生成
的同时生成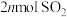
您最近一年使用:0次
2020-08-11更新
|
117次组卷
|
2卷引用:山东省聊城市2019-2020学年高一下学期期末考试化学试题
名校
10 . 下列有关化学反应与能量变化的叙述正确的是
A. 晶体与 晶体与 晶体的反应,为放热反应 晶体的反应,为放热反应 |
| B.石墨转化为金刚石需要吸收热量,据此可判断金刚石比石墨稳定 |
| C.放热反应不需要条件即可发生,而吸热反应必须加热才能实现 |
| D.化学反应中的能量变化主要是由化学键变化引起的 |
您最近一年使用:0次
2020-08-11更新
|
243次组卷
|
3卷引用:山东省聊城市2019-2020学年高一下学期期末考试化学试题



