名校
解题方法
1 . 富钴结壳浸出液分离 制备
制备 的工业流程如下。
的工业流程如下。
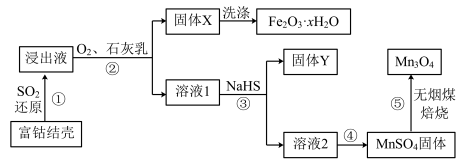
已知:i.浸出液中主要含有的金属离子为: 、
、 、
、 、
、 、
、
ii.25℃时,金属硫化物的溶度积常数。
(1)过程①中, 还原得到的浸出液中含硫元素的阴离子主要为
还原得到的浸出液中含硫元素的阴离子主要为_______ 。
(2)过程②中, 转化为
转化为 时,氧气和石灰乳的作用分别是
时,氧气和石灰乳的作用分别是_______ 。
(3)固体Y中主要物质的化学式为_______ 。
(4)已知, 在
在 时完全沉淀转化为
时完全沉淀转化为 。过程③中沉淀剂不选择
。过程③中沉淀剂不选择 的原因可能是
的原因可能是_______ 。
(5)已知,温度高于20℃时, 在水中的溶解度随温度升高迅速降低。过程④中,采用的操作是
在水中的溶解度随温度升高迅速降低。过程④中,采用的操作是_______ 。
(6)过程⑤中发生下列反应。



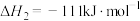
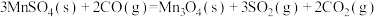

利用 和
和 计算
计算 时,还需要利用
时,还需要利用_______ 反应的 。
。
(7)流程中可循环使用的物质是_______ 。
 制备
制备 的工业流程如下。
的工业流程如下。
已知:i.浸出液中主要含有的金属离子为:
 、
、 、
、 、
、 、
、
ii.25℃时,金属硫化物的溶度积常数。
| 金属硫化物 | NiS | CoS | CuS | MnS |
 |  | 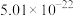 | 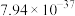 | 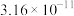 |
 还原得到的浸出液中含硫元素的阴离子主要为
还原得到的浸出液中含硫元素的阴离子主要为(2)过程②中,
 转化为
转化为 时,氧气和石灰乳的作用分别是
时,氧气和石灰乳的作用分别是(3)固体Y中主要物质的化学式为
(4)已知,
 在
在 时完全沉淀转化为
时完全沉淀转化为 。过程③中沉淀剂不选择
。过程③中沉淀剂不选择 的原因可能是
的原因可能是(5)已知,温度高于20℃时,
 在水中的溶解度随温度升高迅速降低。过程④中,采用的操作是
在水中的溶解度随温度升高迅速降低。过程④中,采用的操作是(6)过程⑤中发生下列反应。



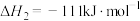
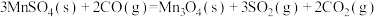

利用
 和
和 计算
计算 时,还需要利用
时,还需要利用 。
。(7)流程中可循环使用的物质是
您最近一年使用:0次
2023-01-05更新
|
318次组卷
|
2卷引用:北京市丰台区2022-2023学年高三上学期期末考试化学试题
2 . 热解耦合化学链制氢工艺是一种将生物质废物转变为高纯 的环境友好型技术路线,如图。
的环境友好型技术路线,如图。
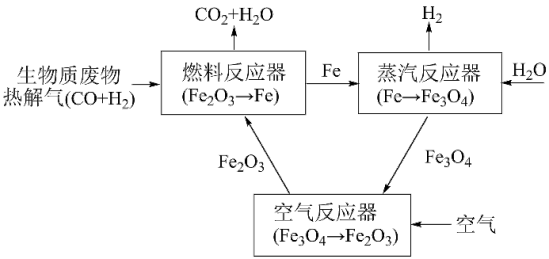
(1)在燃料反应器中,研究人员对纯 作为燃料气与铁基载氧体(
作为燃料气与铁基载氧体( )的还原反应进行了理论研究,得到了还原阶段
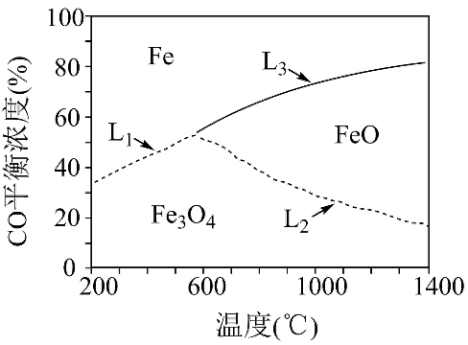
)的还原反应进行了理论研究,得到了还原阶段 平衡浓度和固体成分随温度变化的图象,如图。
平衡浓度和固体成分随温度变化的图象,如图。
已知:a.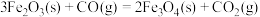
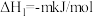
b.

c.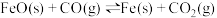
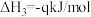
①反应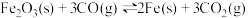 的
的
_______  (用m、n、q表示)。
(用m、n、q表示)。
②当温度低于 时,燃料还原阶段得到的固体主要是
时,燃料还原阶段得到的固体主要是 和
和_______ 。
③曲线 代表的反应为
代表的反应为_______ (填“b”或“c”),曲线 随温度升高而降低的原因是
随温度升高而降低的原因是_______ 。
④纯 作燃料气反应时发生歧化反应[
作燃料气反应时发生歧化反应[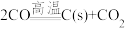 ]使铁基载氧体的固定床内大量积碳。对
]使铁基载氧体的固定床内大量积碳。对 歧化反应进行独立研究:
歧化反应进行独立研究: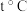 时,向一固定容器中通入一定量
时,向一固定容器中通入一定量 ,测得平衡后
,测得平衡后 的浓度为
的浓度为 ,已知该温度下反应的平衡常数
,已知该温度下反应的平衡常数 ,
, 的平衡转化率是
的平衡转化率是_______ (写出计算过程,保留一位小数)。
(2) 深度还原
深度还原 的过程为:
的过程为: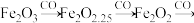
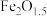
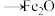 。该过程中,在不同铁基载氧体(
。该过程中,在不同铁基载氧体( )表面的能垒变化如图所示:
)表面的能垒变化如图所示: 在各表面稳定吸附为初始状态(
在各表面稳定吸附为初始状态( ),
), 从各表面脱附进入气相为最终状态(
从各表面脱附进入气相为最终状态( )。
)。

① 在
在_______ 表面反应释放 的速率最快;释放等量
的速率最快;释放等量 时,在
时,在_______ 表面反应放出能量最多(填“Ⅰ”、“Ⅱ”、“ⅢI”或“Ⅳ”)。
② 在Ⅰ表面上的反应路径分三步:
在Ⅰ表面上的反应路径分三步:
i.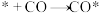 ;(*为活性点位)
;(*为活性点位)
ⅱ. ;
;
ⅲ._______ 。
(3)在蒸汽反应器中,研究表明:压强对出口气体百分含量的影响不大,其原因是_______ 。
 的环境友好型技术路线,如图。
的环境友好型技术路线,如图。
(1)在燃料反应器中,研究人员对纯
 作为燃料气与铁基载氧体(
作为燃料气与铁基载氧体( )的还原反应进行了理论研究,得到了还原阶段
)的还原反应进行了理论研究,得到了还原阶段 平衡浓度和固体成分随温度变化的图象,如图。
平衡浓度和固体成分随温度变化的图象,如图。
已知:a.
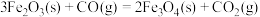
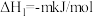
b.


c.
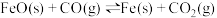
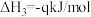
①反应
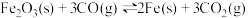 的
的
 (用m、n、q表示)。
(用m、n、q表示)。②当温度低于
 时,燃料还原阶段得到的固体主要是
时,燃料还原阶段得到的固体主要是 和
和③曲线
 代表的反应为
代表的反应为 随温度升高而降低的原因是
随温度升高而降低的原因是④纯
 作燃料气反应时发生歧化反应[
作燃料气反应时发生歧化反应[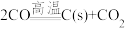 ]使铁基载氧体的固定床内大量积碳。对
]使铁基载氧体的固定床内大量积碳。对 歧化反应进行独立研究:
歧化反应进行独立研究: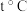 时,向一固定容器中通入一定量
时,向一固定容器中通入一定量 ,测得平衡后
,测得平衡后 的浓度为
的浓度为 ,已知该温度下反应的平衡常数
,已知该温度下反应的平衡常数 ,
, 的平衡转化率是
的平衡转化率是(2)
 深度还原
深度还原 的过程为:
的过程为: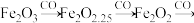
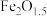
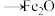 。该过程中,在不同铁基载氧体(
。该过程中,在不同铁基载氧体( )表面的能垒变化如图所示:
)表面的能垒变化如图所示: 在各表面稳定吸附为初始状态(
在各表面稳定吸附为初始状态( ),
), 从各表面脱附进入气相为最终状态(
从各表面脱附进入气相为最终状态( )。
)。
①
 在
在 的速率最快;释放等量
的速率最快;释放等量 时,在
时,在②
 在Ⅰ表面上的反应路径分三步:
在Ⅰ表面上的反应路径分三步:i.
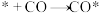 ;(*为活性点位)
;(*为活性点位)ⅱ.
 ;
;ⅲ.
(3)在蒸汽反应器中,研究表明:压强对出口气体百分含量的影响不大,其原因是
您最近一年使用:0次
3 . 工业上利用铁的氧化物在高温条件下循环裂解水制氢气的流程如图所示。

(1)反应I的化学方程式为:Fe3O4(s)+CO(g) 3FeO(s)+CO2(g),反应Ⅱ的化学方程式为
3FeO(s)+CO2(g),反应Ⅱ的化学方程式为_______ ,对比反应I、Ⅱ,铁的氧化物在循环裂解水制氢气过程中的作用是_______ 。
(2)反应III为:CO2(g)+C(s)⇌2CO(g) ∆H>0。为了提高达平衡后CO的产量,理论上可以采取的合理措施有_______ (任写一条措施)。
(3)流程图中碳的氧化物可用来制备碳酰肼[CO(NHNH2)2,其中碳元素为+4价]。加热条件下,碳酰肼能将锅炉内表面锈蚀后的氧化铁转化为结构紧密的四氧化三铁保护层,并生成氮气、水和二氧化碳。该反应的化学方程式为_______ 。
(4)①高铁酸盐是常用的水处理剂。高铁酸钠(Na2FeO4)可用如下反应制备:
2FeSO4+6Na2O2=2Na2FeO4+2Na2O+2Na2SO4+O2↑
若生成2mol Na2FeO4,则反应中电子转移的物质的量为_______ mol。
②高铁酸盐可将水体中的Mn2+氧化为MnO2进行除去,若氧化含Mn2+ 1mg的水体样本,需要1.2mg·L-1高铁酸钾_______ L。

(1)反应I的化学方程式为:Fe3O4(s)+CO(g)
 3FeO(s)+CO2(g),反应Ⅱ的化学方程式为
3FeO(s)+CO2(g),反应Ⅱ的化学方程式为(2)反应III为:CO2(g)+C(s)⇌2CO(g) ∆H>0。为了提高达平衡后CO的产量,理论上可以采取的合理措施有
(3)流程图中碳的氧化物可用来制备碳酰肼[CO(NHNH2)2,其中碳元素为+4价]。加热条件下,碳酰肼能将锅炉内表面锈蚀后的氧化铁转化为结构紧密的四氧化三铁保护层,并生成氮气、水和二氧化碳。该反应的化学方程式为
(4)①高铁酸盐是常用的水处理剂。高铁酸钠(Na2FeO4)可用如下反应制备:
2FeSO4+6Na2O2=2Na2FeO4+2Na2O+2Na2SO4+O2↑
若生成2mol Na2FeO4,则反应中电子转移的物质的量为
②高铁酸盐可将水体中的Mn2+氧化为MnO2进行除去,若氧化含Mn2+ 1mg的水体样本,需要1.2mg·L-1高铁酸钾
您最近一年使用:0次
名校
解题方法
4 . 高炉煤气是炼铁厂排放的尾气,含有H2、N2、CO、CO2及O2,其中N2约为55%、CO约为25%、CO2约为15%、O2约为1.64% (均为体积分数)。某科研小组对尾气的应用展开研究:
Ⅰ.直接作燃料
已知:C(s)+O2(g)=CO2(g) △H=-393.5kJ/mol, 2C(s)+O2(g)=2CO(g) △H=-221kJ/mol
(1)CO燃烧热的热化学方程式为__________________________________ 。
Ⅱ.生产合成氨的原料
高炉煤气经过下列步骤可转化为合成氨的原料气:
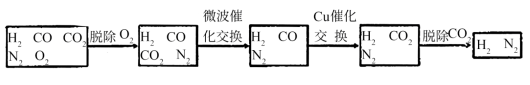
在脱氧过程中仅吸收了O2;交换过程中发生的反应如下,这两个反应均为吸热反应:
CO2+CH4 CO+H2CO+H2O
CO+H2CO+H2O CO2+H2
CO2+H2
(2) 气体通过微波催化交换炉需要较高温度,试根据该反应特征,解释采用较高温度的原
因:________________________ 。
(3)通过铜催化交换炉后,所得气体中V(H2):V(N2)=______________________ 。
Ⅲ.合成氨后的气体应用研究
(4)氨气可用于生产硝酸,该过程中会产生大气污染物NOx。为了研究对NOx的治理,该研究小组在恒温条件下,向2L恒容密闭容器这加入0.2molNO和0.1molCl2,发生如下反应:2NO(g)+Cl2(g) 2ClNO(g) △H<0。10min 时反应达平衡,测得10min内v (ClNO)=7.5×10-3mol/(L·min),则平衡后n(Cl2)=
2ClNO(g) △H<0。10min 时反应达平衡,测得10min内v (ClNO)=7.5×10-3mol/(L·min),则平衡后n(Cl2)=___________ mol。
设此时NO的转化率为ɑ1,若其它条件不变,上述反应在恒压条件下进行,平衡时NO的转化率为ɑ2,则ɑ1_________ ɑ2(填“>”、“<”或“=”);平衡常数K_______ (填“增大”“减小”或“不变”)
(5)氨气还可用于制备NCl3,NCl3发生水解产物之一具有强氧化性,该水解产物能将稀盐酸中的NaClO2氧化成ClO2,该反应的离子方程式为__________________________ 。
Ⅳ.一种用高岭土矿(主要成分为SiO2、Al2O3,含少量Fe2O3)为原料制备铝铵矾[NH4Al(SO4)2·12H2O]的工艺流程如图所示。回答下列问题:
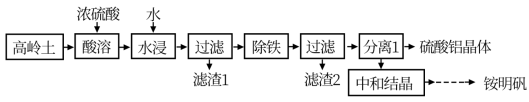
(6)当“酸溶”时间超过40min时,溶液中的Al2(SO4)3会与SiO2反应生成Al2O3·nSiO2,导致铝的溶出率降低,该反应的化学方程式为________________________ 。
(7)检验“除铁”过程中铁是否除尽的方法是_________________________ 。
(8)“中和”时,需控制条件为20℃和pH=2.8,其原因是__________________________ 。
Ⅰ.直接作燃料
已知:C(s)+O2(g)=CO2(g) △H=-393.5kJ/mol, 2C(s)+O2(g)=2CO(g) △H=-221kJ/mol
(1)CO燃烧热的热化学方程式为
Ⅱ.生产合成氨的原料
高炉煤气经过下列步骤可转化为合成氨的原料气:

在脱氧过程中仅吸收了O2;交换过程中发生的反应如下,这两个反应均为吸热反应:
CO2+CH4
 CO+H2CO+H2O
CO+H2CO+H2O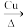 CO2+H2
CO2+H2(2) 气体通过微波催化交换炉需要较高温度,试根据该反应特征,解释采用较高温度的原
因:
(3)通过铜催化交换炉后,所得气体中V(H2):V(N2)=
Ⅲ.合成氨后的气体应用研究
(4)氨气可用于生产硝酸,该过程中会产生大气污染物NOx。为了研究对NOx的治理,该研究小组在恒温条件下,向2L恒容密闭容器这加入0.2molNO和0.1molCl2,发生如下反应:2NO(g)+Cl2(g)
 2ClNO(g) △H<0。10min 时反应达平衡,测得10min内v (ClNO)=7.5×10-3mol/(L·min),则平衡后n(Cl2)=
2ClNO(g) △H<0。10min 时反应达平衡,测得10min内v (ClNO)=7.5×10-3mol/(L·min),则平衡后n(Cl2)=设此时NO的转化率为ɑ1,若其它条件不变,上述反应在恒压条件下进行,平衡时NO的转化率为ɑ2,则ɑ1
(5)氨气还可用于制备NCl3,NCl3发生水解产物之一具有强氧化性,该水解产物能将稀盐酸中的NaClO2氧化成ClO2,该反应的离子方程式为
Ⅳ.一种用高岭土矿(主要成分为SiO2、Al2O3,含少量Fe2O3)为原料制备铝铵矾[NH4Al(SO4)2·12H2O]的工艺流程如图所示。回答下列问题:

(6)当“酸溶”时间超过40min时,溶液中的Al2(SO4)3会与SiO2反应生成Al2O3·nSiO2,导致铝的溶出率降低,该反应的化学方程式为
(7)检验“除铁”过程中铁是否除尽的方法是
(8)“中和”时,需控制条件为20℃和pH=2.8,其原因是
您最近一年使用:0次
名校
解题方法
5 . 钛(Ti)被称为继铁、铝之后的第三金属,江西省攀枝花和西昌地区的钡钛磁铁矿储量十分丰富。如下图所示,将钛厂、氯碱厂和甲醇(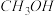 )厂组成产业链可以大大提高资源利用率,减少环境污染。请填写下列空白:
)厂组成产业链可以大大提高资源利用率,减少环境污染。请填写下列空白:

(1)电解食盐水时,总反应的离子方程式______________ 。
(2)以甲醇、空气、氢氧化钾溶液为原料,石墨为电极可构成燃料电池。该电池中负极上的电极反应式是________________________ 。
(3)已知:①
 H=
H=
②
 H=
H=
则
 H=
H=_____________ 。
(4)写出钛铁矿高温下经氯化法得到四氧化钛的化学方程式:________________ 。
(5)某自来水中含有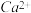 、
、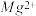 、
、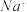 、
、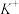 、
、 、
、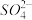 、
、 ,长期烧煮上述自来水会在锅炉内形成水垢,锅炉水垢不仅耗费燃料,而且有烧坏锅炉的危险,因此要定期清除锅炉水垢。已知部分物质20℃时的溶解度数据有:
,长期烧煮上述自来水会在锅炉内形成水垢,锅炉水垢不仅耗费燃料,而且有烧坏锅炉的危险,因此要定期清除锅炉水垢。已知部分物质20℃时的溶解度数据有:
①请用化学方程式表示锅炉中的水垢含有 而不含有
而不含有 的原因:
的原因:_______ 。
②锅炉中的水垢所含有的 不能直接用酸除去,需要加入试剂X,使其转化为易溶于盐酸的物质Y而除去,
不能直接用酸除去,需要加入试剂X,使其转化为易溶于盐酸的物质Y而除去, 能转化为物质Y的离子方程式
能转化为物质Y的离子方程式_________ 。
③水中的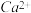 、
、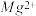 可以用一定浓度的M溶液进行测定,M与
可以用一定浓度的M溶液进行测定,M与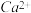 、
、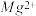 都以等物质的量进行反应,现取含
都以等物质的量进行反应,现取含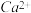 浓度为0.40g/L的自来水样10mL,至锥形瓶中进行滴定,达到终点时,用去了浓度为0.01 mol/L的M溶液20.00mL,则该自来水样中
浓度为0.40g/L的自来水样10mL,至锥形瓶中进行滴定,达到终点时,用去了浓度为0.01 mol/L的M溶液20.00mL,则该自来水样中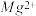 的物质的量浓度是
的物质的量浓度是________ 。
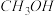 )厂组成产业链可以大大提高资源利用率,减少环境污染。请填写下列空白:
)厂组成产业链可以大大提高资源利用率,减少环境污染。请填写下列空白:
(1)电解食盐水时,总反应的离子方程式
(2)以甲醇、空气、氢氧化钾溶液为原料,石墨为电极可构成燃料电池。该电池中负极上的电极反应式是
(3)已知:①

 H=
H=
②

 H=
H=
则

 H=
H=(4)写出钛铁矿高温下经氯化法得到四氧化钛的化学方程式:
(5)某自来水中含有
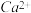 、
、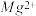 、
、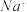 、
、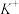 、
、 、
、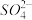 、
、 ,长期烧煮上述自来水会在锅炉内形成水垢,锅炉水垢不仅耗费燃料,而且有烧坏锅炉的危险,因此要定期清除锅炉水垢。已知部分物质20℃时的溶解度数据有:
,长期烧煮上述自来水会在锅炉内形成水垢,锅炉水垢不仅耗费燃料,而且有烧坏锅炉的危险,因此要定期清除锅炉水垢。已知部分物质20℃时的溶解度数据有:| 物质 |  | 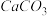 |  |  |  |  |
溶解度( ) ) |  |  |  |  | 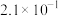 | 26.7 |
 而不含有
而不含有 的原因:
的原因:②锅炉中的水垢所含有的
 不能直接用酸除去,需要加入试剂X,使其转化为易溶于盐酸的物质Y而除去,
不能直接用酸除去,需要加入试剂X,使其转化为易溶于盐酸的物质Y而除去, 能转化为物质Y的离子方程式
能转化为物质Y的离子方程式③水中的
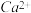 、
、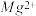 可以用一定浓度的M溶液进行测定,M与
可以用一定浓度的M溶液进行测定,M与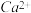 、
、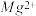 都以等物质的量进行反应,现取含
都以等物质的量进行反应,现取含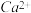 浓度为0.40g/L的自来水样10mL,至锥形瓶中进行滴定,达到终点时,用去了浓度为0.01 mol/L的M溶液20.00mL,则该自来水样中
浓度为0.40g/L的自来水样10mL,至锥形瓶中进行滴定,达到终点时,用去了浓度为0.01 mol/L的M溶液20.00mL,则该自来水样中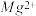 的物质的量浓度是
的物质的量浓度是
您最近一年使用:0次



