名校
解题方法
1 . 在二氧化碳加氢制甲烷的反应体系中,主要发生反应的热化学方程式为:
反应Ⅰ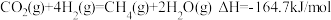
反应Ⅱ
反应Ⅲ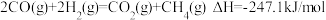
向恒压、密闭容器中通入 和
和 ,平衡时
,平衡时 、
、 、
、 的物质的量随温度的变化如图所示,下列叙述错误的是
的物质的量随温度的变化如图所示,下列叙述错误的是

反应Ⅰ
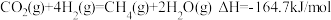
反应Ⅱ

反应Ⅲ
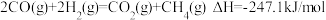
向恒压、密闭容器中通入
 和
和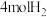 ,平衡时
,平衡时 、
、 、
、 的物质的量随温度的变化如图所示,下列叙述错误的是
的物质的量随温度的变化如图所示,下列叙述错误的是
A.反应Ⅲ在a点的平衡常数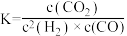 |
B.图中曲线B表示平衡时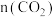 随温度的变化关系 随温度的变化关系 |
C. 的 的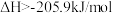 |
D.在低温条件下,可同时提高 平衡转化率和 平衡转化率和 的平衡产率 的平衡产率 |
您最近一年使用:0次
2021-04-23更新
|
1233次组卷
|
5卷引用:江苏省南京市第一中学2021-2022学年高二下学期期中考试化学试题
江苏省南京市第一中学2021-2022学年高二下学期期中考试化学试题江西省宜春市奉新县第一中学2021-2022学年高二下学期第一次月考化学试题第二章 综合拔高练山东省聊城市2021届高三下学期第二次模拟考试化学试题(已下线)专题06 物质结构 元素周期律-备战2022年高考化学真题及地市好题专项集训【山东专用】
名校
解题方法
2 . “绿水青山就是金山银山”,近年来,绿色发展、生态保护成为中国展示给世界的一张新“名片”。
Ⅰ.汽车尾气是造成大气污染的重要原因之一,减少氮的氧化物在大气中的排放是环境保护的重要内容之一、请回答下列问题:
(1)已知: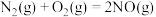
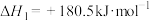

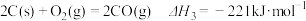
若某反应的平衡常数表达式为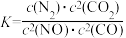 ,则此反应的热化学方程式为
,则此反应的热化学方程式为_______ 。
(2)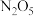 在一定条件下可发生分解:
在一定条件下可发生分解: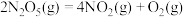 ,一定温度下,在恒容密闭容器中充入一定量
,一定温度下,在恒容密闭容器中充入一定量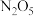 进行该反应,能判断反应已达到化学平衡状态的是
进行该反应,能判断反应已达到化学平衡状态的是_______ (填字母)。
a.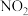 和
和 的浓度比保持不变 b.容器中压强不再变化
的浓度比保持不变 b.容器中压强不再变化
c.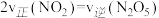 d.气体的密度保持不变
d.气体的密度保持不变
Ⅱ.甲醇、乙醇来源丰富、价格低廉、运输贮存方便,都是重要的化工原料,有着重要的用途和应用前景,可以用多种方法合成。
(3)已知 CO2(g) + 3H2(g)⇌ CH3OH(g) + H2O(g),将 和
和 按物质的量之比1∶3充入体积为2.0 L的恒容密闭容器中反应生成
按物质的量之比1∶3充入体积为2.0 L的恒容密闭容器中反应生成 ,如图1表示压强为0.1 MPa和5.0 MPa下
,如图1表示压强为0.1 MPa和5.0 MPa下 转化率随温度的变化关系。
转化率随温度的变化关系。
①a、b两点化学反应速率分别用Va、Vb,表示,则Va_______ Vb (填“大于”、“小于”或“等于”)。
②列出a点对应的平衡常数表达式K=_______ 。
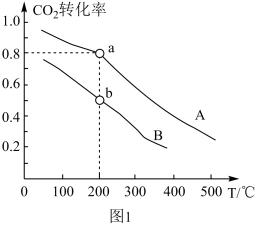
(4)在1.0 L恒容密闭容器中投入1 mol CO2和2.75 mol H2发生反应:CO2(g) + 3H2(g)⇌CH3OH(g) + H2O(g),实验测得不同温度及压强下,平衡时甲醇的物质的量变化如图2所示,下列说法正确的是_______ 。
A.该反应的正反应为放热反应
B.压强大小关系为P1<P2<P3
C.M点对应的平衡常数K的值约为
D.在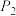 及512 K时,图中N点
及512 K时,图中N点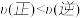
(5) 催化加氢合成乙醇的反应为:2CO2(g) + 6H2(g)⇌C2H5OH(g) + 3H2O(g)
催化加氢合成乙醇的反应为:2CO2(g) + 6H2(g)⇌C2H5OH(g) + 3H2O(g)  ;m代表起始时的投料比,即
;m代表起始时的投料比,即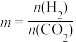 。
。
①图3中投料比相同,温度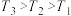 ,则该反应的焓变
,则该反应的焓变
_______ 0(填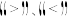 )。
)。

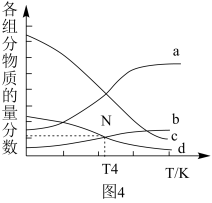
②m=3时,恒压条件下各物质的物质的量分数与温度的关系如图4所示,则曲线b代表的物质为_______ (填化学式)。
Ⅰ.汽车尾气是造成大气污染的重要原因之一,减少氮的氧化物在大气中的排放是环境保护的重要内容之一、请回答下列问题:
(1)已知:

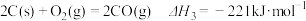
若某反应的平衡常数表达式为
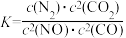 ,则此反应的热化学方程式为
,则此反应的热化学方程式为(2)
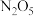 在一定条件下可发生分解:
在一定条件下可发生分解: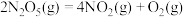 ,一定温度下,在恒容密闭容器中充入一定量
,一定温度下,在恒容密闭容器中充入一定量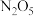 进行该反应,能判断反应已达到化学平衡状态的是
进行该反应,能判断反应已达到化学平衡状态的是a.
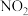 和
和 的浓度比保持不变 b.容器中压强不再变化
的浓度比保持不变 b.容器中压强不再变化c.
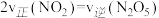 d.气体的密度保持不变
d.气体的密度保持不变Ⅱ.甲醇、乙醇来源丰富、价格低廉、运输贮存方便,都是重要的化工原料,有着重要的用途和应用前景,可以用多种方法合成。
(3)已知 CO2(g) + 3H2(g)⇌ CH3OH(g) + H2O(g),将
 和
和 按物质的量之比1∶3充入体积为2.0 L的恒容密闭容器中反应生成
按物质的量之比1∶3充入体积为2.0 L的恒容密闭容器中反应生成 ,如图1表示压强为0.1 MPa和5.0 MPa下
,如图1表示压强为0.1 MPa和5.0 MPa下 转化率随温度的变化关系。
转化率随温度的变化关系。
①a、b两点化学反应速率分别用Va、Vb,表示,则Va
②列出a点对应的平衡常数表达式K=
(4)在1.0 L恒容密闭容器中投入1 mol CO2和2.75 mol H2发生反应:CO2(g) + 3H2(g)⇌CH3OH(g) + H2O(g),实验测得不同温度及压强下,平衡时甲醇的物质的量变化如图2所示,下列说法正确的是

A.该反应的正反应为放热反应
B.压强大小关系为P1<P2<P3
C.M点对应的平衡常数K的值约为

D.在
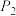 及512 K时,图中N点
及512 K时,图中N点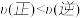
(5)
 催化加氢合成乙醇的反应为:2CO2(g) + 6H2(g)⇌C2H5OH(g) + 3H2O(g)
催化加氢合成乙醇的反应为:2CO2(g) + 6H2(g)⇌C2H5OH(g) + 3H2O(g)  ;m代表起始时的投料比,即
;m代表起始时的投料比,即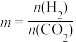 。
。①图3中投料比相同,温度
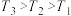 ,则该反应的焓变
,则该反应的焓变
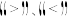 )。
)。
②m=3时,恒压条件下各物质的物质的量分数与温度的关系如图4所示,则曲线b代表的物质为

您最近一年使用:0次
2021-02-02更新
|
674次组卷
|
3卷引用:专题十二化学反应速率与平衡
名校
解题方法
3 . 以太阳能为热源,热化学硫碘循环分解水是一种高效、环保的制氢方法,其流程如图所示。
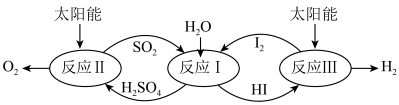
相关反应的热化学方程式为:
反应Ⅰ:SO2(g)+I2(g)+2H2O(l)=2HI(aq)+H2SO4(aq) H1=-213kJ•mol-1
反应Ⅱ:H2SO4(aq)=SO2(g)+H2O(l)+ O2(g) H2=+327kJ•mol-1
O2(g) H2=+327kJ•mol-1
反应Ⅲ:2HI(aq)=H2(g)+I2(g) H3=+172kJ•mol-1
下列说法不正确的是

相关反应的热化学方程式为:
反应Ⅰ:SO2(g)+I2(g)+2H2O(l)=2HI(aq)+H2SO4(aq) H1=-213kJ•mol-1
反应Ⅱ:H2SO4(aq)=SO2(g)+H2O(l)+
 O2(g) H2=+327kJ•mol-1
O2(g) H2=+327kJ•mol-1反应Ⅲ:2HI(aq)=H2(g)+I2(g) H3=+172kJ•mol-1
下列说法不正确的是
| A.该过程实现了太阳能到化学能的转化 |
| B.SO2和I2对总反应起到了催化作用 |
| C.总反应的热化学方程式为2H2O(l)=2H2(g)+O2(g) H=+286kJ•mol-1 |
| D.该过程降低了水分解制氢的活化能,但总反应的H不变 |
您最近一年使用:0次
2020-10-12更新
|
2808次组卷
|
28卷引用:山东省聊城市第二中学2022-2023学年高二上学期第一次月考化学试题
山东省聊城市第二中学2022-2023学年高二上学期第一次月考化学试题北京市北京师范大学燕化附中2022-2023学年高二上学期10月月考化学试题山东省临沂市平邑县第一中学2022-2023学年高二上学期10月月考化学试题 湖北省仙桃中学2022-2023学年高一上学期10月月考化学试题【区级联考】北京市海淀区2019届高三第一学期上学期期末考试化学试题【全国百强校】浙江省学军中学2019届高三下学期4月选考模拟冲刺化学试题【全国百强校】内蒙古自治区赤峰二中2018-2019学年高一下学期第二次月考化学试题(已下线)考点24 元素与理论综合——《备战2020年高考精选考点专项突破题集》2019年秋高三化学复习强化练习—— 盖斯定律及其应用河南省实验中学2020届高三12月月考化学试题北京市2020届高三12月月考(新高考选考模式)化学试题北京市2020届高三质量监测化学试题(已下线)考点06 化学能与热能-2020年高考化学命题预测与模拟试题分类精编山东省济南市历城第二中学2021届高三10月份学情检测化学试题人教版(2019)高二化学选择性必修1第一章 化学反应的热效应 过模拟 2年模拟精编精练湖北省部分省重点中学2020-2021学年高二上学期期中联考化学试题湖北省部分重点中学2020-2021学年高二上学期期中考试化学试题(已下线)押山东卷第07题 化学反应与能量-备战2021年高考化学临考题号押题(山东卷)安徽省怀宁中学2020-2021学年高一下学期第一次月考化学试题(已下线)高中化学《新教材变化解读与考法剖析》第一章 化学反应的热效应(人教版2019选择性必修1)山东省聊城第三中学2021-2022学年高二上学期第三次质量检测化学试题北京市第三十一中学2021-2022学年高二上学期期中考试化学试题湖南省衡阳市第八中学2022-2023学年高二下学期5月月考化学试题(已下线)2023年北京卷高考真题变式题(选择题11-14)湖南省南雅中学2023-2024学年高二上学期第一次月考化学试题江西省宜春市上高二中2023-2024学年高二上学期第一次月考化学试题河北省唐山市丰润区2023-2024学年高二上学期期中考试化学试题福建省厦门市集美中学2023-2024学年高二上学期10月第一次月考化学试题
2019高三·全国·专题练习
名校
4 . 环戊二烯(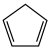 )是重要的有机化工原料,广泛用于农药、橡胶、塑料等生产。回答下列问题:
)是重要的有机化工原料,广泛用于农药、橡胶、塑料等生产。回答下列问题:
(1)已知: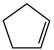 (g) =
(g) =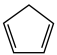 (g)+H2(g) ΔH1=100.3 kJ·mol −1①H2(g)+ I2(g) =2HI(g) ΔH2=−11.0 kJ·mol −1②,对于反应:
(g)+H2(g) ΔH1=100.3 kJ·mol −1①H2(g)+ I2(g) =2HI(g) ΔH2=−11.0 kJ·mol −1②,对于反应: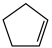 (g)+ I2(g) =
(g)+ I2(g) = (g)+2HI(g) ③ ΔH3=
(g)+2HI(g) ③ ΔH3=___________ kJ·mol −1。
(2)某温度下,等物质的量的碘和环戊烯(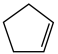 )在刚性容器内发生反应③,起始总压为105Pa,平衡时总压增加了20%,环戊烯的转化率为
)在刚性容器内发生反应③,起始总压为105Pa,平衡时总压增加了20%,环戊烯的转化率为_________ ,该反应的平衡常数Kp=_________ Pa。达到平衡后,欲增加环戊烯的平衡转化率,可采取的措施有__________ (填标号)。
A.通入惰性气体 B.提高温度 C.增加环戊烯浓度 D.增加碘浓度
(3)环戊二烯容易发生聚合生成二聚体,该反应为可逆反应。不同温度下,溶液中环戊二烯浓度与反应时间的关系如图所示,下列说法正确的是__________ (填标号)。
A.T1>T2
B.a点的反应速率小于c点的反应速率
C.a点的正反应速率大于b点的逆反应速率
D.b点时二聚体的浓度为0.45 mol·L−1
 )是重要的有机化工原料,广泛用于农药、橡胶、塑料等生产。回答下列问题:
)是重要的有机化工原料,广泛用于农药、橡胶、塑料等生产。回答下列问题:(1)已知:
 (g) =
(g) = (g)+H2(g) ΔH1=100.3 kJ·mol −1①H2(g)+ I2(g) =2HI(g) ΔH2=−11.0 kJ·mol −1②,对于反应:
(g)+H2(g) ΔH1=100.3 kJ·mol −1①H2(g)+ I2(g) =2HI(g) ΔH2=−11.0 kJ·mol −1②,对于反应: (g)+ I2(g) =
(g)+ I2(g) = (g)+2HI(g) ③ ΔH3=
(g)+2HI(g) ③ ΔH3=(2)某温度下,等物质的量的碘和环戊烯(
 )在刚性容器内发生反应③,起始总压为105Pa,平衡时总压增加了20%,环戊烯的转化率为
)在刚性容器内发生反应③,起始总压为105Pa,平衡时总压增加了20%,环戊烯的转化率为A.通入惰性气体 B.提高温度 C.增加环戊烯浓度 D.增加碘浓度
(3)环戊二烯容易发生聚合生成二聚体,该反应为可逆反应。不同温度下,溶液中环戊二烯浓度与反应时间的关系如图所示,下列说法正确的是

A.T1>T2
B.a点的反应速率小于c点的反应速率
C.a点的正反应速率大于b点的逆反应速率
D.b点时二聚体的浓度为0.45 mol·L−1
您最近一年使用:0次
2019-06-26更新
|
2665次组卷
|
20卷引用:内蒙古赤峰市2021-2022学年高二下学期期末考试化学试题
内蒙古赤峰市2021-2022学年高二下学期期末考试化学试题(已下线)第19讲 化学平衡(讲)-2023年高考化学一轮复习讲练测(新教材新高考)福建省泉州市南安市侨光中学2022-2023学年高二上学期10月月考化学试题(已下线)专题09 反应速率、化学平衡——2019年高考真题和模拟题化学分项汇编(已下线)专题7.2 化学平衡状态 化学平衡移动(练)-《2020年高考一轮复习讲练测》(已下线)专题7.2 化学平衡状态 化学平衡移动(讲)-《2020年高考一轮复习讲练测》江西省高安中学2019-2020学年高二上学期期末考试化学(B卷)试题鲁科版(2019)选择性必修1第2章 化学反应的方向、限度与速率 第2章 综合检测高中必刷题高二选择性必修1第二章 化学反应速率与化学平衡 第二章素养检测(已下线)2.3.3+化学平衡常数-2020-2021学年高二化学同步课堂帮帮帮(人教版选修4)人教版(2019)高二化学选择性必修1第二章 化学反应速率与化学平衡 过高考 3年真题强化闯关(已下线)第23讲 化学平衡状态 化学平衡的移动 (精讲)——2021年高考化学一轮复习讲练测鲁科版(2019)高二选择性必修第一册第2章 化学反应的方向、限度与速率 高考挑战区 过高考四川省遂宁市2020-2021学年高二下学期期末考试化学试题选择性必修1(SJ)专题2专题培优专练(已下线)第19讲 化学平衡(讲) — 2022年高考化学一轮复习讲练测(新教材新高考)山东省临沂市平邑县第一中学实验部2021-2022学年高二上学期第二次月考化学试题江西省崇义中学2020-2021学年高一上学期期中考试(A卷)化学试题河南省洛阳市第一中学2022-2023学年高二上学期期末检测化学试题湖南省邵阳市新邵县2023-2024学年高二上学期期末考试化学试题
2019高三·全国·专题练习
5 . 氢能源是最具应用前景的能源之一,高纯氢的制备是目前的研究热点。
甲烷水蒸气催化重整是制高纯氢的方法之一。
①反应器中初始反应的生成物为H2和CO2,其物质的量之比为4∶1,甲烷和水蒸气反应的方程式是______ 。
②已知反应器中还存在如下反应:
i.CH4(g)+H2O(g)=CO(g)+3H2(g) ΔH1
ii.CO(g)+H2O(g)=CO2(g)+H2(g) ΔH2
iii.CH4(g)=C(s)+2H2(g) ΔH3
……
iii为积炭反应,利用ΔH1和ΔH2计算ΔH3时,还需要利用______ 反应的ΔH。
甲烷水蒸气催化重整是制高纯氢的方法之一。
①反应器中初始反应的生成物为H2和CO2,其物质的量之比为4∶1,甲烷和水蒸气反应的方程式是
②已知反应器中还存在如下反应:
i.CH4(g)+H2O(g)=CO(g)+3H2(g) ΔH1
ii.CO(g)+H2O(g)=CO2(g)+H2(g) ΔH2
iii.CH4(g)=C(s)+2H2(g) ΔH3
……
iii为积炭反应,利用ΔH1和ΔH2计算ΔH3时,还需要利用
您最近一年使用:0次
2019-06-21更新
|
349次组卷
|
7卷引用:考点17 化学反应的热效应-备战2023年高考化学一轮复习考点帮(全国通用)
(已下线)考点17 化学反应的热效应-备战2023年高考化学一轮复习考点帮(全国通用)辽宁省大连市第四十四中学2022-2023学年高三上学期10月考试化学试题(已下线)专题07 化学反应中的能量变化——2019年高考真题和模拟题化学分项汇编(已下线)专题九 化学能与热能(真题汇编)-2020年高考二轮模块化复习之《化学基本原理》名师讲案与提分特训(已下线)1.3.1+盖斯定律-2020-2021学年高二化学同步课堂帮帮帮(人教版选修4)(已下线)考点20 化学能与热能-备战2022年高考化学一轮复习考点帮(全国通用)(已下线)考点20 化学能与热能-备战2022年高考化学一轮复习考点帮(浙江专用)
解题方法
6 . 在火箭推进器中装有强还原剂肼(N2H4)和强氧化剂(H2O2),当它们混合时,即产生大量的N2和水蒸气,并放出大量热。已知0.4mol液态肼和足量H2O2反应,生成氮气和水蒸气,放出256.65kJ的热量。
(1)写出该反应的热化学方程式______ 。
(2)已知H2O(l)=H2O(g) △H=+44kJ·mol﹣1,则16g液态肼燃烧生成氮气和液态水时,放出的热量是______ kJ。
(3)上述反应应用于火箭推进剂,除释放大量的热和快速产生大量气体外,还有一个很突出的优点是______ 。
(4)已知N2(g)+2O2(g)═2NO2(g) △H=+67.7kJ·mol﹣1,N2H4(g)+O2(g)═N2(g)+2H2O (g) △H=﹣534kJ·mol﹣1,根据盖斯定律写出肼与NO2完全反应生成氮气和气态水的热化学方程式______ 。
(5)已知:N2 (g)+2O2 (g)═2NO2 (g)△H=+67.7kJ/mol
N2H4(g)+O2(g)═N2(g)+2H2O (g)△H=﹣543kJ/mol
 H2 (g)+
H2 (g)+ F2 (g)═HF (g)△H=﹣269kJ/mol
F2 (g)═HF (g)△H=﹣269kJ/mol
H2(g)+ O2(g)═H2O (g)△H=﹣242kJ/mol
O2(g)═H2O (g)△H=﹣242kJ/mol
有人认为若用氟代替二氧化氮作氧化剂,则反应释放能量更大,肼和氟反应的热化学方程式:______ 。
(6)丙烷燃烧可以通过以下两种途径:
途径I:C3H8(g)+5O2(g)═3CO2(g)+4H2O(l)△H=﹣a kJ·mol﹣1
途径II:C3H8(g)═C3H6(g)+H2(g)△H=+b kJ·mol﹣1
2C3H6(g)+9O2(g)═6CO2(g)+6H2O(l)△H=﹣c kJ·mol﹣1
2H2(g)+O2 (g)═2H2O(l)△H=﹣d kJ·mol﹣1 (abcd均为正值)
请回答下列问题:
判断等量的丙烷通过两种途径放出的热量,途径I放出的热量______ (填“大于”、“等于”或“小于”)途径II放出的热量。C3H8(g)═C3H6(g)+H2(g) 的反应中,反应物具有的总能量______ (填“大于”、“等于”或“小于”)生成物具有的总能量。b 与a、c、d的数学关系式是______ 。
(1)写出该反应的热化学方程式
(2)已知H2O(l)=H2O(g) △H=+44kJ·mol﹣1,则16g液态肼燃烧生成氮气和液态水时,放出的热量是
(3)上述反应应用于火箭推进剂,除释放大量的热和快速产生大量气体外,还有一个很突出的优点是
(4)已知N2(g)+2O2(g)═2NO2(g) △H=+67.7kJ·mol﹣1,N2H4(g)+O2(g)═N2(g)+2H2O (g) △H=﹣534kJ·mol﹣1,根据盖斯定律写出肼与NO2完全反应生成氮气和气态水的热化学方程式
(5)已知:N2 (g)+2O2 (g)═2NO2 (g)△H=+67.7kJ/mol
N2H4(g)+O2(g)═N2(g)+2H2O (g)△H=﹣543kJ/mol
 H2 (g)+
H2 (g)+ F2 (g)═HF (g)△H=﹣269kJ/mol
F2 (g)═HF (g)△H=﹣269kJ/molH2(g)+
 O2(g)═H2O (g)△H=﹣242kJ/mol
O2(g)═H2O (g)△H=﹣242kJ/mol有人认为若用氟代替二氧化氮作氧化剂,则反应释放能量更大,肼和氟反应的热化学方程式:
(6)丙烷燃烧可以通过以下两种途径:
途径I:C3H8(g)+5O2(g)═3CO2(g)+4H2O(l)△H=﹣a kJ·mol﹣1
途径II:C3H8(g)═C3H6(g)+H2(g)△H=+b kJ·mol﹣1
2C3H6(g)+9O2(g)═6CO2(g)+6H2O(l)△H=﹣c kJ·mol﹣1
2H2(g)+O2 (g)═2H2O(l)△H=﹣d kJ·mol﹣1 (abcd均为正值)
请回答下列问题:
判断等量的丙烷通过两种途径放出的热量,途径I放出的热量
您最近一年使用:0次
2017-10-18更新
|
639次组卷
|
4卷引用:第1章能力提升测评卷-【帮课堂】2022-2023学年高二化学同步精品讲义(沪科版2020选择性必修第一册)
(已下线)第1章能力提升测评卷-【帮课堂】2022-2023学年高二化学同步精品讲义(沪科版2020选择性必修第一册)(已下线)第04讲 第一章《化学反应的热效应》单元测试(培优提升)-【帮课堂】2022-2023学年高二化学同步精品讲义(人教2019选择性必修1)2015-2016学年黑龙江省肇东一中高一下期末化学试卷黑龙江省饶河县高级中学2017-2018学年高二上学期第一次月考化学试题



