名校
1 . 纳米碗C40H10是一种奇特的碗状共轭体系。高温条件下,C40H10可以由C40H20分子经过连续5步氢抽提和闭环脱氢反应生成。其中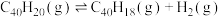 的反应机理和能量变化如图。下列说法不正确的是
的反应机理和能量变化如图。下列说法不正确的是
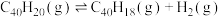 的反应机理和能量变化如图。下列说法不正确的是
的反应机理和能量变化如图。下列说法不正确的是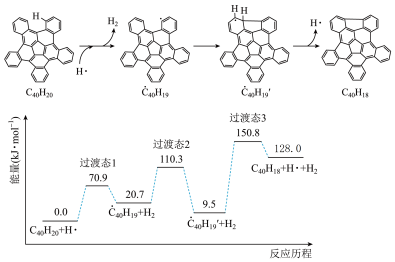
| A.选择相对较高的温度更有利于制备纳米碗 |
| B.推测 C40H10纳米碗中含5个五元环 |
C.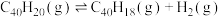 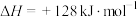 |
| D.该反应历程包含了3步基元反应,且第3步是该反应的决速步骤 |
您最近一年使用:0次
2024-05-03更新
|
475次组卷
|
3卷引用:广东省大湾区普通高中2024届高三下学期毕业年级联合模拟考试(二)化学试卷
解题方法
2 . 室温下,某刚性密闭容器中按体积比1:2充入X(g)和Y(g),发生反应X(g)+ Y(g) P(g)+Q(g)。下图表示该反应的历程, M(g)和N(g)均是中间产物。下列说法错误的是
P(g)+Q(g)。下图表示该反应的历程, M(g)和N(g)均是中间产物。下列说法错误的是
 P(g)+Q(g)。下图表示该反应的历程, M(g)和N(g)均是中间产物。下列说法错误的是
P(g)+Q(g)。下图表示该反应的历程, M(g)和N(g)均是中间产物。下列说法错误的是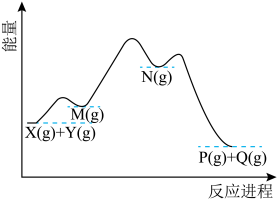
| A.反应的历程分3步进行 |
| B.反应过程中,N比M所能达到的最高浓度更大 |
| C.反应达到平衡时,升高温度, X的浓度增大 |
| D.若初始时,按体积比2:1充入X(g)和Y(g),其他条件不变,平衡时P(g)的百分含量不变 |
您最近一年使用:0次
3 . 一定温度下,反应 的机理第1步为
的机理第1步为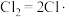 ,理论计算后续步骤可能的反应机理如图所示,TS1和TS2表示过渡态。下列说法错误的是
,理论计算后续步骤可能的反应机理如图所示,TS1和TS2表示过渡态。下列说法错误的是
 的机理第1步为
的机理第1步为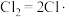 ,理论计算后续步骤可能的反应机理如图所示,TS1和TS2表示过渡态。下列说法错误的是
,理论计算后续步骤可能的反应机理如图所示,TS1和TS2表示过渡态。下列说法错误的是
A.该反应的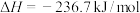 | B.机理a、b均表示2步基元反应 |
C.机理a、b决速步的能垒: | D.由机理a可知键能大小:Cl-Si<H-Si |
您最近一年使用:0次
名校
4 . 一定条件下,反应物和生成物的相对能量与反应历程示意图如下,下列说法不正确 的是
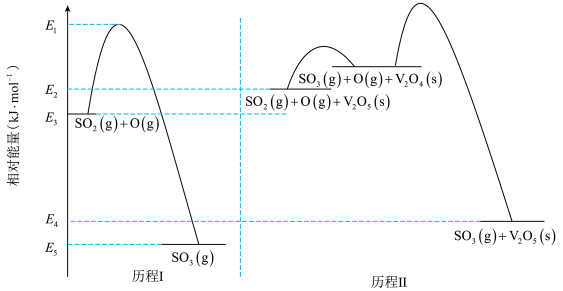

A.由历程I可计算, 的总键能 的总键能 |
B.由历程Ⅱ可知,相同条件下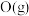 的浓度比 的浓度比 的浓度对反应速度影响更大 的浓度对反应速度影响更大 |
C.相同条件下, 的平衡转化率,历程I 的平衡转化率,历程I 历程Ⅱ 历程Ⅱ |
D.由历程I和历程Ⅱ可得, |
您最近一年使用:0次
2023-05-05更新
|
879次组卷
|
5卷引用:浙江省杭州地区(含周边)重点中学2022-2023学年高三下学期联考化学试题
浙江省杭州地区(含周边)重点中学2022-2023学年高三下学期联考化学试题浙江省温州新力量联盟2022-2023学年高二下学期期末检测化学试题(已下线)考点17 化学反应的热效应(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(全国通用)(已下线)题型06 反应热的判断及计算-2024年高考化学答题技巧与模板构建(已下线)热点15 化学反应原理(反应历程)图像分析
名校
5 . 我国在应对气候变化工作中取得显著成效,并向国际社会承诺2030年实现“碳达峰”,2060年实现“碳中和”。因此将 转化为高附加值化学品成为科学家研究的重要课题。回答下列问题:
转化为高附加值化学品成为科学家研究的重要课题。回答下列问题:
在 加氢合成甲醇的体系中,同时存在以下反应:
加氢合成甲醇的体系中,同时存在以下反应:
反应i:

反应ii:

(1)在特定温度下,由稳定态单质生成1mol化合物的焓变叫做该物质在此温度下的标准摩尔生成焓。表中为几种物质在298K的标准生成焓,则反应ii的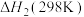 =
=______  。
。
(2)在 加氢合成甲醇的体系中,下列说法不正确的是______(填序号)。
加氢合成甲醇的体系中,下列说法不正确的是______(填序号)。
(3)不同条件下,按照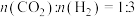 投料,
投料, 的平衡转化率如下图所示:
的平衡转化率如下图所示:

①压强 、
、 、
、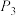 由大到小的顺序是
由大到小的顺序是______ ;压强为 时,温度高于570℃之后,随着温度升高
时,温度高于570℃之后,随着温度升高 平衡转化率增大的原因
平衡转化率增大的原因______ 。
②图中点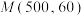 ,此时压强
,此时压强 为0.1MPa,
为0.1MPa, 的选择性为
的选择性为 (选择性:转化的
(选择性:转化的 中生成
中生成 和
和 的百分比),
的百分比), 的平衡转化率为60%。则该温度时反应i的平衡常数
的平衡转化率为60%。则该温度时反应i的平衡常数 =
=______  (分压=总压×物质的量分数)。
(分压=总压×物质的量分数)。
③反应ii的净速率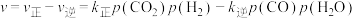 ,其中
,其中 、
、 分别为正、逆反应的速率常数,
分别为正、逆反应的速率常数, 为气体的分压,降低温度时,
为气体的分压,降低温度时,
____ (选填“增大”、“减小”或“不变”)。
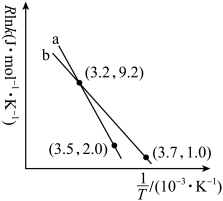
(4)反应i的Arrhenius经验公式的实验数据如图中 线所示,计算该反应的活化能
线所示,计算该反应的活化能
______  ;当改变外界条件时,实验数据如图中
;当改变外界条件时,实验数据如图中 线所示,则改变的外界条件可能是
线所示,则改变的外界条件可能是______ 。已知:经验公式为: (其中
(其中 为反应的活化能,
为反应的活化能, 为速率常数,R和C为常数)。
为速率常数,R和C为常数)。
 转化为高附加值化学品成为科学家研究的重要课题。回答下列问题:
转化为高附加值化学品成为科学家研究的重要课题。回答下列问题:在
 加氢合成甲醇的体系中,同时存在以下反应:
加氢合成甲醇的体系中,同时存在以下反应:反应i:


反应ii:


(1)在特定温度下,由稳定态单质生成1mol化合物的焓变叫做该物质在此温度下的标准摩尔生成焓。表中为几种物质在298K的标准生成焓,则反应ii的
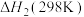 =
= 。
。物质 |
|
|
|
|
标准摩尔生成焓( | 0 | -394 | -111 | -242 |
(2)在
 加氢合成甲醇的体系中,下列说法不正确的是______(填序号)。
加氢合成甲醇的体系中,下列说法不正确的是______(填序号)。A.增大H2浓度有利于提高 的转化率 的转化率 |
| B.若气体的平均相对分子质量不变,说明反应i、ii都已达平衡 |
| C.体系达平衡后,若压缩体积,反应i平衡正向移动,反应ii平衡不移动 |
| D.选用合适的催化剂可以提高甲醇在单位时间内的产量 |
(3)不同条件下,按照
 投料,
投料, 的平衡转化率如下图所示:
的平衡转化率如下图所示:
①压强
 、
、 、
、 由大到小的顺序是
由大到小的顺序是 时,温度高于570℃之后,随着温度升高
时,温度高于570℃之后,随着温度升高 平衡转化率增大的原因
平衡转化率增大的原因②图中点
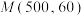 ,此时压强
,此时压强 为0.1MPa,
为0.1MPa, 的选择性为
的选择性为 (选择性:转化的
(选择性:转化的 中生成
中生成 和
和 的百分比),
的百分比), 的平衡转化率为60%。则该温度时反应i的平衡常数
的平衡转化率为60%。则该温度时反应i的平衡常数 =
= (分压=总压×物质的量分数)。
(分压=总压×物质的量分数)。③反应ii的净速率
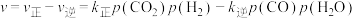 ,其中
,其中 、
、 分别为正、逆反应的速率常数,
分别为正、逆反应的速率常数, 为气体的分压,降低温度时,
为气体的分压,降低温度时,
(4)反应i的Arrhenius经验公式的实验数据如图中
 线所示,计算该反应的活化能
线所示,计算该反应的活化能
 ;当改变外界条件时,实验数据如图中
;当改变外界条件时,实验数据如图中 线所示,则改变的外界条件可能是
线所示,则改变的外界条件可能是 (其中
(其中 为反应的活化能,
为反应的活化能, 为速率常数,R和C为常数)。
为速率常数,R和C为常数)。
您最近一年使用:0次
6 . 东南大学化学化工学院张袁健教授探究 和
和 分别催化
分别催化 分解的反应机理,部分反应历程如图所示(MS表示吸附在催化剂表面物种;TS表示过渡态):
分解的反应机理,部分反应历程如图所示(MS表示吸附在催化剂表面物种;TS表示过渡态):
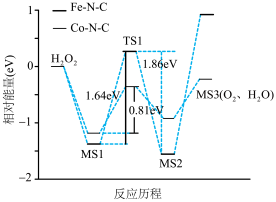
下列说法错误的是
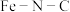 和
和 分别催化
分别催化 分解的反应机理,部分反应历程如图所示(MS表示吸附在催化剂表面物种;TS表示过渡态):
分解的反应机理,部分反应历程如图所示(MS表示吸附在催化剂表面物种;TS表示过渡态):
下列说法错误的是
A.催化效果:催化剂 高于催化剂 高于催化剂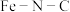 |
B.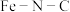 催化: 催化: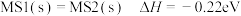 |
C.催化剂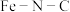 比催化剂 比催化剂 的产物更容易脱附 的产物更容易脱附 |
D. 催化 催化 分解吸热, 分解吸热,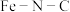 催化 催化 分解放热 分解放热 |
您最近一年使用:0次
2023-03-28更新
|
1379次组卷
|
5卷引用:山东省实验中学2023届高三下学期3月一模化学试题
山东省实验中学2023届高三下学期3月一模化学试题(已下线)化学-2023年高考押题预测卷03(山东卷)(含考试版、全解全析、参考答案、答题卡)(已下线)专题15 化学反应速率和化学平衡江西省丰城中学2022-2023学年高一下学期4月期中考试化学试题甘肃省天水市第一中学 第三中学联考2023-2024学年高三上学期第三次月考 化学试题
7 . HCl(g)溶于大量水的过程放热,循环关系如图所示:下列说法不正确的是

A.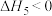 , ,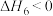 |
B.若将循环图中 元素改成 元素改成 元素,相应的 元素,相应的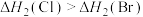 |
C.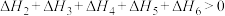 |
D.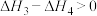 |
您最近一年使用:0次
2023-04-21更新
|
216次组卷
|
4卷引用:浙江省绍兴市2022-2023学年高三上学期11月份选考科目诊断性考试(一模)化学试题
名校
解题方法
8 . CO2作为未来的重要碳源,其选择性加氢合成CH3OH 一直是研究热点。在CO2加氢合成CH3OH的体系中,同时发生以下反应:
反应i:CO2(g) +3H2(g) CH3OH(g)+H2O(g)△H1<0
CH3OH(g)+H2O(g)△H1<0
反应ii:CO2(g) +H2(g) CO(g) +H2O(g) △H2
CO(g) +H2O(g) △H2
(1)反应i在_______ (填“高温”“低温”或“任意温度”)下可以自发进行。
(2)在特定温度下,由稳定态单质生成1mol化合物的焓变叫该物质在此温度下的标准生成焓( )。下表为几种物质在298K的标准生成焓,则反应ii的△H2=
)。下表为几种物质在298K的标准生成焓,则反应ii的△H2=_______ kJ·mol-1.
(3)在CO2加氢合成CH3OH的体系中,下列说法错误的是_______(填标号)。
(4)某温度下,向容积为1L的密闭容器中通入1molCO2 (g)和5molH2(g), 10min后体系达到平衡,此时H2的转化率为8%,CH3OH 的选择性为50%。已知:CH3OH的选择性x=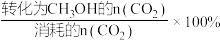
①用CO2表示0~10min内平均反应速率v(CO2)=_______ 。
②反应i的平衡常数K_______ (写出计算式即可)。
(5)维持压强和投料不变,将CO2和H2按一定流速通过反应器,二氧化碳的转化率α(CO2) 和甲醇的选择性x(CH3OH)随温度变化的关系如图所示:
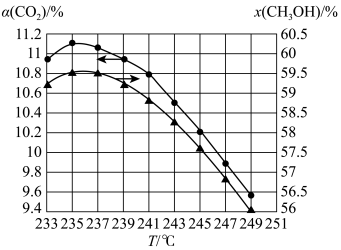
已知催化剂活性受温度影响变化不大。结合反应i和反应ii,分析235℃后曲线变化的原因。
①甲醇的选择性随温度升高而下降的原因是_______ ;
②二氧化碳的转化率随温度升高也在下降的可能原因是_______ 。
反应i:CO2(g) +3H2(g)
 CH3OH(g)+H2O(g)△H1<0
CH3OH(g)+H2O(g)△H1<0反应ii:CO2(g) +H2(g)
 CO(g) +H2O(g) △H2
CO(g) +H2O(g) △H2(1)反应i在
(2)在特定温度下,由稳定态单质生成1mol化合物的焓变叫该物质在此温度下的标准生成焓(
 )。下表为几种物质在298K的标准生成焓,则反应ii的△H2=
)。下表为几种物质在298K的标准生成焓,则反应ii的△H2=| 物质 | H2(g) | CO2(g) | CO(g) | H2O(g) |
 (kJ·mol-1) (kJ·mol-1) | 0 | -394 | -111 | -242 |
| A.增大H2浓度有利于提高CO2的转化率 |
| B.若气体的平均相对分子质量保持不变,说明反应体系已达平衡 |
| C.体系达平衡后,若压缩体积,则反应i平衡正向移动,反应ii平衡不移动。 |
| D.选用合适的催化剂可以提高平衡之前CH3OH在单位时间内的产量 |
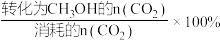
①用CO2表示0~10min内平均反应速率v(CO2)=
②反应i的平衡常数K
(5)维持压强和投料不变,将CO2和H2按一定流速通过反应器,二氧化碳的转化率α(CO2) 和甲醇的选择性x(CH3OH)随温度变化的关系如图所示:

已知催化剂活性受温度影响变化不大。结合反应i和反应ii,分析235℃后曲线变化的原因。
①甲醇的选择性随温度升高而下降的原因是
②二氧化碳的转化率随温度升高也在下降的可能原因是
您最近一年使用:0次
2022-06-06更新
|
280次组卷
|
2卷引用:吉林省东北师大附中长春十一中等五校2022届高三1月联合模拟考试理科综合化学试题
名校
解题方法
9 . HCOOH在Pd催化剂表面脱氢的反应历程与能量的关系如下。下列说法错误的是
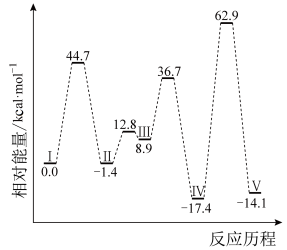



A.在Pd催化剂表面HCOOH脱氢反应的 H<0 H<0 |
| B.在Pd催化剂表面离解O—H键比C—H键的活化能低 |
| C.在历程I~V中,生成V的反应速率最慢 |
| D.用DCOOH或HCOOD代替HCOOH,得到的产物都有HD和CO2 |
您最近一年使用:0次
2023-05-06更新
|
275次组卷
|
2卷引用:山东省实验中学2023届高三下学期5月第一次模拟考试化学试题
10 . “碳中和”已成为人们关注的焦点,实现“碳中和”的基本途径是“减排”(减少在大气中排放 )和“增汇”(增加对大气中
)和“增汇”(增加对大气中 的吸收)。
的吸收)。
(1)中国科技研究者利用 人工合成甲醇,进而制备甲醛(HCHO)取得了进展。
人工合成甲醇,进而制备甲醛(HCHO)取得了进展。
第一步合成甲醇涉及的反应有:
ⅰ.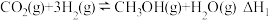
ⅱ.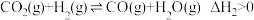
①生成焓是某温度下,标准状态的各种元素的最稳定单质生成标准状态1mol某纯物质的热效应。部分物质的生成焓数据如下表(单位:kJ/mol):
由此可求得
_______ kJ/mol。
②反应ⅰ和ⅱ在一定条件下建立平衡,下列说法正确的有_______ 。
A.加入催化剂,可以加快ⅰ的反应速率和提高CO的转化率
B.移走CO(g),可以使反应ⅱ平衡向右进行
C.容器内气体的相对分子质量不再改变说明反应达到了平衡
D.压缩反应容器,反应ⅰ的化学平衡常数变小
一定条件下,在某密闭容器中投入初始投料比 发生上述反应。体系中
发生上述反应。体系中 和c(CO)随时间变化,甲醇的选择性(指转化为甲醇的
和c(CO)随时间变化,甲醇的选择性(指转化为甲醇的 占发生反应的
占发生反应的 的百分比)随温度变化如图所示:
的百分比)随温度变化如图所示:
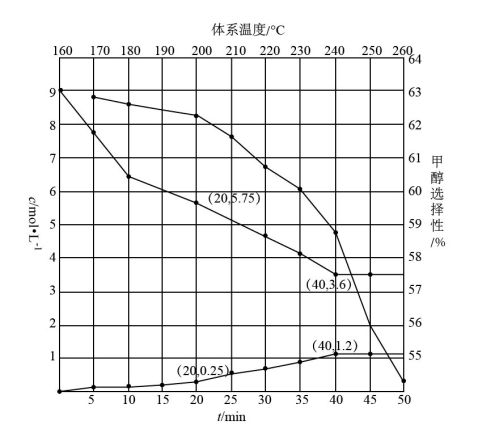
③计算 时间内
时间内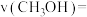
_______  ,此条件下反应ⅱ平衡常数K=
,此条件下反应ⅱ平衡常数K=_______ (写出计算过程,保留2位小数)。
④甲醇选择性随温度升高而降低的原因可能是_______ 。
(2)甲醇脱氢制甲醛, 催化反应的部分机理如下(*表示有一个单电子可以参与成键):
催化反应的部分机理如下(*表示有一个单电子可以参与成键):
历程ⅰ: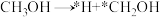
历程ⅱ:
历程ⅲ:
①写出历程ⅱ的方程式_______ 。
②若在甲乙两个等容积的恒容容器中分别加入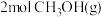 和
和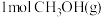 ,在同一条件下达到平衡,转化率较大的是
,在同一条件下达到平衡,转化率较大的是_______ (填甲或乙),原因是_______ 。
 )和“增汇”(增加对大气中
)和“增汇”(增加对大气中 的吸收)。
的吸收)。(1)中国科技研究者利用
 人工合成甲醇,进而制备甲醛(HCHO)取得了进展。
人工合成甲醇,进而制备甲醛(HCHO)取得了进展。第一步合成甲醇涉及的反应有:
ⅰ.
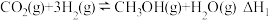
ⅱ.
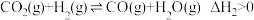
①生成焓是某温度下,标准状态的各种元素的最稳定单质生成标准状态1mol某纯物质的热效应。部分物质的生成焓数据如下表(单位:kJ/mol):
 |  |  |  |
| -393.51 | -201.17 | -241.82 | 0 |
由此可求得

②反应ⅰ和ⅱ在一定条件下建立平衡,下列说法正确的有
A.加入催化剂,可以加快ⅰ的反应速率和提高CO的转化率
B.移走CO(g),可以使反应ⅱ平衡向右进行
C.容器内气体的相对分子质量不再改变说明反应达到了平衡
D.压缩反应容器,反应ⅰ的化学平衡常数变小
一定条件下,在某密闭容器中投入初始投料比
 发生上述反应。体系中
发生上述反应。体系中 和c(CO)随时间变化,甲醇的选择性(指转化为甲醇的
和c(CO)随时间变化,甲醇的选择性(指转化为甲醇的 占发生反应的
占发生反应的 的百分比)随温度变化如图所示:
的百分比)随温度变化如图所示:
③计算
 时间内
时间内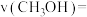
 ,此条件下反应ⅱ平衡常数K=
,此条件下反应ⅱ平衡常数K=④甲醇选择性随温度升高而降低的原因可能是
(2)甲醇脱氢制甲醛,
 催化反应的部分机理如下(*表示有一个单电子可以参与成键):
催化反应的部分机理如下(*表示有一个单电子可以参与成键):历程ⅰ:
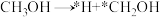
历程ⅱ:
历程ⅲ:

①写出历程ⅱ的方程式
②若在甲乙两个等容积的恒容容器中分别加入
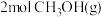 和
和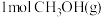 ,在同一条件下达到平衡,转化率较大的是
,在同一条件下达到平衡,转化率较大的是
您最近一年使用:0次
2022-04-29更新
|
978次组卷
|
4卷引用:广东省粤港澳大湾区普通高中2022届高三第二次模拟考试化学试题
广东省粤港澳大湾区普通高中2022届高三第二次模拟考试化学试题广东省茂名市普通高中毕业班2022届高三下学期模拟考试化学试题(已下线)化学-2023年高考押题预测卷02(广东卷)(含考试版、全解全析、参考答案、答题卡)(已下线)专题15 化学反应原理综合题-三年(2020-2022)高考真题分项汇编







