1 . 某条件下2SO2(g)+O2(g) 2SO3(g)反应过程的能量变化如图所示。
2SO3(g)反应过程的能量变化如图所示。
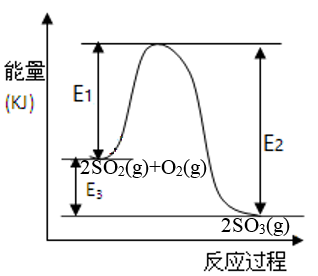
请回答下列问题:
(1)该条件下将5molSO2和2molO2通入2L的恒容密闭容器中发生反应。2min反应达到平衡,测得反应物O2剩余1.5mol,此时用O2表示该反应的速率为___ mol/(L·min),反应__ (填“放出”或“吸收”)的热量为_____ (含E1、E2或E3的表达式);
(2)下列叙述中能证明该反应已达化学平衡状态的是___ (填数字序号);
①容器内气体所含的原子总数不再发生变化
②SO2的浓度不再发生变化
③相同时间内消耗2nmolSO2的同时生成nmolO2
(3)若以如图所示装置将SO2、O2以一定压强喷到活性电极上反应可生产硫酸。该装置中电子由____ (填“A”或“B”)电极流出。为持续稳定生产,硫酸溶液的浓度应维持49%不变,则通入SO2和水的质量比为________ 。
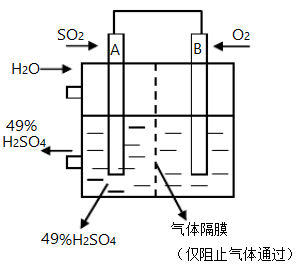
 2SO3(g)反应过程的能量变化如图所示。
2SO3(g)反应过程的能量变化如图所示。
请回答下列问题:
(1)该条件下将5molSO2和2molO2通入2L的恒容密闭容器中发生反应。2min反应达到平衡,测得反应物O2剩余1.5mol,此时用O2表示该反应的速率为
(2)下列叙述中能证明该反应已达化学平衡状态的是
①容器内气体所含的原子总数不再发生变化
②SO2的浓度不再发生变化
③相同时间内消耗2nmolSO2的同时生成nmolO2
(3)若以如图所示装置将SO2、O2以一定压强喷到活性电极上反应可生产硫酸。该装置中电子由

您最近一年使用:0次
2 . Ⅰ.(1)在反应A(g)+3B(g)===2C(g)中,若以物质A表示的该反应的化学反应速率为0.2 mol·L-1·min-1,则以物质B的化学反应速率为__________ mol·L-1·min-1。
(2)在2 L的密闭容器中,充入2 mol N2和3 mol H2,在一定条件下发生反应,3 s后测得N2为1.9 mol,则以H2的浓度变化表示的此化学反应速率为vB=_________ mol·L-1·s-1。
(3)将10 mol A和5 mol B放入容积为10 L的密闭容器中,某温度下发生反应:3A(g)+B(g) 2C(g),在最初2 s内,消耗A的平均速率为0.06 mol·L-1·s-1,则在2 s时,容器中有
2C(g),在最初2 s内,消耗A的平均速率为0.06 mol·L-1·s-1,则在2 s时,容器中有______ mol A,此时C的物质的量浓度为________ ,若此后各物质的量均不再变化,则证明此可逆反应达到了______ 的程度。
A.反应彻底 B.反应终止 C.化学平衡 D.无法判断
Ⅱ. 已知:①2CO(g)+O2(g)===2CO2(g) ΔH=-566 kJ·mol-1;②N2(g)+O2(g)===2NO(g) ΔH=+180 kJ·mol-1,则2CO(g)+2NO(g)===N2(g)+2CO2(g)的ΔH =________ 。
Ⅲ. 下列热化学方程式书写正确的是(ΔH的绝对值均正确)________ 。
A.C2H5OH(l)+3O2(g)===2CO2(g)+3H2O(g)ΔH=-1 367.0 kJ·mol-1(燃烧热)
B.NaOH(aq)+HCl(aq)===NaCl(aq)+H2O(l)ΔH=-57.3 kJ·mol-1(中和热)
C.S(s)+O2(g)===SO2(g)ΔH=-296.8 kJ·mol-1(燃烧热)
D.2NO2===O2+2NOΔH=+116.2 kJ·mol-1(反应热)
(2)在2 L的密闭容器中,充入2 mol N2和3 mol H2,在一定条件下发生反应,3 s后测得N2为1.9 mol,则以H2的浓度变化表示的此化学反应速率为vB=
(3)将10 mol A和5 mol B放入容积为10 L的密闭容器中,某温度下发生反应:3A(g)+B(g)
 2C(g),在最初2 s内,消耗A的平均速率为0.06 mol·L-1·s-1,则在2 s时,容器中有
2C(g),在最初2 s内,消耗A的平均速率为0.06 mol·L-1·s-1,则在2 s时,容器中有A.反应彻底 B.反应终止 C.化学平衡 D.无法判断
Ⅱ. 已知:①2CO(g)+O2(g)===2CO2(g) ΔH=-566 kJ·mol-1;②N2(g)+O2(g)===2NO(g) ΔH=+180 kJ·mol-1,则2CO(g)+2NO(g)===N2(g)+2CO2(g)的ΔH =
Ⅲ. 下列热化学方程式书写正确的是(ΔH的绝对值均正确)
A.C2H5OH(l)+3O2(g)===2CO2(g)+3H2O(g)ΔH=-1 367.0 kJ·mol-1(燃烧热)
B.NaOH(aq)+HCl(aq)===NaCl(aq)+H2O(l)ΔH=-57.3 kJ·mol-1(中和热)
C.S(s)+O2(g)===SO2(g)ΔH=-296.8 kJ·mol-1(燃烧热)
D.2NO2===O2+2NOΔH=+116.2 kJ·mol-1(反应热)
您最近一年使用:0次
解题方法
3 . 在标准状态下,下列物质气态时的相对能量如下表:
下列说法不正确 的是
物质 | O |  | 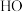 |  |  |  |  |
能量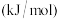 | 249 | 218 | 39 | 0 | 0 | 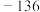 |  |
A. 的键能为 的键能为 |
B. 的燃烧热为 的燃烧热为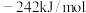 |
C. 中氧氧单键的键能为 中氧氧单键的键能为 |
D. |
您最近一年使用:0次
解题方法
4 . 铬及其化合物在催化、金属防腐等方面具有重要应用。回答下列问题:
(1)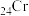 属于
属于___________ 区元素。
(2) 催化丙烷脱氢过程中,部分反应历程如图,
催化丙烷脱氢过程中,部分反应历程如图, 过程的焓变为
过程的焓变为___________ (列式表示)。

(3) 溶液中存在多个平衡。本题条件下仅需考虑如下平衡:
溶液中存在多个平衡。本题条件下仅需考虑如下平衡:
(i)

(ii)
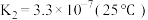
①下列有关 溶液的说法正确的有
溶液的说法正确的有___________ (填字母)。
a.加入少量硫酸溶液,溶液的pH不变
B.加入少量水稀释,溶液中所有离子的浓度均减小
C.加入少量硫酸溶液,反应(ⅰ)的平衡逆向移动
D.加入少量 固体,平衡时
固体,平衡时 与
与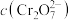 的比值保持不变
的比值保持不变
②25℃时, 溶液中,设
溶液中,设 、
、 与
与 的平衡浓度分别为x、y、
的平衡浓度分别为x、y、 ,则x、y、z之间的关系式为
,则x、y、z之间的关系式为___________ 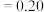
③电解铬酸钾溶液制备重铬酸钾的装置示意图如图所示,请写出该制备过程总反应的化学方程式为___________ 。

(1)
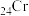 属于
属于(2)
 催化丙烷脱氢过程中,部分反应历程如图,
催化丙烷脱氢过程中,部分反应历程如图, 过程的焓变为
过程的焓变为
(3)
 溶液中存在多个平衡。本题条件下仅需考虑如下平衡:
溶液中存在多个平衡。本题条件下仅需考虑如下平衡:(i)


(ii)

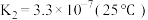
①下列有关
 溶液的说法正确的有
溶液的说法正确的有a.加入少量硫酸溶液,溶液的pH不变
B.加入少量水稀释,溶液中所有离子的浓度均减小
C.加入少量硫酸溶液,反应(ⅰ)的平衡逆向移动
D.加入少量
 固体,平衡时
固体,平衡时 与
与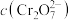 的比值保持不变
的比值保持不变②25℃时,
 溶液中,设
溶液中,设 、
、 与
与 的平衡浓度分别为x、y、
的平衡浓度分别为x、y、 ,则x、y、z之间的关系式为
,则x、y、z之间的关系式为
③电解铬酸钾溶液制备重铬酸钾的装置示意图如图所示,请写出该制备过程总反应的化学方程式为

您最近一年使用:0次
解题方法
5 . 下列关于化学反应与能量的说法中,不正确 的是
A. 与盐酸的反应属于放热反应 与盐酸的反应属于放热反应 |
| B.能量变化与化学键的断裂和形成有关 |
C. 与 与 的反应属于放热反应 的反应属于放热反应 |
| D.反应物的总能量低于生成物的总能量,反应时从环境吸收能量 |
您最近一年使用:0次
2023-05-10更新
|
245次组卷
|
2卷引用:新疆乌鲁木齐市六校联考2022-2023学年高一下学期6月期末考试化学试题
名校
6 . 一定条件下,反应物和生成物的相对能量与反应历程示意图如下,下列说法不正确 的是
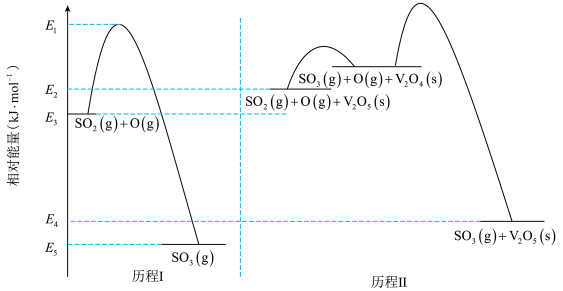

A.由历程I可计算, 的总键能 的总键能 |
B.由历程Ⅱ可知,相同条件下 的浓度比 的浓度比 的浓度对反应速度影响更大 的浓度对反应速度影响更大 |
C.相同条件下, 的平衡转化率,历程I 的平衡转化率,历程I 历程Ⅱ 历程Ⅱ |
D.由历程I和历程Ⅱ可得, |
您最近一年使用:0次
2023-05-05更新
|
884次组卷
|
5卷引用:浙江省温州新力量联盟2022-2023学年高二下学期期末检测化学试题
浙江省温州新力量联盟2022-2023学年高二下学期期末检测化学试题浙江省杭州地区(含周边)重点中学2022-2023学年高三下学期联考化学试题(已下线)考点17 化学反应的热效应(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(全国通用)(已下线)题型06 反应热的判断及计算-2024年高考化学答题技巧与模板构建(已下线)热点15 化学反应原理(反应历程)图像分析
7 . 乙苯催化脱氢制备苯乙烯是目前生产苯乙烯的主要方法,反应: →
→ +H2(g)
+H2(g)  。下列有关说法正确的是
。下列有关说法正确的是
 →
→ +H2(g)
+H2(g)  。下列有关说法正确的是
。下列有关说法正确的是A.使用催化剂可降低该反应的 |
B. 的总能量大于 的总能量大于 与 与 的总能量 的总能量 |
C.1g 完全反应转化为 完全反应转化为 需吸收约1.1kJ的能量 需吸收约1.1kJ的能量 |
D.反应 → → (g)+H2(g) (g)+H2(g)  |
您最近一年使用:0次
名校
解题方法
8 . 炭黑可以活化氧分子得到活化氧( ),活化氧可以快速氧化
),活化氧可以快速氧化 ,从而消除雾霾。其活化过程中的能量变化如图所示,下列说法错误的是
,从而消除雾霾。其活化过程中的能量变化如图所示,下列说法错误的是
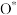 ),活化氧可以快速氧化
),活化氧可以快速氧化 ,从而消除雾霾。其活化过程中的能量变化如图所示,下列说法错误的是
,从而消除雾霾。其活化过程中的能量变化如图所示,下列说法错误的是
A.生成活化氧的 | B.活化过程中①→②的反应是快反应 |
| C.活化过程中有水时的活化能降低 | D.氧化 的过程中,炭黑起催化作用 的过程中,炭黑起催化作用 |
您最近一年使用:0次
2022-12-29更新
|
327次组卷
|
2卷引用:广东省深圳市宝安区2021-2022学年高二上学期期末调研测试化学试题
解题方法
9 . 联氨(N2H4)在常温下为无色液体,可用作火箭燃料。已知反应:
①2O2(g)+N2(g)=N2O4(l) △H1
②N2(g)+2H2(g)=N2H4(l) △H2
③O2(g)+2H2(g)=2H2O(g) △H3
④2N2H4(l)+N2O4(l)=3N2(g)+4H2O(g) △H4=-1048.9kJ•mol-1
下列说法不正确 的是
①2O2(g)+N2(g)=N2O4(l) △H1
②N2(g)+2H2(g)=N2H4(l) △H2
③O2(g)+2H2(g)=2H2O(g) △H3
④2N2H4(l)+N2O4(l)=3N2(g)+4H2O(g) △H4=-1048.9kJ•mol-1
下列说法
| A.O2(g)+2H2(g)=2H2O(l) △H5,△H5>△H3 |
| B.△H2不可表示N2的燃烧热 |
| C.1molO2(g)和2molH2(g)具有的总能量高于2molH2O(g)具有的总能量 |
| D.联氨和N2O4作火箭推进剂的原因之一是反应放出大量的热 |
您最近一年使用:0次
10 . 在一定体积下, 分解时相关物质的相对能量与反应历程关系如图所示[已知
分解时相关物质的相对能量与反应历程关系如图所示[已知 和
和 的相对能量为0]。下列说法错误的是
的相对能量为0]。下列说法错误的是

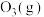 分解时相关物质的相对能量与反应历程关系如图所示[已知
分解时相关物质的相对能量与反应历程关系如图所示[已知 和
和 的相对能量为0]。下列说法错误的是
的相对能量为0]。下列说法错误的是
A.根据图像可知: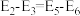 |
B.形成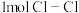 键时释放的能量为 键时释放的能量为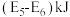 |
C. 的平衡转化率:历程I=历程II 的平衡转化率:历程I=历程II |
D.在该历程中速率最快步骤的热化学方程式为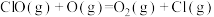  |
您最近一年使用:0次
2024-02-13更新
|
91次组卷
|
2卷引用:新疆乌鲁木齐市第101中学2023-2024学年高二上学期1月期末化学试题



