解题方法
1 . 含碳化合物的合成与转化具有重要的研究价值。
(1)热力学规定,在标准压强和指定温度下,由元素最稳定的单质生成 化合物时的反应热称为该化合物的标准摩尔生成焓。常温下,
化合物时的反应热称为该化合物的标准摩尔生成焓。常温下, 、
、 的标准摩尔生成焓分别为
的标准摩尔生成焓分别为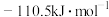 、
、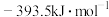 ,则表示
,则表示 标准摩尔生成焓的热化学反应方程式为
标准摩尔生成焓的热化学反应方程式为___________ 。
(2) 与
与 在某催化剂作用下的反应如图所示:
在某催化剂作用下的反应如图所示:
该反应的热化学反应方程式为___________ 。
(3)汽车尾气中的 和
和 在催化转化器中可反应生成两种无毒无害的气体(该反应为放热反应),若该反应在恒温、恒容的密闭体系中进行,下列示意图正确且能说明反应在进行到时刻达到平衡状态的是___________(填标号)。
在催化转化器中可反应生成两种无毒无害的气体(该反应为放热反应),若该反应在恒温、恒容的密闭体系中进行,下列示意图正确且能说明反应在进行到时刻达到平衡状态的是___________(填标号)。
(4) 与
与 可发生反应:
可发生反应: ,2L密闭容器中通入
,2L密闭容器中通入
 和
和
 ,在不同催化剂(A、B)作用下,进行相同时间后,
,在不同催化剂(A、B)作用下,进行相同时间后, 的产率随反应温度的变化如图所示:
的产率随反应温度的变化如图所示: 、
、 表示,则
表示,则
___________  (填“>”“<”或“=”,下同)。
(填“>”“<”或“=”,下同)。
②y点对应的v(逆)___________ z点对应的v(正)。
③若w点的时间为5min,则 的平均反应速率为
的平均反应速率为___________  。此温度下的化学平衡常数为
。此温度下的化学平衡常数为___________ 。
(1)热力学规定,在标准压强和指定温度下,由元素最稳定的单质生成
 化合物时的反应热称为该化合物的标准摩尔生成焓。常温下,
化合物时的反应热称为该化合物的标准摩尔生成焓。常温下, 、
、 的标准摩尔生成焓分别为
的标准摩尔生成焓分别为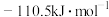 、
、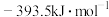 ,则表示
,则表示 标准摩尔生成焓的热化学反应方程式为
标准摩尔生成焓的热化学反应方程式为(2)
 与
与 在某催化剂作用下的反应如图所示:
在某催化剂作用下的反应如图所示: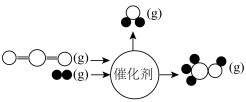
| 化学键 |
|
|
|
|
|
键能/( ) ) | 438 | 326 | 802 | 464 | 414 |
(3)汽车尾气中的
 和
和 在催化转化器中可反应生成两种无毒无害的气体(该反应为放热反应),若该反应在恒温、恒容的密闭体系中进行,下列示意图正确且能说明反应在进行到时刻达到平衡状态的是___________(填标号)。
在催化转化器中可反应生成两种无毒无害的气体(该反应为放热反应),若该反应在恒温、恒容的密闭体系中进行,下列示意图正确且能说明反应在进行到时刻达到平衡状态的是___________(填标号)。A.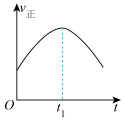 | B.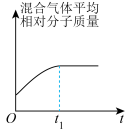 |
C.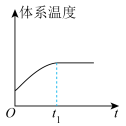 | D.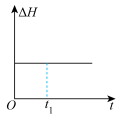 |
 与
与 可发生反应:
可发生反应: ,2L密闭容器中通入
,2L密闭容器中通入
 和
和
 ,在不同催化剂(A、B)作用下,进行相同时间后,
,在不同催化剂(A、B)作用下,进行相同时间后, 的产率随反应温度的变化如图所示:
的产率随反应温度的变化如图所示: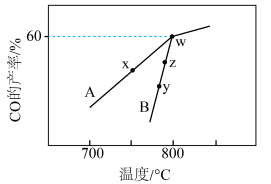
 、
、 表示,则
表示,则
 (填“>”“<”或“=”,下同)。
(填“>”“<”或“=”,下同)。②y点对应的v(逆)
③若w点的时间为5min,则
 的平均反应速率为
的平均反应速率为 。此温度下的化学平衡常数为
。此温度下的化学平衡常数为
您最近一年使用:0次
2 . 某科研团队利用 和
和 反应使之转化为水煤气,对争取2060年前实现“碳中和”、减缓燃料危机和减轻温室效应具有重要的意义。请回答下列问题:
反应使之转化为水煤气,对争取2060年前实现“碳中和”、减缓燃料危机和减轻温室效应具有重要的意义。请回答下列问题:
(1)A、B均为1L的恒容密闭容器,向A容器中充入1mol 和1mol
和1mol ,向B容器中充入1mol
,向B容器中充入1mol 和1mol
和1mol 在催化剂存在下发生反应:
在催化剂存在下发生反应: ,测得
,测得 的平衡转化率随温度的变化如图所示。
的平衡转化率随温度的变化如图所示。 表示0~5min内的化学反应速率为
表示0~5min内的化学反应速率为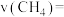
_______ ,此时的化学平衡常数 为
为_______ (保留两位小数),若在此温度下时向A容器的平衡体系中再充入 、
、 各0.4mol,CO、
各0.4mol,CO、 各1.2mol,重新达到平衡前,
各1.2mol,重新达到平衡前,
_______  (填“>”“<”或“=”)。
(填“>”“<”或“=”)。
②a点时该反应的平衡常数为 ,则
,则
_______  (填“>”“<”或“=”)。
(填“>”“<”或“=”)。
③a、b两点处容器内气体总压强分别是p(a)、p(b),则p(a)、p(b)的大小顺序为_______ 。
(2)对于反应③: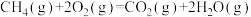 ,在使用不同催化剂时,相同时间内测得
,在使用不同催化剂时,相同时间内测得 的转化率随温度的变化如图所示。
的转化率随温度的变化如图所示。______ (填“Ⅰ”“Ⅱ”或“Ⅲ”)。如果d点已经达到平衡状态,则e点的
____  逆(填“>”“<”或“=”),f点转化率比d点低的原因是
逆(填“>”“<”或“=”),f点转化率比d点低的原因是____ 。
 和
和 反应使之转化为水煤气,对争取2060年前实现“碳中和”、减缓燃料危机和减轻温室效应具有重要的意义。请回答下列问题:
反应使之转化为水煤气,对争取2060年前实现“碳中和”、减缓燃料危机和减轻温室效应具有重要的意义。请回答下列问题:(1)A、B均为1L的恒容密闭容器,向A容器中充入1mol
 和1mol
和1mol ,向B容器中充入1mol
,向B容器中充入1mol 和1mol
和1mol 在催化剂存在下发生反应:
在催化剂存在下发生反应: ,测得
,测得 的平衡转化率随温度的变化如图所示。
的平衡转化率随温度的变化如图所示。
 表示0~5min内的化学反应速率为
表示0~5min内的化学反应速率为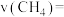
 为
为 、
、 各0.4mol,CO、
各0.4mol,CO、 各1.2mol,重新达到平衡前,
各1.2mol,重新达到平衡前,
 (填“>”“<”或“=”)。
(填“>”“<”或“=”)。②a点时该反应的平衡常数为
 ,则
,则
 (填“>”“<”或“=”)。
(填“>”“<”或“=”)。③a、b两点处容器内气体总压强分别是p(a)、p(b),则p(a)、p(b)的大小顺序为
(2)对于反应③:
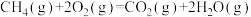 ,在使用不同催化剂时,相同时间内测得
,在使用不同催化剂时,相同时间内测得 的转化率随温度的变化如图所示。
的转化率随温度的变化如图所示。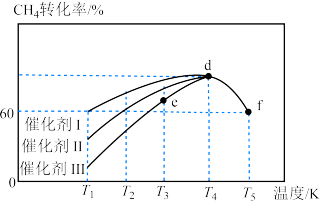

 逆(填“>”“<”或“=”),f点转化率比d点低的原因是
逆(填“>”“<”或“=”),f点转化率比d点低的原因是
您最近一年使用:0次
3 . 恒温下,在4L的密闭容器中充入4mol 和3.2mol
和3.2mol ,发生反应
,发生反应 ,反应过程中对
,反应过程中对 的物质的量进行检测,得到的数据如下表所示:
的物质的量进行检测,得到的数据如下表所示:
下列说法错误的是
 和3.2mol
和3.2mol ,发生反应
,发生反应 ,反应过程中对
,反应过程中对 的物质的量进行检测,得到的数据如下表所示:
的物质的量进行检测,得到的数据如下表所示:| 时间/min | 5 | 10 | 15 | 20 | 25 | 30 |
 | 0.32 | 0.56 | 0.72 | 0.80 | 0.80 | 0.80 |
A.前10分钟,用 表示的化学反应速率为 表示的化学反应速率为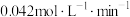 |
B. (逆):5分钟时小于10分钟时 (逆):5分钟时小于10分钟时 |
| C.平衡后,将容器的容积扩大到原来的两倍,再达平衡时,H2的物质的量浓度大于 0.2mol·L-1 |
| D.维持容器容积、温度不变,平衡时再加入CO2和CH3OH各3.2mol,平衡将向正反应方向进行 |
您最近一年使用:0次
4 . 二氧化氯常温下为黄绿色气体,在30℃时分解,50℃时发生爆炸性分解,与Cl2的氧化性相近。在生活中被广泛应用于自来水消毒和果蔬保鲜等方面。某兴趣小组通过图装置(夹持装置略)对其制备、吸收、释放和应用进行了研究。_______ 。
(2)ClO2的吸收:关闭活塞B,向D中缓慢加入稀盐酸,ClO2在D中被稳定剂完全吸收生成NaClO2,在该反应过程中装置A、D均应控制反应温度低于30C,理由是_______ 。
(3)ClO2的释放:在酸性条件下NaClO2发生反应: ,完成ClO2的释放,则在该过程中氧化剂和还原剂的物质的量之比为
,完成ClO2的释放,则在该过程中氧化剂和还原剂的物质的量之比为_______ ,在ClO2释放实验中,打开活塞E,D中发生反应,说明有ClO2释放的实验现象是_______ 。
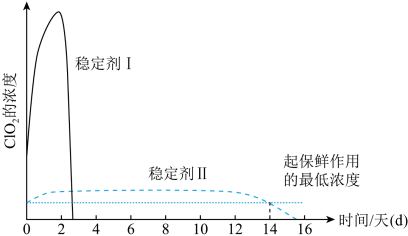
(4)ClO2的应用:己吸收ClO2气体的稳定剂I和稳定剂Ⅱ,加酸后释放ClO2的浓度随时间的变化情况如图所示,若将其用于水果保鲜,稳定剂Ⅱ优于稳定剂I,若稳定剂Ⅱ中ClO2气体的起始浓度为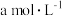 ,如图所示剩余
,如图所示剩余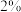 时便失去保鲜作用,则该稳定剂的平均失效速率为
时便失去保鲜作用,则该稳定剂的平均失效速率为_______ 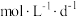 。
。
(2)ClO2的吸收:关闭活塞B,向D中缓慢加入稀盐酸,ClO2在D中被稳定剂完全吸收生成NaClO2,在该反应过程中装置A、D均应控制反应温度低于30C,理由是
(3)ClO2的释放:在酸性条件下NaClO2发生反应:
 ,完成ClO2的释放,则在该过程中氧化剂和还原剂的物质的量之比为
,完成ClO2的释放,则在该过程中氧化剂和还原剂的物质的量之比为(4)ClO2的应用:己吸收ClO2气体的稳定剂I和稳定剂Ⅱ,加酸后释放ClO2的浓度随时间的变化情况如图所示,若将其用于水果保鲜,稳定剂Ⅱ优于稳定剂I,若稳定剂Ⅱ中ClO2气体的起始浓度为
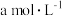 ,如图所示剩余
,如图所示剩余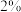 时便失去保鲜作用,则该稳定剂的平均失效速率为
时便失去保鲜作用,则该稳定剂的平均失效速率为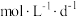 。
。
您最近一年使用:0次
5 . 如何降低大气中 的含量及有效地开发利用
的含量及有效地开发利用 引起了全世界的普遍重视。目前工业上有一种方法是用
引起了全世界的普遍重视。目前工业上有一种方法是用 来生产燃料甲醇。为探究该反应原理,进行如下实验:
来生产燃料甲醇。为探究该反应原理,进行如下实验:
在容积为1L的密闭容器中,充入 和
和 ,在
,在 下发生发应,
下发生发应, 实验测得
实验测得 和
和 的物质的量
的物质的量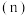 随时间变化如图1所示:
随时间变化如图1所示: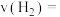
___________ ,H2转化率为___________ 。 达平衡时,
达平衡时, 的体积分数为
的体积分数为___________ ,图2是改变温度时化学反应速率随时间变化的示意图,则该反应的正反应为___________ 反应 填“放热”或“吸热”
填“放热”或“吸热” 。
。 该反应的平衡常数为
该反应的平衡常数为___________  保留两位小数
保留两位小数 ,若提高温度到
,若提高温度到 进行,达平衡时,K值
进行,达平衡时,K值___________  填“增大”“减小”或“不变”
填“增大”“减小”或“不变” 。
。
(3)下列措施中不能使 的转化率增大的是
的转化率增大的是___________ 。
A.在原容器中再充入1mol
B.在原容器中再充入
C.缩小容器的容积
D.使用更有效的催化剂
E.将水蒸气从体系中分离出
(4) 条件下,测得某时刻,
条件下,测得某时刻, 、
、 、
、 和
和 的浓度均为
的浓度均为 ,则此时
,则此时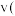 正
正
___________ 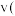 逆
逆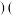 填“
填“ ”“
”“ ”或“
”或“ ”
”
(5)下列措施能使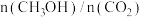 增大的是___________。
增大的是___________。
 的含量及有效地开发利用
的含量及有效地开发利用 引起了全世界的普遍重视。目前工业上有一种方法是用
引起了全世界的普遍重视。目前工业上有一种方法是用 来生产燃料甲醇。为探究该反应原理,进行如下实验:
来生产燃料甲醇。为探究该反应原理,进行如下实验:在容积为1L的密闭容器中,充入
 和
和 ,在
,在 下发生发应,
下发生发应, 实验测得
实验测得 和
和 的物质的量
的物质的量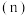 随时间变化如图1所示:
随时间变化如图1所示:
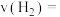
 达平衡时,
达平衡时, 的体积分数为
的体积分数为 填“放热”或“吸热”
填“放热”或“吸热” 。
。
 该反应的平衡常数为
该反应的平衡常数为 保留两位小数
保留两位小数 ,若提高温度到
,若提高温度到 进行,达平衡时,K值
进行,达平衡时,K值 填“增大”“减小”或“不变”
填“增大”“减小”或“不变” 。
。(3)下列措施中不能使
 的转化率增大的是
的转化率增大的是A.在原容器中再充入1mol

B.在原容器中再充入

C.缩小容器的容积
D.使用更有效的催化剂
E.将水蒸气从体系中分离出
(4)
 条件下,测得某时刻,
条件下,测得某时刻, 、
、 、
、 和
和 的浓度均为
的浓度均为 ,则此时
,则此时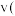 正
正
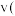 逆
逆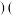 填“
填“ ”“
”“ ”或“
”或“ ”
”
(5)下列措施能使
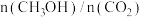 增大的是___________。
增大的是___________。| A.升高温度 | B.在原容器中充入1molHe |
| C.将水蒸气从体系中分离出 | D.缩小容器容积,增大压强 |
您最近一年使用:0次
6 . 请回答下列问题:
(1) 可发生二聚反应生成
可发生二聚反应生成  ,化学方程式为
,化学方程式为 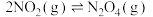 ,上述反应达到平衡后,升高温度可使体系颜色加深,则该反应的
,上述反应达到平衡后,升高温度可使体系颜色加深,则该反应的
___________ 0(填“>”或“<”)。已知该反应的正反应速率方程为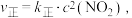 逆反应速率方程为
逆反应速率方程为 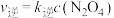 ,其中
,其中 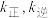 分别为正、逆反应的速率常数。则如图(
分别为正、逆反应的速率常数。则如图( 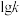 表示速率常数的对数;
表示速率常数的对数; 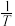 示温度的倒数)所示①、②、③、④四条斜线中,能表示
示温度的倒数)所示①、②、③、④四条斜线中,能表示 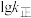 随
随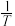 变化关系的是斜线
变化关系的是斜线___________ ,能表示 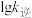 随
随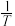 变化关系的是斜线
变化关系的是斜线___________ 。
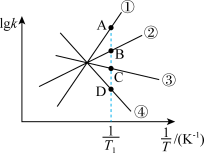
(2)图中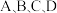 点的纵坐标分别为
点的纵坐标分别为 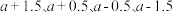 ,则温度
,则温度  时化学平衡常数K=
时化学平衡常数K=___________ mol/L。已知温度  时,某时刻恒容密闭容器中
时,某时刻恒容密闭容器中 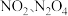 浓度均为
浓度均为 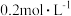 ,此时v正
,此时v正___________ v逆(填“>”“<”或“=”)。
(1)
 可发生二聚反应生成
可发生二聚反应生成  ,化学方程式为
,化学方程式为 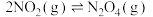 ,上述反应达到平衡后,升高温度可使体系颜色加深,则该反应的
,上述反应达到平衡后,升高温度可使体系颜色加深,则该反应的
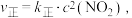 逆反应速率方程为
逆反应速率方程为 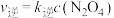 ,其中
,其中 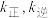 分别为正、逆反应的速率常数。则如图(
分别为正、逆反应的速率常数。则如图( 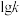 表示速率常数的对数;
表示速率常数的对数; 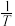 示温度的倒数)所示①、②、③、④四条斜线中,能表示
示温度的倒数)所示①、②、③、④四条斜线中,能表示 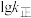 随
随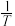 变化关系的是斜线
变化关系的是斜线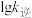 随
随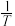 变化关系的是斜线
变化关系的是斜线
(2)图中
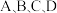 点的纵坐标分别为
点的纵坐标分别为 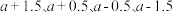 ,则温度
,则温度  时化学平衡常数K=
时化学平衡常数K= 时,某时刻恒容密闭容器中
时,某时刻恒容密闭容器中 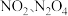 浓度均为
浓度均为 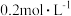 ,此时v正
,此时v正
您最近一年使用:0次
名校
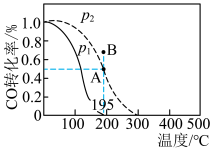
7 . 在20 L的密闭容器中按物质的量之比1∶2充入CO和H2,发生反应:
 。测得CO的转化率随温度的变化及不同压强下CO的变化如图所示,
。测得CO的转化率随温度的变化及不同压强下CO的变化如图所示, 和195℃时
和195℃时 随时间的变化结果如下表所示。下列说法错误的是
随时间的变化结果如下表所示。下列说法错误的是

 。测得CO的转化率随温度的变化及不同压强下CO的变化如图所示,
。测得CO的转化率随温度的变化及不同压强下CO的变化如图所示, 和195℃时
和195℃时 随时间的变化结果如下表所示。下列说法错误的是
随时间的变化结果如下表所示。下列说法错误的是| t/min | 0 | 1 | 3 | 5 |
 /mol /mol | 8 | 5 | 4 | 4 |
A. 和195℃时,0~3 min,反应速率 和195℃时,0~3 min,反应速率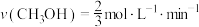 |
B.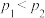 , , |
C.在 和195℃时,该反应的平衡常数为 和195℃时,该反应的平衡常数为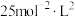 |
D. 和195℃时,在B点: 和195℃时,在B点: |
您最近一年使用:0次
名校
8 . 运用化学反应原理研究化学反应有重要意义。
(1)硫酸生产中,SO2催化氧化生成 :
: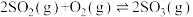 ,混合体系中
,混合体系中 的百分含量和温度的关系如图1所示(曲线上任何一点都表示平衡状态)。
的百分含量和温度的关系如图1所示(曲线上任何一点都表示平衡状态)。

①若在恒温、恒压条件下向上述平衡体系中通入氦气,平衡___________ (填“向左”“向右”或“不”)移动。
②若反应进行到状态D时,
___________ (填“>”“<”或“=”) 。
。
(2)课本里介绍的合成氨技术叫哈伯法: ,应用此法反应达到平衡时反应物的转化率不高。
,应用此法反应达到平衡时反应物的转化率不高。
①能使该反应的反应速率增大,且平衡向正反应方向移动的措施是___________ (填编号)。
A.使用更高效的催化剂 B.升高温度
C.减小体积 D.充入氮气,增大氮气的浓度(保持容器体积不变)
②若在某温度下,2L的密闭容器中发生合成氨的反应,图2表示N2的物质的量随时间的变化曲线。用H2表示 内该反应的平均速率
内该反应的平均速率
___________ 。从第 起,扩大容器的体积为4L,则
起,扩大容器的体积为4L,则 的变化曲线为
的变化曲线为___________ (填编号)。

(1)硫酸生产中,SO2催化氧化生成
 :
: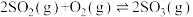 ,混合体系中
,混合体系中 的百分含量和温度的关系如图1所示(曲线上任何一点都表示平衡状态)。
的百分含量和温度的关系如图1所示(曲线上任何一点都表示平衡状态)。
①若在恒温、恒压条件下向上述平衡体系中通入氦气,平衡
②若反应进行到状态D时,

 。
。(2)课本里介绍的合成氨技术叫哈伯法:
 ,应用此法反应达到平衡时反应物的转化率不高。
,应用此法反应达到平衡时反应物的转化率不高。①能使该反应的反应速率增大,且平衡向正反应方向移动的措施是
A.使用更高效的催化剂 B.升高温度
C.减小体积 D.充入氮气,增大氮气的浓度(保持容器体积不变)
②若在某温度下,2L的密闭容器中发生合成氨的反应,图2表示N2的物质的量随时间的变化曲线。用H2表示
 内该反应的平均速率
内该反应的平均速率
 起,扩大容器的体积为4L,则
起,扩大容器的体积为4L,则 的变化曲线为
的变化曲线为
您最近一年使用:0次
名校
9 . 臭氧是理想的烟气脱硝试剂,可逆反应 在体积固定的密闭容器中进行,反应过程中测得
在体积固定的密闭容器中进行,反应过程中测得 的浓度随时间1的变化曲线如图所示,下列叙述错误的是
的浓度随时间1的变化曲线如图所示,下列叙述错误的是

 在体积固定的密闭容器中进行,反应过程中测得
在体积固定的密闭容器中进行,反应过程中测得 的浓度随时间1的变化曲线如图所示,下列叙述错误的是
的浓度随时间1的变化曲线如图所示,下列叙述错误的是
| A.a-c段反应速率加快的原因可能是反应放热 |
B.若向容器内充入一定体积的 ,化学反应速率加快 ,化学反应速率加快 |
| C.向反应体系中通入氢气,反应速率降低 |
| D.2~8min的化学反应速率v(NO2)=0.2mol·L-1·min-1 |
您最近一年使用:0次
名校
10 . 发展新能源、改善空气质量一直是化学研究的热点。回答下列问题:
(1)甲醇是可再生的清洁能源,可利用CO2与H2合成甲醇:
 ,该反应历程如图所示。合成甲醇过程中产生的有机副产物为
,该反应历程如图所示。合成甲醇过程中产生的有机副产物为
A. B.
B.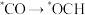
C. D.
D.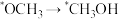
(2)焦炭与水蒸气在恒容密闭容器中反应可制合成气(CO和H2),主要反应Ⅰ、Ⅱ的
 (
( 为以分压表示的平衡常数)与T的关系如图所示。
为以分压表示的平衡常数)与T的关系如图所示。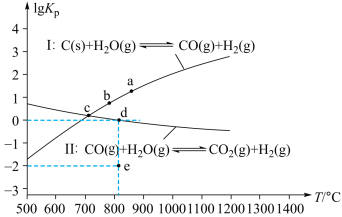
①反应Ⅰ的
②在容积为10 L的密闭容器中充入1 mol CO、1 mol H2O只发生反应Ⅱ,5 min时到达图2中的d点,则0~5 min内,用CO表示的反应速率为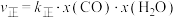 ,
,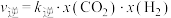 ,
, 、
、 分别为正、逆反应速率常数,x为物质的量分数,计算e点的
分别为正、逆反应速率常数,x为物质的量分数,计算e点的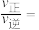
(3)c点时,若反应容器中CO的浓度为
 ,则CO2的浓度为
,则CO2的浓度为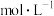 。
。
您最近一年使用:0次