1 . 一定条件下, 、
、 、
、 三种气体在某恒容密闭容器中发生反应,各气体的浓度随时间变化的曲线如图所示。
三种气体在某恒容密闭容器中发生反应,各气体的浓度随时间变化的曲线如图所示。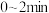 内该反应共吸收了
内该反应共吸收了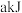 (
( )能量。下列说法不正确的是
)能量。下列说法不正确的是
 、
、 、
、 三种气体在某恒容密闭容器中发生反应,各气体的浓度随时间变化的曲线如图所示。
三种气体在某恒容密闭容器中发生反应,各气体的浓度随时间变化的曲线如图所示。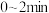 内该反应共吸收了
内该反应共吸收了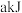 (
( )能量。下列说法不正确的是
)能量。下列说法不正确的是
A.达到平衡时, 的浓度不再变化 的浓度不再变化 |
B.反应的化学方程式为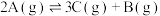 |
C.该条件下,达到平衡时, 的转化率为 的转化率为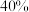 |
D.由图可知, 内, 内, 的反应速率为 的反应速率为 |
您最近一年使用:0次
2 . 在一定温度下,向一容积为5 L的恒容密闭容器中充入0.4 mol SO2和0.2 mol O2,发生反应:2SO2(g)+O2(g) 2SO3(g) ∆H = -196 kJ/mol。经2 min后达到平衡,当反应达到平衡时,容器内压强变为起始时的0.8倍。请回答下列问题:
2SO3(g) ∆H = -196 kJ/mol。经2 min后达到平衡,当反应达到平衡时,容器内压强变为起始时的0.8倍。请回答下列问题:
(1)判断该反应达到平衡状态的标志是___________ (填字母);
a.SO2、O2、SO3三者的浓度之比为2∶1∶2
b.容器内气体的压强不变
c.容器内混合气体的密度保持不变
d.SO3的物质的量不再变化
e.SO2的生成速率和SO3的生成速率相等
(2)从反应开始到平衡的这段时间O2的转化率为___________ ,用SO2的浓度变化表示的平均反应速率v(SO2)=___________ 。
(3)若反应温度降低,SO2的转化率___________ (填“增大”“减小”或“不变”);如图表示平衡时SO2的体积分数随压强和温度变化的曲线。则温度关系:T1___________ T2(填“>”“<”或“=”)。
 2SO3(g) ∆H = -196 kJ/mol。经2 min后达到平衡,当反应达到平衡时,容器内压强变为起始时的0.8倍。请回答下列问题:
2SO3(g) ∆H = -196 kJ/mol。经2 min后达到平衡,当反应达到平衡时,容器内压强变为起始时的0.8倍。请回答下列问题:(1)判断该反应达到平衡状态的标志是
a.SO2、O2、SO3三者的浓度之比为2∶1∶2
b.容器内气体的压强不变
c.容器内混合气体的密度保持不变
d.SO3的物质的量不再变化
e.SO2的生成速率和SO3的生成速率相等
(2)从反应开始到平衡的这段时间O2的转化率为
(3)若反应温度降低,SO2的转化率

您最近一年使用:0次
3 . 在 恒容密闭容器中加入一定量
恒容密闭容器中加入一定量 和
和 ,发生反应
,发生反应 ,
, 。绝热条件下容器中
。绝热条件下容器中 物质的量随时间的变化关系如表格所示。不同温度下平衡时
物质的量随时间的变化关系如表格所示。不同温度下平衡时 的体积分数与
的体积分数与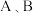 起始时的投料比的变化关系如图所示。则下列结论错误的是
起始时的投料比的变化关系如图所示。则下列结论错误的是

 恒容密闭容器中加入一定量
恒容密闭容器中加入一定量 和
和 ,发生反应
,发生反应 ,
, 。绝热条件下容器中
。绝热条件下容器中 物质的量随时间的变化关系如表格所示。不同温度下平衡时
物质的量随时间的变化关系如表格所示。不同温度下平衡时 的体积分数与
的体积分数与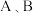 起始时的投料比的变化关系如图所示。则下列结论错误的是
起始时的投料比的变化关系如图所示。则下列结论错误的是
| 时间/min | 0 | 1 | 2 | 3 | 4 |
| n(A)/mol | 4.0 | 3.8 | 3.0 | 2.4 | 2.0 |
| n(B)/mol | 2.0 | 1.9 | 1.5 | 1.2 | 1.0 |
| n(C)/mol | 0 | 0.1 | 0.5 | 0.8 | 1.0 |
| A.随反应进行,正反应速率先增大后减小 |
B.图中 |
C.前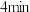 平均化学反应速率 平均化学反应速率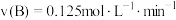 |
D.a、b、c三点 的转化率: 的转化率: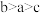 |
您最近一年使用:0次
名校
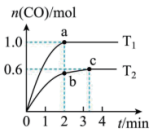
4 . 向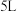 的恒容密闭容器中通入
的恒容密闭容器中通入 和
和 各
各 ,发生反应:
,发生反应: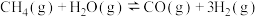 。在不同温度下测得
。在不同温度下测得 随时间变化的曲线如图所示。下列说法正确的是
随时间变化的曲线如图所示。下列说法正确的是
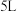 的恒容密闭容器中通入
的恒容密闭容器中通入 和
和 各
各 ,发生反应:
,发生反应: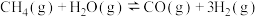 。在不同温度下测得
。在不同温度下测得 随时间变化的曲线如图所示。下列说法正确的是
随时间变化的曲线如图所示。下列说法正确的是
| A.该反应在任意温度下均可自发进行 |
B. 温度下, 温度下, 的平衡转化率是30% 的平衡转化率是30% |
C. 、 、 两点平衡常数: 两点平衡常数: |
D. 温度下,0到 温度下,0到 内,用 内,用 表示的平均反应速率为0.1mol·L-1·min-1 表示的平均反应速率为0.1mol·L-1·min-1 |
您最近一年使用:0次
5 . 接触法制硫酸工艺中,其主反应在450℃左右并有催化剂存在下进行: 。
。
(1)该反应的平衡常数表达式K=_______ ,该反应450℃时的平衡常数_______ 500℃时的平衡常数(填“>”或“<”或“=”)。
(2)下列描述能说明上述反应(反应容器体积不变)已达平衡的是_______ 。
a.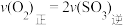
b.容器中气体的平均相对分子质量不随时间而变化
c.容器中气体的密度不随时间而变化
d.容器中气体的分子总数不随时间而变化
(3)在一个固定容积为5L的密闭容器中充入 SO2和
SO2和 O2,半分钟后达到平衡,测得容器中含0.18molSO3,则v(O2)=
O2,半分钟后达到平衡,测得容器中含0.18molSO3,则v(O2)=_______ mol/(L∙min):如果要提高SO2转化率,可以采取哪些措施?请写出两种方法_______ 、_______ 。
 。
。(1)该反应的平衡常数表达式K=
(2)下列描述能说明上述反应(反应容器体积不变)已达平衡的是
a.
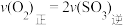
b.容器中气体的平均相对分子质量不随时间而变化
c.容器中气体的密度不随时间而变化
d.容器中气体的分子总数不随时间而变化
(3)在一个固定容积为5L的密闭容器中充入
 SO2和
SO2和 O2,半分钟后达到平衡,测得容器中含0.18molSO3,则v(O2)=
O2,半分钟后达到平衡,测得容器中含0.18molSO3,则v(O2)=
您最近一年使用:0次
6 . 科研、生产中常涉及碳的化合物。回答下列问题:
(1) 时,向容积为
时,向容积为 的恒容密闭容器中充入一定量的
的恒容密闭容器中充入一定量的 和
和 ,发生反应:
,发生反应: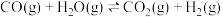 ,反应过程中测定的部分数据见下表:
,反应过程中测定的部分数据见下表:
①反应前 内的平均反应速率
内的平均反应速率
_________ ;表中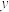 的值为
的值为___________ 。
②判定 时达到平衡状态的理由是
时达到平衡状态的理由是___________ 。
(2)工业上可利用煤的气化产物(水煤气)合成二甲醚: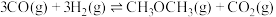
 。一定条件下的密闭容器中,该反应达到平衡,要提高
。一定条件下的密闭容器中,该反应达到平衡,要提高 的转化率,可以采取的措施是___________(填字母)。
的转化率,可以采取的措施是___________(填字母)。
(3)高炉炼铁中发生的主要反应为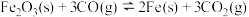 。已知该反应平衡常数随温度变化如图所示,该反应平衡常数表达式
。已知该反应平衡常数随温度变化如图所示,该反应平衡常数表达式
___________ ,
___________ 0(填“>”“<”或“=”)。

(4) 和
和 通入聚焦太阳能反应器中,发生反应:
通入聚焦太阳能反应器中,发生反应:
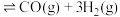 ,将等物质的量的
,将等物质的量的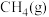 和
和 充入
充入 恒容密闭反应器中,某温度下反应达到平衡,平衡常数
恒容密闭反应器中,某温度下反应达到平衡,平衡常数 ,此时测得
,此时测得 ,则
,则 的平衡转化率为
的平衡转化率为___________ (保留两位有效数字)。
(1)
 时,向容积为
时,向容积为 的恒容密闭容器中充入一定量的
的恒容密闭容器中充入一定量的 和
和 ,发生反应:
,发生反应: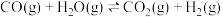 ,反应过程中测定的部分数据见下表:
,反应过程中测定的部分数据见下表:反应时间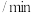 | 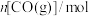 |  |
| 0 | 1.8 | 0.9 |
| 2 | 1.2 |  |
| 4 | 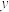 | 0.3 |
 内的平均反应速率
内的平均反应速率
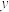 的值为
的值为②判定
 时达到平衡状态的理由是
时达到平衡状态的理由是(2)工业上可利用煤的气化产物(水煤气)合成二甲醚:
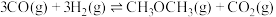
 。一定条件下的密闭容器中,该反应达到平衡,要提高
。一定条件下的密闭容器中,该反应达到平衡,要提高 的转化率,可以采取的措施是___________(填字母)。
的转化率,可以采取的措施是___________(填字母)。| A.升高温度 | B.加入催化剂 |
C.减小 的浓度 的浓度 | D.增大压强(缩小容器体积) |
(3)高炉炼铁中发生的主要反应为
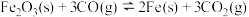 。已知该反应平衡常数随温度变化如图所示,该反应平衡常数表达式
。已知该反应平衡常数随温度变化如图所示,该反应平衡常数表达式


(4)
 和
和 通入聚焦太阳能反应器中,发生反应:
通入聚焦太阳能反应器中,发生反应:
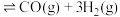 ,将等物质的量的
,将等物质的量的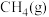 和
和 充入
充入 恒容密闭反应器中,某温度下反应达到平衡,平衡常数
恒容密闭反应器中,某温度下反应达到平衡,平衡常数 ,此时测得
,此时测得 ,则
,则 的平衡转化率为
的平衡转化率为
您最近一年使用:0次
2024-02-07更新
|
34次组卷
|
2卷引用:广西北海市2023-2024学年高二上学期期末考试化学试题
名校
解题方法
7 . 对反应A+3B⇌2C来说,下列反应速率中最快的是
| A.υ(B)=0.9 mol/(L•min) | B.υ(B)=0.6 mol/(L•min) |
| C.υ(C)=0.5 mol/(L•min) | D.υ(A)=0.5 mol/(L•min) |
您最近一年使用:0次
解题方法
8 . 某研究性学习小组利用 溶液和酸性
溶液和酸性 溶液的反应进行了一系列探究外界条件的改变对化学反应速率的影响实验,相关实验如下:
溶液的反应进行了一系列探究外界条件的改变对化学反应速率的影响实验,相关实验如下:
(1)实验中发生的化学反应的离子方程式为___________ 。
(2)通过实验1、4,可探究___________ (填外部因素)对化学反应速率的影响。通过实验3、5,可探究温度对化学反应速率的影响,则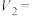
___________ ,
___________ ;实验得出
___________ (填“>”、“=”或“<”) 。
。
(3)0~5min内,实验2中高锰酸钾的平均反应速率为___________  。进行实验4时发现溶液几乎没有褪色,原因可能是
。进行实验4时发现溶液几乎没有褪色,原因可能是___________ 。
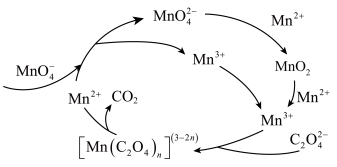
(4)甲同学在实验1、2、3中观察到 溶液褪色速率开始时较慢,反应一段时间后逐渐加快。查阅资料获悉:
溶液褪色速率开始时较慢,反应一段时间后逐渐加快。查阅资料获悉:
ⅰ. 与酸性
与酸性 溶液反应的一种机理如图所示:
溶液反应的一种机理如图所示:
ⅱ. 在溶液中呈紫红色,能发生反应
在溶液中呈紫红色,能发生反应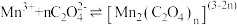 ,
,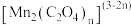 通常呈青绿色;
通常呈青绿色; 呈绿色,在酸性条件下不稳定,迅速分解产生
呈绿色,在酸性条件下不稳定,迅速分解产生 和
和 。
。
①仅由图示机理分析,反应一段时间后溶液褪色速率突然加快的原因可能为___________ 。
②乙同学将实验1中溶液pH调至1时再次做实验,发现溶液紫色并未直接褪去,而是先变为青色溶液,一段时间后青色溶液逐渐褪至无色。乙同学结合上述信息,推测紫色溶液变为青色溶液时,青色溶液中可能含有 。指导老师否定了该猜想,理由是
。指导老师否定了该猜想,理由是___________ 。
 溶液和酸性
溶液和酸性 溶液的反应进行了一系列探究外界条件的改变对化学反应速率的影响实验,相关实验如下:
溶液的反应进行了一系列探究外界条件的改变对化学反应速率的影响实验,相关实验如下:| 实验编号 | 实验温度/℃ | 试管中所加试剂及其用量/mL | 溶液颜色褪至无色所需时间/min | |||
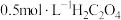 溶液 溶液 |  | 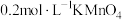 溶液 溶液 | 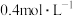 稀硫酸 稀硫酸 | |||
| 1 | 25 | 3.0 | 3.0 | 2.0 | 2.0 | 6.4 |
| 2 | 25 | 4.0 | 2.0 |  | 2.0 | 5.0 |
| 3 | 25 | 5.0 | 1.0 | 2.0 |  |  |
| 4 | 25 | 1.5 | 4.5 | 2.0 | 2.0 |  |
| 5 | 50 | 5.0 | 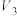 | 2.0 | 2.0 | 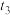 |
(1)实验中发生的化学反应的离子方程式为
(2)通过实验1、4,可探究
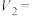


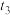 。
。(3)0~5min内,实验2中高锰酸钾的平均反应速率为
 。进行实验4时发现溶液几乎没有褪色,原因可能是
。进行实验4时发现溶液几乎没有褪色,原因可能是(4)甲同学在实验1、2、3中观察到
 溶液褪色速率开始时较慢,反应一段时间后逐渐加快。查阅资料获悉:
溶液褪色速率开始时较慢,反应一段时间后逐渐加快。查阅资料获悉:ⅰ.
 与酸性
与酸性 溶液反应的一种机理如图所示:
溶液反应的一种机理如图所示:
ⅱ.
 在溶液中呈紫红色,能发生反应
在溶液中呈紫红色,能发生反应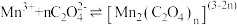 ,
,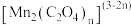 通常呈青绿色;
通常呈青绿色; 呈绿色,在酸性条件下不稳定,迅速分解产生
呈绿色,在酸性条件下不稳定,迅速分解产生 和
和 。
。①仅由图示机理分析,反应一段时间后溶液褪色速率突然加快的原因可能为
②乙同学将实验1中溶液pH调至1时再次做实验,发现溶液紫色并未直接褪去,而是先变为青色溶液,一段时间后青色溶液逐渐褪至无色。乙同学结合上述信息,推测紫色溶液变为青色溶液时,青色溶液中可能含有
 。指导老师否定了该猜想,理由是
。指导老师否定了该猜想,理由是
您最近一年使用:0次
2023-11-22更新
|
84次组卷
|
3卷引用:广西贵港市部分学校2023-2024学年高二上学期期中联考化学试题
名校
解题方法
9 . 三氧化钼(MoO3)是石油工业中常用的催化剂,也是瓷轴药的颜料,该物质常使用辉钼矿(主要成分为MoS3)通过一定条件来制备。回答下列相关问题:
(1)已知:①MoS2(s) Mo(s)+S2(g) △H1
Mo(s)+S2(g) △H1
②S2(g)+2O2(g) 2SO2(g) △H2
2SO2(g) △H2
③2Mo(s)+3O2(g) 2MoO3(s) △H3
2MoO3(s) △H3
则2MoS2+7O2(g) 2MoO3(s)+4SO2(g)的△H=
2MoO3(s)+4SO2(g)的△H=_______ (用含△H1、△H2、△H3的代数式表示)。
(2)若在恒温恒容条件下,仅发生反应MoS2(s) Mo(s)+S2(g)。
Mo(s)+S2(g)。
①下列说法正确的是_______ (填序号)。
a.气体的密度不变,则反应一定达到了平衡状态
b.气体的相对分子质量不变,反应不一定处于平衡状态
c.增加MoS2的量,平衡正向移动
②达到平衡时S2(g)的浓度为1.4mol•L-1,充入一定量的S2(g),反应再次达到平衡,S2(g)浓度_______ (填“>”“<”或“=”)1.4mol•L-1。
(3)在2L恒容密闭容器中充入1.0molS2(g)和1.5molO2(g),若仅发生反应;S2(g)+2O2(g) 2SO2(g),5min后反应达到平衡,此时容器压强为起始时的80%,则0~5min内,S2(g)的反应速率为
2SO2(g),5min后反应达到平衡,此时容器压强为起始时的80%,则0~5min内,S2(g)的反应速率为_______ mol•L-1•min-1。
(4)在恒容密闭容器中,加入足量的MoS2和O2,仅发生反应:2MoS2+7O2(g) 2MoO3(s)+4SO2(g) △H。测得氧气的平衡转化率与起始压强、温度的关系如图所示。
2MoO3(s)+4SO2(g) △H。测得氧气的平衡转化率与起始压强、温度的关系如图所示。

①比较p1、p2、p3的大小:_______ 。
②若在p2为7.0kPa下,初始通入7.0molO2,则A点平衡常数Kp=________ 。(用气体平衡分压代替气体平衡浓度计算,分压=总压×气体的物质的量分数,写出计算式即可)。
(1)已知:①MoS2(s)
 Mo(s)+S2(g) △H1
Mo(s)+S2(g) △H1②S2(g)+2O2(g)
 2SO2(g) △H2
2SO2(g) △H2③2Mo(s)+3O2(g)
 2MoO3(s) △H3
2MoO3(s) △H3则2MoS2+7O2(g)
 2MoO3(s)+4SO2(g)的△H=
2MoO3(s)+4SO2(g)的△H=(2)若在恒温恒容条件下,仅发生反应MoS2(s)
 Mo(s)+S2(g)。
Mo(s)+S2(g)。①下列说法正确的是
a.气体的密度不变,则反应一定达到了平衡状态
b.气体的相对分子质量不变,反应不一定处于平衡状态
c.增加MoS2的量,平衡正向移动
②达到平衡时S2(g)的浓度为1.4mol•L-1,充入一定量的S2(g),反应再次达到平衡,S2(g)浓度
(3)在2L恒容密闭容器中充入1.0molS2(g)和1.5molO2(g),若仅发生反应;S2(g)+2O2(g)
 2SO2(g),5min后反应达到平衡,此时容器压强为起始时的80%,则0~5min内,S2(g)的反应速率为
2SO2(g),5min后反应达到平衡,此时容器压强为起始时的80%,则0~5min内,S2(g)的反应速率为(4)在恒容密闭容器中,加入足量的MoS2和O2,仅发生反应:2MoS2+7O2(g)
 2MoO3(s)+4SO2(g) △H。测得氧气的平衡转化率与起始压强、温度的关系如图所示。
2MoO3(s)+4SO2(g) △H。测得氧气的平衡转化率与起始压强、温度的关系如图所示。
①比较p1、p2、p3的大小:
②若在p2为7.0kPa下,初始通入7.0molO2,则A点平衡常数Kp=
您最近一年使用:0次
名校
解题方法
10 . 已知下列热化学方程式:回答下列问题:
H2(g)+ O2(g)=H2O(l) △H=-285.8kJ•mol-1
O2(g)=H2O(l) △H=-285.8kJ•mol-1
C(s)+ O2(g)=CO(g) △H=-110.5kJ•mol-1
O2(g)=CO(g) △H=-110.5kJ•mol-1
H2(g)+ O2(g)=H2O(g) △H=-241.8kJ•mol-1
O2(g)=H2O(g) △H=-241.8kJ•mol-1
C(s)+O2(g)=CO2(g) △H=-393.5kJ•mol-1
(1)H2的燃烧热△H=________ ;C的燃烧热为________ 。
(2)用CO2制备CH3OH可实现CO2的能源化利用,反应如下:CO2+3H2 CH3OH+H2O。温度为250℃时,测得上述反应中生成8.0gCH3OH(g)放出的热量为12.3kJ,反应的热化学方程式为
CH3OH+H2O。温度为250℃时,测得上述反应中生成8.0gCH3OH(g)放出的热量为12.3kJ,反应的热化学方程式为_______ 。
(3)某温度下,在一个1L的密闭容器中,X、Y、Z三种物质的物质的量随时间的变化曲线如图所示。根据图中数据,填写下列空白:
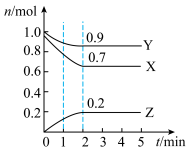
①从开始至2min,X的平均反应速率为_______ 。
②该反应的化学方程式为________ 。
③1min时,正逆反应速率的大小关系为:v(正)________ v(逆)(填“>”或“<”或“=”)。
④若X、Y、Z均为气体,在2min时,向容器中通入氩气,增大体系压强,X的化学反应速率将________ (填“变大”或、“不变”或“变小”)。
⑤10s后的某一时刻(t1)改变了外界条件,其速率随时间的变化图像如图所示。则下列说法符合该图像的是_______ 。
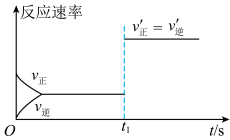
A.t1时刻,增大了X的浓度 B.t1时刻,缩小了容器体积
C.t1时刻,升高了体系温度 D.t1时刻,使用了催化剂
H2(g)+
 O2(g)=H2O(l) △H=-285.8kJ•mol-1
O2(g)=H2O(l) △H=-285.8kJ•mol-1C(s)+
 O2(g)=CO(g) △H=-110.5kJ•mol-1
O2(g)=CO(g) △H=-110.5kJ•mol-1H2(g)+
 O2(g)=H2O(g) △H=-241.8kJ•mol-1
O2(g)=H2O(g) △H=-241.8kJ•mol-1C(s)+O2(g)=CO2(g) △H=-393.5kJ•mol-1
(1)H2的燃烧热△H=
(2)用CO2制备CH3OH可实现CO2的能源化利用,反应如下:CO2+3H2
 CH3OH+H2O。温度为250℃时,测得上述反应中生成8.0gCH3OH(g)放出的热量为12.3kJ,反应的热化学方程式为
CH3OH+H2O。温度为250℃时,测得上述反应中生成8.0gCH3OH(g)放出的热量为12.3kJ,反应的热化学方程式为(3)某温度下,在一个1L的密闭容器中,X、Y、Z三种物质的物质的量随时间的变化曲线如图所示。根据图中数据,填写下列空白:

①从开始至2min,X的平均反应速率为
②该反应的化学方程式为
③1min时,正逆反应速率的大小关系为:v(正)
④若X、Y、Z均为气体,在2min时,向容器中通入氩气,增大体系压强,X的化学反应速率将
⑤10s后的某一时刻(t1)改变了外界条件,其速率随时间的变化图像如图所示。则下列说法符合该图像的是

A.t1时刻,增大了X的浓度 B.t1时刻,缩小了容器体积
C.t1时刻,升高了体系温度 D.t1时刻,使用了催化剂
您最近一年使用:0次



