解题方法
1 . 已知橙红色的配离子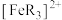 可被
可被 氧化成淡蓝色的配离子
氧化成淡蓝色的配离子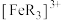 (
( 的还原产物是
的还原产物是 ),现用浓度分别为
),现用浓度分别为 、
、 、
、 的
的 溶液进行实验,
溶液进行实验,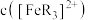 随时间
随时间 的变化曲线如图所示。下列有关说法错误的是
的变化曲线如图所示。下列有关说法错误的是
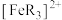 可被
可被 氧化成淡蓝色的配离子
氧化成淡蓝色的配离子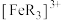 (
( 的还原产物是
的还原产物是 ),现用浓度分别为
),现用浓度分别为 、
、 、
、 的
的 溶液进行实验,
溶液进行实验,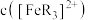 随时间
随时间 的变化曲线如图所示。下列有关说法错误的是
的变化曲线如图所示。下列有关说法错误的是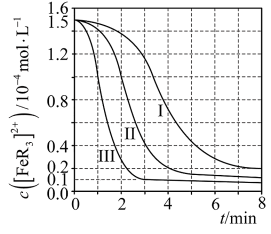
A.实验中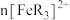 、 、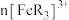 之和不变时,反应达到平衡状态 之和不变时,反应达到平衡状态 |
| B.三组实验中,反应速率都是前期速率增加,后期速率减小 |
C. 的硝酸进行实验,平衡时 的硝酸进行实验,平衡时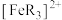 的平均消耗速率为 的平均消耗速率为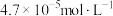 |
D.平衡后加水稀释, 增大 增大 |
您最近一年使用:0次
解题方法
2 . 船舶柴油机发动机工作时,反应产生的 尾气是空气主要污染物之一,研究
尾气是空气主要污染物之一,研究 的转化方法和机理具有重要意义。
的转化方法和机理具有重要意义。
已知: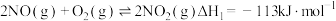 ;
; ;
;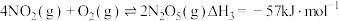
(1) 氧化脱除
氧化脱除 的总反应是
的总反应是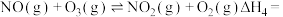
_______ 。
(2)该反应过程有两步: ,反应中各物质浓度变化如图所示。则速率常数
,反应中各物质浓度变化如图所示。则速率常数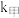
_______  (填“
(填“ ”、“
”、“ ”或“
”或“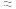 ”),原因是
”),原因是 _______ 。  的反应历程分两步:
的反应历程分两步:
①则反应Ⅰ与反应Ⅱ的活化能:
_______ 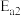 (填“
(填“ ”“
”“ ”或“
”或“ ”)。反应
”)。反应 的平衡常数
的平衡常数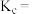
_______ (用 、
、 、
、 、
、 表示)。
表示)。
②在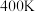 、初始压强为
、初始压强为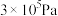 的恒温刚性容器(体积为VL)中,按
的恒温刚性容器(体积为VL)中,按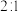 通入
通入 和
和 一定条件下发生反应。达平衡时
一定条件下发生反应。达平衡时 转化率为
转化率为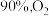 转化率为
转化率为
____________ 。
(4)某研究小组将 、
、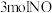 和一定量的
和一定量的 充入
充入 密闭容器中,在
密闭容器中,在 催化剂表面发生反应
催化剂表面发生反应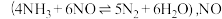 的转化率随温度的变化情况如图所示:
的转化率随温度的变化情况如图所示: 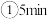 内温度从
内温度从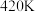 升高到
升高到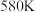 ,此时段内
,此时段内 的平均反应速率
的平均反应速率
_______ (保留 位有效数字)。
位有效数字)。
②无氧条件下, 生成
生成 的转化率较低,原因可能是
的转化率较低,原因可能是 _______ 。
 尾气是空气主要污染物之一,研究
尾气是空气主要污染物之一,研究 的转化方法和机理具有重要意义。
的转化方法和机理具有重要意义。 已知:
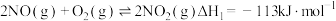 ;
; ;
;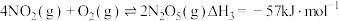
(1)
 氧化脱除
氧化脱除 的总反应是
的总反应是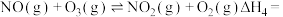
(2)该反应过程有两步:
 ,反应中各物质浓度变化如图所示。则速率常数
,反应中各物质浓度变化如图所示。则速率常数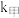
 (填“
(填“ ”、“
”、“ ”或“
”或“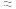 ”),原因是
”),原因是 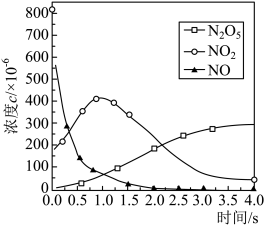
 的反应历程分两步:
的反应历程分两步: | 步骤 | 反应 | 活化能 | 正反应速率方程 | 逆反应速率方程 |
| Ⅰ |  (快) (快) |  | 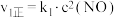 | 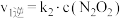 |
| Ⅱ | 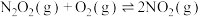 (慢) | 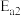 | 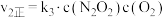 |  |

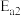 (填“
(填“ ”“
”“ ”或“
”或“ ”)。反应
”)。反应 的平衡常数
的平衡常数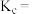
 、
、 、
、 、
、 表示)。
表示)。 ②在
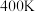 、初始压强为
、初始压强为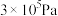 的恒温刚性容器(体积为VL)中,按
的恒温刚性容器(体积为VL)中,按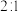 通入
通入 和
和 一定条件下发生反应。达平衡时
一定条件下发生反应。达平衡时 转化率为
转化率为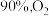 转化率为
转化率为
(4)某研究小组将
 、
、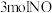 和一定量的
和一定量的 充入
充入 密闭容器中,在
密闭容器中,在 催化剂表面发生反应
催化剂表面发生反应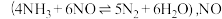 的转化率随温度的变化情况如图所示:
的转化率随温度的变化情况如图所示: 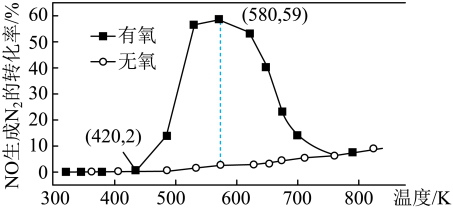
 内温度从
内温度从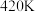 升高到
升高到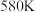 ,此时段内
,此时段内 的平均反应速率
的平均反应速率
 位有效数字)。
位有效数字)。 ②无氧条件下,
 生成
生成 的转化率较低,原因可能是
的转化率较低,原因可能是
您最近一年使用:0次
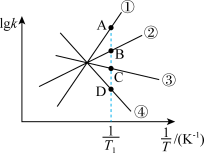
3 . 请回答下列问题:
(1) 可发生二聚反应生成
可发生二聚反应生成  ,化学方程式为
,化学方程式为 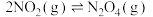 ,上述反应达到平衡后,升高温度可使体系颜色加深,则该反应的
,上述反应达到平衡后,升高温度可使体系颜色加深,则该反应的
___________ 0(填“>”或“<”)。已知该反应的正反应速率方程为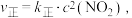 逆反应速率方程为
逆反应速率方程为 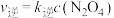 ,其中
,其中 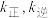 分别为正、逆反应的速率常数。则如图(
分别为正、逆反应的速率常数。则如图( 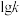 表示速率常数的对数;
表示速率常数的对数; 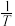 示温度的倒数)所示①、②、③、④四条斜线中,能表示
示温度的倒数)所示①、②、③、④四条斜线中,能表示 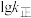 随
随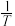 变化关系的是斜线
变化关系的是斜线___________ ,能表示 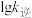 随
随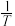 变化关系的是斜线
变化关系的是斜线___________ 。
(2)图中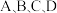 点的纵坐标分别为
点的纵坐标分别为 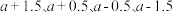 ,则温度
,则温度  时化学平衡常数K=
时化学平衡常数K=___________ mol/L。已知温度  时,某时刻恒容密闭容器中
时,某时刻恒容密闭容器中 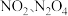 浓度均为
浓度均为 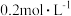 ,此时v正
,此时v正___________ v逆(填“>”“<”或“=”)。
(1)
 可发生二聚反应生成
可发生二聚反应生成  ,化学方程式为
,化学方程式为 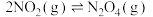 ,上述反应达到平衡后,升高温度可使体系颜色加深,则该反应的
,上述反应达到平衡后,升高温度可使体系颜色加深,则该反应的
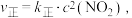 逆反应速率方程为
逆反应速率方程为 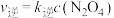 ,其中
,其中 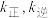 分别为正、逆反应的速率常数。则如图(
分别为正、逆反应的速率常数。则如图( 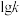 表示速率常数的对数;
表示速率常数的对数; 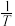 示温度的倒数)所示①、②、③、④四条斜线中,能表示
示温度的倒数)所示①、②、③、④四条斜线中,能表示 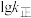 随
随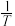 变化关系的是斜线
变化关系的是斜线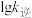 随
随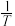 变化关系的是斜线
变化关系的是斜线
(2)图中
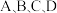 点的纵坐标分别为
点的纵坐标分别为 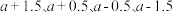 ,则温度
,则温度  时化学平衡常数K=
时化学平衡常数K= 时,某时刻恒容密闭容器中
时,某时刻恒容密闭容器中 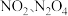 浓度均为
浓度均为 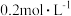 ,此时v正
,此时v正
您最近一年使用:0次
名校
4 . Ⅰ. 甲醇是重要的化工原料,发展前景广阔。
温度为T1时,向容积为2L的密闭容器甲、乙中分别充入一定量的CO和H2O(g),发生反应:CO(g) + H2O(g)⇌CO2(g) + H2(g)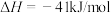 。相关数据如下:
。相关数据如下:
(1)甲容器中,反应在t1 min 内的平均速率v(H2)= ___________ mol/(L·min)。
(2)甲容器中,平衡时,反应放出的热量___________ kJ。
(3)T1时,反应的平衡常数K甲=___________ 。
(4)乙容器中,a=___________ mol。
II.已知:①N2(g)+O2(g) ⇌2NO(g) △H1=+180kJ mol-1
mol-1
②C(s)+O2(g)=CO2(g) △H2=-393kJ mol-1
mol-1
③2C(s)+O2(g)=2CO(g) △H3=-221kJ mol-1
mol-1
(5)若某反应的平衡常数表达式为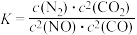 ,请写出此反应的热化学方程式:
,请写出此反应的热化学方程式:___________ 。
(6)欲研究在某催化剂作用下2CO(g)+2NO(g)⇌N2(g)+2CO2(g)的反应速率与温度的关系,在其他条件相同时,改变反应温度,测得经过相同时间时该反应的正反应速率如下图所示,A、B两点对应温度下正反应速率变化的原因可能是___________ ,A、B两点对应温度下该反应的活化能Ea(A)___________ Ea(B)(填“>”或“<”)。 为相对压力平衡常数,其表达式写法:在浓度平衡常数表达式中,用相对分压代替浓度。气体的相对分压等于其分压(单位为kPa)除以p0(p0=100kPa)。在某温度下,原料组成n(CO):n(NO)=1:1,初始总压为100kPa的恒容密闭容器中进行上述反应,体系达到平衡时N2的分压为20kPa,则该反应的相对压力平衡常数
为相对压力平衡常数,其表达式写法:在浓度平衡常数表达式中,用相对分压代替浓度。气体的相对分压等于其分压(单位为kPa)除以p0(p0=100kPa)。在某温度下,原料组成n(CO):n(NO)=1:1,初始总压为100kPa的恒容密闭容器中进行上述反应,体系达到平衡时N2的分压为20kPa,则该反应的相对压力平衡常数 =
=___________ 。
(8)用NH3可以消除NO污染:4NH3(g)+6NO(g)⇌5N2(g)+6H2O(1),该反应速率v正=k正 c4(NH3)
c4(NH3) c6(NO),v逆=K逆
c6(NO),v逆=K逆 c5(N2),若将9molNH3和11molNO投入真空容器中恒温恒容(温度298K、体积为10L)进行反应,已知该条件下k正=6.4×102(mol/L)-9
c5(N2),若将9molNH3和11molNO投入真空容器中恒温恒容(温度298K、体积为10L)进行反应,已知该条件下k正=6.4×102(mol/L)-9 s-1,当平衡时NH3转化率为
s-1,当平衡时NH3转化率为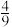 ,v逆=
,v逆=___________ mol L-1
L-1 s-1。
s-1。
温度为T1时,向容积为2L的密闭容器甲、乙中分别充入一定量的CO和H2O(g),发生反应:CO(g) + H2O(g)⇌CO2(g) + H2(g)
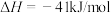 。相关数据如下:
。相关数据如下:| 容器 | 甲 | 乙 | ||
| 反应物 | CO | H2O | CO | H2O |
| 起始时物质的量(mol) | 1.2 | 0.6 | 2.4 | 1.2 |
| 平衡时物质的量(mol) | 0.8 | 0.2 | a | b |
| 达到平衡的时间(min) | t1 | t2 | ||
(2)甲容器中,平衡时,反应放出的热量
(3)T1时,反应的平衡常数K甲=
(4)乙容器中,a=
II.已知:①N2(g)+O2(g) ⇌2NO(g) △H1=+180kJ
 mol-1
mol-1②C(s)+O2(g)=CO2(g) △H2=-393kJ
 mol-1
mol-1③2C(s)+O2(g)=2CO(g) △H3=-221kJ
 mol-1
mol-1(5)若某反应的平衡常数表达式为
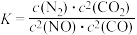 ,请写出此反应的热化学方程式:
,请写出此反应的热化学方程式:(6)欲研究在某催化剂作用下2CO(g)+2NO(g)⇌N2(g)+2CO2(g)的反应速率与温度的关系,在其他条件相同时,改变反应温度,测得经过相同时间时该反应的正反应速率如下图所示,A、B两点对应温度下正反应速率变化的原因可能是
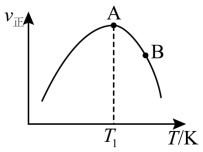
 为相对压力平衡常数,其表达式写法:在浓度平衡常数表达式中,用相对分压代替浓度。气体的相对分压等于其分压(单位为kPa)除以p0(p0=100kPa)。在某温度下,原料组成n(CO):n(NO)=1:1,初始总压为100kPa的恒容密闭容器中进行上述反应,体系达到平衡时N2的分压为20kPa,则该反应的相对压力平衡常数
为相对压力平衡常数,其表达式写法:在浓度平衡常数表达式中,用相对分压代替浓度。气体的相对分压等于其分压(单位为kPa)除以p0(p0=100kPa)。在某温度下,原料组成n(CO):n(NO)=1:1,初始总压为100kPa的恒容密闭容器中进行上述反应,体系达到平衡时N2的分压为20kPa,则该反应的相对压力平衡常数 =
=(8)用NH3可以消除NO污染:4NH3(g)+6NO(g)⇌5N2(g)+6H2O(1),该反应速率v正=k正
 c4(NH3)
c4(NH3) c6(NO),v逆=K逆
c6(NO),v逆=K逆 c5(N2),若将9molNH3和11molNO投入真空容器中恒温恒容(温度298K、体积为10L)进行反应,已知该条件下k正=6.4×102(mol/L)-9
c5(N2),若将9molNH3和11molNO投入真空容器中恒温恒容(温度298K、体积为10L)进行反应,已知该条件下k正=6.4×102(mol/L)-9 s-1,当平衡时NH3转化率为
s-1,当平衡时NH3转化率为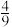 ,v逆=
,v逆= L-1
L-1 s-1。
s-1。
您最近一年使用:0次
名校
解题方法
5 . 在恒温恒压下,向密闭容器中充入4mol  和2mol
和2mol  ,发生如下反应:
,发生如下反应: △H<0,2min后,反应达到平衡,生成
△H<0,2min后,反应达到平衡,生成 为1.4mol,同时放出热量Q kJ。则下列分析正确的是
为1.4mol,同时放出热量Q kJ。则下列分析正确的是
 和2mol
和2mol  ,发生如下反应:
,发生如下反应: △H<0,2min后,反应达到平衡,生成
△H<0,2min后,反应达到平衡,生成 为1.4mol,同时放出热量Q kJ。则下列分析正确的是
为1.4mol,同时放出热量Q kJ。则下列分析正确的是A.若反应开始时容器体积为2L,则 |
B.若把条件“恒温恒压”改为“恒压恒容”,则平衡后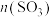 大于1.4mol 大于1.4mol |
C.2min后,向容器中再通入一定量的 气体,重新达到平衡时 气体,重新达到平衡时 的含量变小 的含量变小 |
| D.若把条件“恒温恒压”改为“恒温恒容”,则平衡时放出热量小于Q kJ |
您最近一年使用:0次
名校
解题方法
6 . 控制、治理氮氧化物对大气的污染是改善大气质量的证要方面。
(1)火力发电厂的燃煤排烟中含大量的氮氧化物( ),可利用甲烷和
),可利用甲烷和 在一条件下反应消除其污染,那么
在一条件下反应消除其污染,那么 与
与 反应的化学方程式为
反应的化学方程式为___________ 。
(2)在一密闭容器中发生反应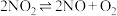 ,反应过程中
,反应过程中 的浓度随时间变化的情况如以下图所示。请回答:
的浓度随时间变化的情况如以下图所示。请回答:
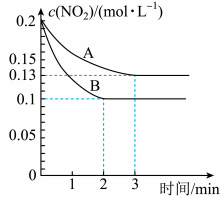
①依曲线A,反应在前3min内氧气的平均反应速率为___________ 。(保留三位有效数字)
②假设曲线A、B分别表示的是该反应在某不同条件下的反应情况,那么此条件是___________ 。(填“浓度”、“压强”、“温度”或“催化剂”)
③曲线A、B分别对应的反应平衡常数的大小关系是
___________  (填“>”、“<”或“=”)
(填“>”、“<”或“=”)
(3)一定温度下,密闭容器中 可发生以下反应:
可发生以下反应:
 I
I
 Ⅱ
Ⅱ
那么反应I的平衡常数表达式为___________ 。假设达平衡时, ,
,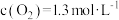 ,那么反应Ⅱ中
,那么反应Ⅱ中 的转化率为
的转化率为___________ , (g)的起始浓度不低于
(g)的起始浓度不低于___________  。
。
(1)火力发电厂的燃煤排烟中含大量的氮氧化物(
 ),可利用甲烷和
),可利用甲烷和 在一条件下反应消除其污染,那么
在一条件下反应消除其污染,那么 与
与 反应的化学方程式为
反应的化学方程式为(2)在一密闭容器中发生反应
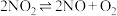 ,反应过程中
,反应过程中 的浓度随时间变化的情况如以下图所示。请回答:
的浓度随时间变化的情况如以下图所示。请回答:
①依曲线A,反应在前3min内氧气的平均反应速率为
②假设曲线A、B分别表示的是该反应在某不同条件下的反应情况,那么此条件是
③曲线A、B分别对应的反应平衡常数的大小关系是

 (填“>”、“<”或“=”)
(填“>”、“<”或“=”)(3)一定温度下,密闭容器中
 可发生以下反应:
可发生以下反应: I
I Ⅱ
Ⅱ那么反应I的平衡常数表达式为
 ,
,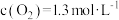 ,那么反应Ⅱ中
,那么反应Ⅱ中 的转化率为
的转化率为 (g)的起始浓度不低于
(g)的起始浓度不低于 。
。
您最近一年使用:0次
2024-04-05更新
|
68次组卷
|
2卷引用:黑龙江省鸡西市新兴实验学校2023-2024学年高三上学期11月期中考试化学试题
解题方法
7 . 火箭推进器中装有还原剂液态肼(N2H4)和氧化剂过氧化氢(H2O2),当它们混合时,即产生大量氮气和水蒸气,并放出大量热。已知0.4mol液态肼与足量液态过氧化氢反应,生成氮气和水蒸气,放出256.65kJ的热量。回答下列问题:
(1)过氧化氢的电子式是___________ 。
(2)该反应的热化学方程式为___________ 。
(3)实验室可用次氯酸钠溶液与氨气反应制备液态肼,已知生成物之一是常见的海盐,则反应的化学方程式为___________ 。
(4)在微生物作用的条件下,NH 经过两步反应被氧化成NO
经过两步反应被氧化成NO 。两步反应的能量变化示意图如下:
。两步反应的能量变化示意图如下:___________ (填“放热”或“吸热”)反应,判断依据是___________ 。
②1 mol NH (aq)全部氧化成NO
(aq)全部氧化成NO (aq)的反应热ΔH是
(aq)的反应热ΔH是___________ 。
(5)在2L恒容密闭容器中充入0.6molN2H4(g),一定温度下发生反应:3N2H4(g) 4NH3(g)+N2(g) ΔH=-32.9kJ·mol-1,N2H4的转化率随时间变化情况如图所示:
4NH3(g)+N2(g) ΔH=-32.9kJ·mol-1,N2H4的转化率随时间变化情况如图所示:___________ ,该温度下此反应的平衡常数为___________ 。
②下列能够表明上述反应已达到平衡状态的有___________ 。
A.3 v正(N2H4) = 4 v逆(NH3) B.气体密度不再改变
C.混合气体的平均相对分子质量不再改变 D.体系与环境不再有净热交换
③写出一种提高N2H4平衡转化率的方法___________ 。
(6)已知醋酸是一种常见的弱酸,回答下列有关问题:
①常温下,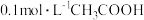 溶液加水稀释过程中,下列表达式数据变大的是
溶液加水稀释过程中,下列表达式数据变大的是___________ 。
A. B.
B.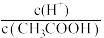 C.
C.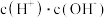 D .
D . E.
E.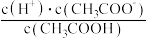
②25℃时,在一定体积pH=2的CH3COOH溶液中,加水稀释至体积为原体积的1000倍,稀释后的溶液pH的范围为___________ 。
(7)已知Kw为水的离子积常数,回答下列有关问题
①在某温度(t℃)下,Kw=1×10-12,则该温度t℃(填大于,小于或等于)_______ 25℃,理由是:___________________________________________ 。
②该温度下,已知pH=9的氢氧化钠溶液,由水电离得到的 =
=______________ 。
(1)过氧化氢的电子式是
(2)该反应的热化学方程式为
(3)实验室可用次氯酸钠溶液与氨气反应制备液态肼,已知生成物之一是常见的海盐,则反应的化学方程式为
(4)在微生物作用的条件下,NH
 经过两步反应被氧化成NO
经过两步反应被氧化成NO 。两步反应的能量变化示意图如下:
。两步反应的能量变化示意图如下: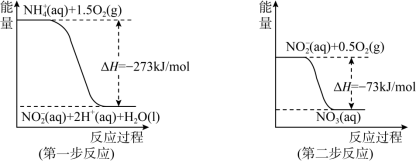
②1 mol NH
 (aq)全部氧化成NO
(aq)全部氧化成NO (aq)的反应热ΔH是
(aq)的反应热ΔH是(5)在2L恒容密闭容器中充入0.6molN2H4(g),一定温度下发生反应:3N2H4(g)
 4NH3(g)+N2(g) ΔH=-32.9kJ·mol-1,N2H4的转化率随时间变化情况如图所示:
4NH3(g)+N2(g) ΔH=-32.9kJ·mol-1,N2H4的转化率随时间变化情况如图所示: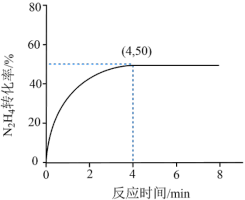
②下列能够表明上述反应已达到平衡状态的有
A.3 v正(N2H4) = 4 v逆(NH3) B.气体密度不再改变
C.混合气体的平均相对分子质量不再改变 D.体系与环境不再有净热交换
③写出一种提高N2H4平衡转化率的方法
(6)已知醋酸是一种常见的弱酸,回答下列有关问题:
①常温下,
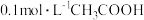 溶液加水稀释过程中,下列表达式数据变大的是
溶液加水稀释过程中,下列表达式数据变大的是A.
 B.
B.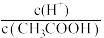 C.
C.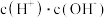 D .
D . E.
E.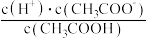
②25℃时,在一定体积pH=2的CH3COOH溶液中,加水稀释至体积为原体积的1000倍,稀释后的溶液pH的范围为
(7)已知Kw为水的离子积常数,回答下列有关问题
①在某温度(t℃)下,Kw=1×10-12,则该温度t℃(填大于,小于或等于)
②该温度下,已知pH=9的氢氧化钠溶液,由水电离得到的
 =
=
您最近一年使用:0次
解题方法
8 . 二氧化碳的转化和利用成为实现“碳达峰”、“碳中和”的重要研究课题。
(1)利用CO2和H2可生产乙烯。相关热化学方程式为:
反应I:2CO2(g)+6H2(g) CH2=CH2(g)+4H2O(g)
CH2=CH2(g)+4H2O(g)  =-246.4kJ/mol
=-246.4kJ/mol
反应II:CO2(g)+4H2(g) CH4(g)+2H2O(g)
CH4(g)+2H2O(g)  =-166.8kJ/mol
=-166.8kJ/mol
某催化剂作用下,在容积为2.0L的恒容密闭容器中充入lmolCO2和3molH2,体系中主要发生上述反应I和反应II两个竞争反应。反应进行tmin时测得两种烃的物质的量随温度的变化如图所示,该催化剂在840℃时主要选择反应___________ (填“I”或II”);840℃之后,C2H4产量下降的原因是___________ 。(从动力学和热力学两角度进行分析)

520℃时,0~tmin内用氢气表示反应I的平均反应速率:v(H2)=___________ mol/(L·min)(用含t的代数式表示)。
(2)利用工业废气CO2制甲醇,发生反应III:CO2(g)+3H2(g) CH3OH(g)+H2O(g)
CH3OH(g)+H2O(g)  ,可一定程度摆脱当下对化石燃料的依赖。
,可一定程度摆脱当下对化石燃料的依赖。
①已知上述反应一定温度下可自发进行,由此可知 ___________0(填“>”、“<”或“=”)。
___________0(填“>”、“<”或“=”)。
②在aL密闭容器中,充入不同氢碳比的原料气体,控制温度600K,只发生反应III,请在图中画出CH3OH在混合气体中的平衡体积分数随氢碳比递增的变化趋势___________。

③一定条件下,将1molCO2和1molH2置于恒容密闭容器中,只发生反应II。下列事实不能说明反应达到平衡状态的是___________ 。
A.每断裂3molH-H同时断裂3molH-O
B.CO2的生成速率与H2O的生成速率相等
C.CO2的体积分数保持不变
D.混合气体的平均相对分子质量保持不变
E.混合气体的密度保持不变
(1)利用CO2和H2可生产乙烯。相关热化学方程式为:
反应I:2CO2(g)+6H2(g)
 CH2=CH2(g)+4H2O(g)
CH2=CH2(g)+4H2O(g)  =-246.4kJ/mol
=-246.4kJ/mol反应II:CO2(g)+4H2(g)
 CH4(g)+2H2O(g)
CH4(g)+2H2O(g)  =-166.8kJ/mol
=-166.8kJ/mol某催化剂作用下,在容积为2.0L的恒容密闭容器中充入lmolCO2和3molH2,体系中主要发生上述反应I和反应II两个竞争反应。反应进行tmin时测得两种烃的物质的量随温度的变化如图所示,该催化剂在840℃时主要选择反应

520℃时,0~tmin内用氢气表示反应I的平均反应速率:v(H2)=
(2)利用工业废气CO2制甲醇,发生反应III:CO2(g)+3H2(g)
 CH3OH(g)+H2O(g)
CH3OH(g)+H2O(g)  ,可一定程度摆脱当下对化石燃料的依赖。
,可一定程度摆脱当下对化石燃料的依赖。①已知上述反应一定温度下可自发进行,由此可知
 ___________0(填“>”、“<”或“=”)。
___________0(填“>”、“<”或“=”)。②在aL密闭容器中,充入不同氢碳比的原料气体,控制温度600K,只发生反应III,请在图中画出CH3OH在混合气体中的平衡体积分数随氢碳比递增的变化趋势___________。

③一定条件下,将1molCO2和1molH2置于恒容密闭容器中,只发生反应II。下列事实不能说明反应达到平衡状态的是
A.每断裂3molH-H同时断裂3molH-O
B.CO2的生成速率与H2O的生成速率相等
C.CO2的体积分数保持不变
D.混合气体的平均相对分子质量保持不变
E.混合气体的密度保持不变
您最近一年使用:0次
9 . 中国科学家设计构建了结构封装双钯活性位点—纳米“蓄水”膜反应器,实现了 一步无副反应高效稳定制乙醇。回答下列问题:
一步无副反应高效稳定制乙醇。回答下列问题:
(1)已知乙醇、氢气的标准燃烧热 分别为
分别为 、
、 ,则反应
,则反应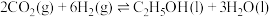 的
的
___________  ,该反应在
,该反应在___________ (填“高温下”“低温下”或“任何温度下均”)有利于自发进行。
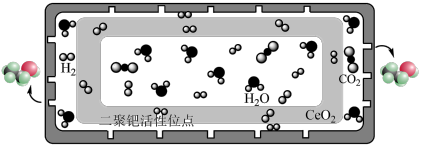
(2)结构封装双钯活性位点—纳米“蓄水”膜反应器结构(如图所示)类似于一个胶囊,胶囊内部封装了二氧化铈载体分散的双钯催化剂,胶囊的壳层具有高选择性、疏水性,可及时分离出产物乙醇。该反应器可使 高效稳定地转化为乙醇,请分析可能原因:
高效稳定地转化为乙醇,请分析可能原因:___________ 。
(3)在一恒压密闭容器中充入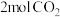 、
、 ,发生主反应I
,发生主反应I 、副反应II
、副反应II 。已知初始压强为
。已知初始压强为 ,反应
,反应 时,测得
时,测得 下,总共生成
下,总共生成 水。甲醇与乙醇的选择性[如
水。甲醇与乙醇的选择性[如 的选择性
的选择性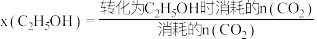 ]随温度和反应时间的变化关系如图。
]随温度和反应时间的变化关系如图。
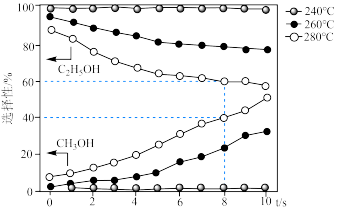
①在 下,当温度为
下,当温度为 时,乙醇的选择性能保持在近
时,乙醇的选择性能保持在近 的水平,但温度为
的水平,但温度为 和
和 时选择性大幅下降,其原因可能为
时选择性大幅下降,其原因可能为___________ 。
② 下,
下, 内
内 的转化率为
的转化率为___________ %,氢气分压的平均变化率为___________  。
。
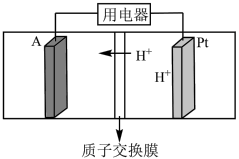
(4)酸性 燃料电池的装置图如图所示,A极输入的物质为
燃料电池的装置图如图所示,A极输入的物质为___________ (填化学式), 极的电极反应式为
极的电极反应式为___________ 。
 一步无副反应高效稳定制乙醇。回答下列问题:
一步无副反应高效稳定制乙醇。回答下列问题:(1)已知乙醇、氢气的标准燃烧热
 分别为
分别为 、
、 ,则反应
,则反应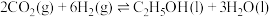 的
的
 ,该反应在
,该反应在(2)结构封装双钯活性位点—纳米“蓄水”膜反应器结构(如图所示)类似于一个胶囊,胶囊内部封装了二氧化铈载体分散的双钯催化剂,胶囊的壳层具有高选择性、疏水性,可及时分离出产物乙醇。该反应器可使
 高效稳定地转化为乙醇,请分析可能原因:
高效稳定地转化为乙醇,请分析可能原因:
(3)在一恒压密闭容器中充入
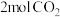 、
、 ,发生主反应I
,发生主反应I 、副反应II
、副反应II 。已知初始压强为
。已知初始压强为 ,反应
,反应 时,测得
时,测得 下,总共生成
下,总共生成 水。甲醇与乙醇的选择性[如
水。甲醇与乙醇的选择性[如 的选择性
的选择性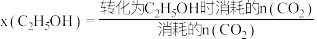 ]随温度和反应时间的变化关系如图。
]随温度和反应时间的变化关系如图。
①在
 下,当温度为
下,当温度为 时,乙醇的选择性能保持在近
时,乙醇的选择性能保持在近 的水平,但温度为
的水平,但温度为 和
和 时选择性大幅下降,其原因可能为
时选择性大幅下降,其原因可能为②
 下,
下, 内
内 的转化率为
的转化率为 。
。(4)酸性
 燃料电池的装置图如图所示,A极输入的物质为
燃料电池的装置图如图所示,A极输入的物质为 极的电极反应式为
极的电极反应式为
您最近一年使用:0次
2024-03-31更新
|
119次组卷
|
2卷引用:2024届陕西省榆林市高三上学期第一次模拟检测理综试题-高中化学
解题方法
10 . 工业上利用反应 制取氢气。向两个容积为
制取氢气。向两个容积为 的密闭容器中加入
的密闭容器中加入 和
和 各
各 ,分别在不同温度和催化剂下进行反应,保持其他初始实验条件不变,经
,分别在不同温度和催化剂下进行反应,保持其他初始实验条件不变,经 测得两容器中
测得两容器中 转化率如图所示。下列说法正确的是
转化率如图所示。下列说法正确的是

 制取氢气。向两个容积为
制取氢气。向两个容积为 的密闭容器中加入
的密闭容器中加入 和
和 各
各 ,分别在不同温度和催化剂下进行反应,保持其他初始实验条件不变,经
,分别在不同温度和催化剂下进行反应,保持其他初始实验条件不变,经 测得两容器中
测得两容器中 转化率如图所示。下列说法正确的是
转化率如图所示。下列说法正确的是
| A.A点和B点均为反应的平衡状态 |
| B.催化剂2比催化剂1的催化效率高 |
C.C点时, 反应的平均速率 反应的平均速率 |
D.温度为 时,该反应平衡常数 时,该反应平衡常数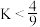 |
您最近一年使用:0次



