名校
1 . 某化学小组欲测定 与
与 反应的化学反应速率,并探究影响其化学反应速率的因素,请回答下列问题:
反应的化学反应速率,并探究影响其化学反应速率的因素,请回答下列问题:
 .该小组同学设计了3组实验,探究影响化学反应速率的部分因素,具体情况如表所示。
.该小组同学设计了3组实验,探究影响化学反应速率的部分因素,具体情况如表所示。
(1)表中
___________ ,通过实验1和实验3可探究___________ 对化学反应速率的影响。
(2)写出 与
与 反应的离子方程式:
反应的离子方程式:___________ 。
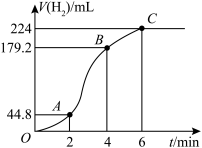
 .该小组同学依据实验1的条件进行反应并测定其化学反应速率,所得数据如图所示。
.该小组同学依据实验1的条件进行反应并测定其化学反应速率,所得数据如图所示。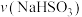 为
为___________ 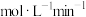 。
。
分析实验数据发现,反应过程中该反应的化学反应速率先增大后减小,探究化学反应速率先增大的原因,具体情况如表所示。
(4)方案2中的假设为___________ 。
(5)除方案1、2中的假设外,还可提出的假设是___________ 。
(6)反应后期化学反应速率减小的主要原因是___________ 。
 与
与 反应的化学反应速率,并探究影响其化学反应速率的因素,请回答下列问题:
反应的化学反应速率,并探究影响其化学反应速率的因素,请回答下列问题: .该小组同学设计了3组实验,探究影响化学反应速率的部分因素,具体情况如表所示。
.该小组同学设计了3组实验,探究影响化学反应速率的部分因素,具体情况如表所示。| 编号 | 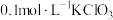 溶液体积/mL 溶液体积/mL |  液体积/mL 液体积/mL | 加水的体积/mL | 温度 |
| 1 | 10 | 10 | 0 | 25℃ |
| 2 | 10 | 5 | a | 25℃ |
| 3 | 10 | 10 | 0 | 60℃ |
(1)表中

(2)写出
 与
与 反应的离子方程式:
反应的离子方程式: .该小组同学依据实验1的条件进行反应并测定其化学反应速率,所得数据如图所示。
.该小组同学依据实验1的条件进行反应并测定其化学反应速率,所得数据如图所示。
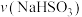 为
为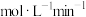 。
。分析实验数据发现,反应过程中该反应的化学反应速率先增大后减小,探究化学反应速率先增大的原因,具体情况如表所示。
| 方案 | 假设 | 实验操作 |
| 1 | 该反应放热,使溶液温度升高,化学反应速率加快 | 向烧杯中加入10mL 溶液和10mL 溶液和10mL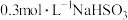 溶液,插入温度计,测量温度变化 溶液,插入温度计,测量温度变化 |
| 2 | 另取10mL 溶液加入烧杯中,向其中加入少量NaCl固体,再加入10mL 溶液加入烧杯中,向其中加入少量NaCl固体,再加入10mL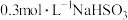 溶液。 溶液。 |
(4)方案2中的假设为
(5)除方案1、2中的假设外,还可提出的假设是
(6)反应后期化学反应速率减小的主要原因是
您最近一年使用:0次
解题方法
2 . 某小组利用H2C2O4溶液和酸性KMnO4溶液反应来探究“外界条件对化学反应速率的影响”,进行了如下实验:
请回答:
(1)实验计时方法是从溶液混合开始记时,至___________ 时记时结束。
(2)V1=___________ ,V2=___________ ;设计实验Ⅰ、Ⅲ的目的是探究___________ 对反应速率的影响。
(3)利用实验Ⅲ中数据计算,用KMnO4的浓度变化表示的反应速率为v(KMnO4)=___________ 。
(4)有同学在实验中发现高锰酸钾酸性溶液和草酸溶液反应时,开始一段时间反应速率较慢,溶液褪色不明显;但不久突然褪色,反应速率明显加快。某同学认为是放热导致溶液温度升高所致,重做Ⅰ号实验,测定过程中溶液不同时间的温度,结果温度没有明显变化。由此你得出的结论是:
①___________ 不是反应速率突然加快的原因;
②可能是反应产物有催化作用。Ⅳ号实验是为验证你的猜测,实验中要加入的少量某种物质是___________ 。
| 实验编号 | 0.01mol•L﹣1 酸性KMnO4溶液 | 0.1mol•L﹣1 H2C2O4溶液 | 水 | 某种物质 | 反应温度/℃ | 反应时间(min) |
| Ⅰ | 2ml | 2ml | 0 | 0 | 20 | 2.1 |
| Ⅱ | V1ml | 2ml | 1ml | 0 | 20 | 5.5 |
| Ⅲ | V2 ml | 2ml | 0 | 0 | 50 | 0.5 |
| Ⅳ | 2ml | 2ml | 0 | 少量 | 20 | 0.2 |
(1)实验计时方法是从溶液混合开始记时,至
(2)V1=
(3)利用实验Ⅲ中数据计算,用KMnO4的浓度变化表示的反应速率为v(KMnO4)=
(4)有同学在实验中发现高锰酸钾酸性溶液和草酸溶液反应时,开始一段时间反应速率较慢,溶液褪色不明显;但不久突然褪色,反应速率明显加快。某同学认为是放热导致溶液温度升高所致,重做Ⅰ号实验,测定过程中溶液不同时间的温度,结果温度没有明显变化。由此你得出的结论是:
①
②可能是反应产物有催化作用。Ⅳ号实验是为验证你的猜测,实验中要加入的少量某种物质是
您最近一年使用:0次
3 . 室温下,将 、
、 、KI、
、KI、 溶液及淀粉混合,一段时间后溶液先变为蓝色,后蓝色褪去,且两种现象交替出现。反应分两步进行:反应A:
溶液及淀粉混合,一段时间后溶液先变为蓝色,后蓝色褪去,且两种现象交替出现。反应分两步进行:反应A: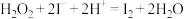 ;反应B:……;总反应为:
;反应B:……;总反应为: 。
。
回答下列问题:
(1)反应B的离子方程式是______ 。 的作用为
的作用为______ 。
(2)小组同学探究溶液颜色第一次变蓝快慢的影响因素,进行下列反应。
①实验Ⅰ中,若2s时 的浓度变为
的浓度变为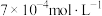 ,则0~2s时
,则0~2s时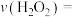
______ 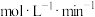
②为探究不同pH对溶液颜色第一次变蓝快慢的影响因素,进行实验Ⅰ和Ⅱ,则
______ ;实验Ⅲ和实验Ⅳ对照实验的目的为______ ;若探究温度对溶液颜色第一次变蓝快慢的影响因素,可选择实验______ 和实验______ (填写“Ⅰ”“Ⅱ”“Ⅲ”或“Ⅳ”)。
 、
、 、KI、
、KI、 溶液及淀粉混合,一段时间后溶液先变为蓝色,后蓝色褪去,且两种现象交替出现。反应分两步进行:反应A:
溶液及淀粉混合,一段时间后溶液先变为蓝色,后蓝色褪去,且两种现象交替出现。反应分两步进行:反应A: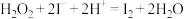 ;反应B:……;总反应为:
;反应B:……;总反应为: 。
。回答下列问题:
(1)反应B的离子方程式是
 的作用为
的作用为(2)小组同学探究溶液颜色第一次变蓝快慢的影响因素,进行下列反应。
试剂用量(mL) 序号 | 温度 | 0.01 | 0.01 | 0.01 | 0.01 |
|
Ⅰ | 25℃ | 5 | 4 | 8 | 3 | 0 |
Ⅱ | 25℃ | 5 | 2 | x | y | z |
Ⅲ | 35℃ | 5 | 4 | 8 | 3 | 0 |
Ⅳ | 35℃ | 3 | 4 | 8 | 3 | 2 |
 的浓度变为
的浓度变为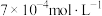 ,则0~2s时
,则0~2s时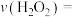
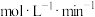
②为探究不同pH对溶液颜色第一次变蓝快慢的影响因素,进行实验Ⅰ和Ⅱ,则

您最近一年使用:0次
名校
4 . 过硫酸钠(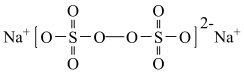 ),易溶于水,加热至65℃分解。作为强氧化剂,广泛应用于蓄电池工业、造纸工业、食品工业等。某化学小组对
),易溶于水,加热至65℃分解。作为强氧化剂,广泛应用于蓄电池工业、造纸工业、食品工业等。某化学小组对 制备和性质及用途进行探究。
制备和性质及用途进行探究。

工业制备过硫酸钠的反应原理:
主反应:

副反应:

实验室设计如图实验装置:
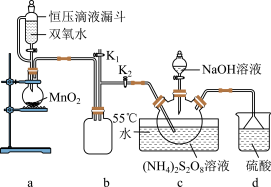
(2)装置b的作用是
(3)上述反应过程中,d装置中主要发生的化学反应方程式为
Ⅱ.探究
 的性质与用途
的性质与用途(4)
 用于废水中苯酚的降解
用于废水中苯酚的降解已知:a.
 具有强氧化性,
具有强氧化性, 浓度较高时会导致
浓度较高时会导致 淬灭。
淬灭。b.
 可将苯酚氧化,但反应速率较慢,加入
可将苯酚氧化,但反应速率较慢,加入 可加快反应。
可加快反应。过程为ⅰ.

ⅱ.
 将苯酚氧化为
将苯酚氧化为 气体
气体①
 氧化苯酚的离子方程式是
氧化苯酚的离子方程式是②将含
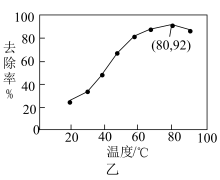
 的溶液稀释后加入苯酚的废水处理器中,调节溶液总体积为1L,pH=1,测得在相同时间内,不同条件下苯酚的降解率如图甲。
的溶液稀释后加入苯酚的废水处理器中,调节溶液总体积为1L,pH=1,测得在相同时间内,不同条件下苯酚的降解率如图甲。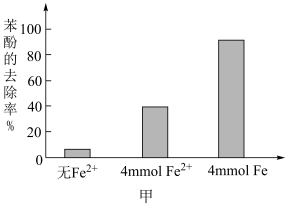
 ,可明显提高苯酚的降解率,主要原因是
,可明显提高苯酚的降解率,主要原因是(5)工业上利用
 能有效处理燃煤锅炉烟气中的NO气体。一定条件下,将含一定浓度NO的烟气以一定的速率通过含
能有效处理燃煤锅炉烟气中的NO气体。一定条件下,将含一定浓度NO的烟气以一定的速率通过含 的处理液中,NO去除率随温度变化的关系如图乙所示,80℃时,NO去除率为92%。若NO初始浓度为
的处理液中,NO去除率随温度变化的关系如图乙所示,80℃时,NO去除率为92%。若NO初始浓度为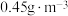 ,
, 达到最大去除率,NO去除的平均反应速率:
达到最大去除率,NO去除的平均反应速率: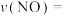
 。
。
您最近一年使用:0次
名校
5 . 化学兴趣小组同学用0.20
 、0.1
、0.1
 、0.2%淀粉溶液、0.50mol/L KI等试剂探究影响化学反应速率的因素。
、0.2%淀粉溶液、0.50mol/L KI等试剂探究影响化学反应速率的因素。
已知:
 (慢)
(慢)
 (快)
(快)
(1)向KI、 与淀粉的混合溶液中加入一定量的
与淀粉的混合溶液中加入一定量的 溶液,当溶液中的
溶液,当溶液中的___________ (填化学式)耗尽后,溶液颜色将由无色变为蓝色。为确保能观察到蓝色, 与
与 物质的量需满足的关系为
物质的量需满足的关系为
___________ (填“>”、“<”或“=”)2∶1.出现蓝色之前, 在反应中起到的作用是
在反应中起到的作用是___________ 。
(2)为探究反应物浓度对化学反应速率的影响,设计如下实验方案:
①表中的
___________ ,理由是___________ 。
②若实验①中观察到溶液变蓝的时间为10s,则用 的浓度变化表示的平均反应速率
的浓度变化表示的平均反应速率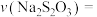
___________ mol/(L·s)。
(3)已知某条件下, 随反应时间(t)的变化曲线如图,若保持其它条件不变,分别画出降低反应温度和加入催化剂时
随反应时间(t)的变化曲线如图,若保持其它条件不变,分别画出降低反应温度和加入催化剂时 随反应时间(t)的变化曲线示意图(进行相应的标注)。
随反应时间(t)的变化曲线示意图(进行相应的标注)。___________

 、0.1
、0.1
 、0.2%淀粉溶液、0.50mol/L KI等试剂探究影响化学反应速率的因素。
、0.2%淀粉溶液、0.50mol/L KI等试剂探究影响化学反应速率的因素。已知:
 (慢)
(慢) (快)
(快)(1)向KI、
 与淀粉的混合溶液中加入一定量的
与淀粉的混合溶液中加入一定量的 溶液,当溶液中的
溶液,当溶液中的 与
与 物质的量需满足的关系为
物质的量需满足的关系为
 在反应中起到的作用是
在反应中起到的作用是(2)为探究反应物浓度对化学反应速率的影响,设计如下实验方案:
| 实验序号 | 溶液体积/mL | ||||
 溶液 溶液 |  | KI溶液 |  溶液 溶液 | 淀粉溶液 | |
| ① | 10.0 | 0.0 | 4.0 | 4.0 | 2.0 |
| ② | 9.0 |  |  | 4.0 | 2.0 |
| ③ | 8.0 |  |  | 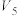 | 2.0 |

②若实验①中观察到溶液变蓝的时间为10s,则用
 的浓度变化表示的平均反应速率
的浓度变化表示的平均反应速率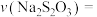
(3)已知某条件下,
 随反应时间(t)的变化曲线如图,若保持其它条件不变,分别画出降低反应温度和加入催化剂时
随反应时间(t)的变化曲线如图,若保持其它条件不变,分别画出降低反应温度和加入催化剂时 随反应时间(t)的变化曲线示意图(进行相应的标注)。
随反应时间(t)的变化曲线示意图(进行相应的标注)。
您最近一年使用:0次
名校
解题方法
6 . 控制变量法是化学实验的一种常用方法。
Ⅰ.下表是某学习小组研究等物质的量浓度的稀硫酸和锌反应的实验数据,分析以下数据,回答下列问题:
(1)判断锌和稀硫酸反应速率大小,最简单的方法可通过测定_______ 进行判断,在此5组实验中,其速率最快的是_______ (填实验序号)。
(2)实验1和2表明_______ 对反应速率有影响,实验1和3对比发现实验3反应速率明显较快,主要原因是_______ 。
(3)进行实验2时,小组同学根据实验过程绘制的氢气体积(标准状况下)与时间的关系如图所示。在OA、AB、BC三段中反应速率最快的是AB段,其原因是_______ 。_______ 。
(5)b点对应的反应速率
_______  。
。
(6)通过以上分析可知选择加入下列哪些试剂可以与加入硫酸铜有相似的效果_______
Ⅰ.下表是某学习小组研究等物质的量浓度的稀硫酸和锌反应的实验数据,分析以下数据,回答下列问题:
| 序号 | 锌的质量/g | 锌的形式 |  |  | 反应前溶液的温度/℃ | 其他试剂 |
| 1 | 0.65 | 粒状 | 0.5 | 50 | 20 | 无 |
| 2 | 0.65 | 粉末 | 0.5 | 50 | 20 | 无 |
| 3 | 0.65 | 粒状 | 0.5 | 50 | 20 | 2滴 溶液 溶液 |
| 4 | 0.65 | 粉末 | 0.8 | 50 | 20 | 无 |
| 5 | 0.65 | 粉末 | 0.8 | 50 | 35 | 2滴 溶液 溶液 |
(1)判断锌和稀硫酸反应速率大小,最简单的方法可通过测定
(2)实验1和2表明
(3)进行实验2时,小组同学根据实验过程绘制的氢气体积(标准状况下)与时间的关系如图所示。在OA、AB、BC三段中反应速率最快的是AB段,其原因是
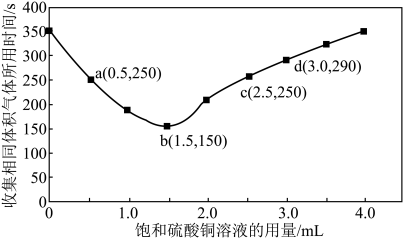
(5)b点对应的反应速率

 。
。(6)通过以上分析可知选择加入下列哪些试剂可以与加入硫酸铜有相似的效果_______
A. 溶液 溶液 | B. 溶液 溶液 | C.稀 | D. 溶液 溶液 |
您最近一年使用:0次
名校
解题方法
7 . 探究浓度对化学反应速率的影响。
利用反应: ,反应过程中溶液出现乳白色浑浊,比较浑浊现象出现时间的长短,判断反应进行的快慢。实验数据如下表。
,反应过程中溶液出现乳白色浑浊,比较浑浊现象出现时间的长短,判断反应进行的快慢。实验数据如下表。
(1)乳白色浑浊的主要成分是___________ 。
(2)实验1、2探究 溶液浓度对化学反应速率的影响。
溶液浓度对化学反应速率的影响。
①
___________ 。
②“实验2”中加入 水的主要目的是
水的主要目的是___________ 。
(3)实验1、3探究 溶液的浓度对化学反应速率的影响。则
溶液的浓度对化学反应速率的影响。则
___________ ,
___________ ,
___________ 。
(4)该实验能说明增大反应物的浓度,化学反应速率增大。实验依据是___________ 。
(5)用 传感器测得实验1在
传感器测得实验1在 时
时 为
为 ,则该反应在
,则该反应在 内的化学反应速率
内的化学反应速率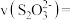
___________  。有同学校认为这样的计算结果误差较大,理由是
。有同学校认为这样的计算结果误差较大,理由是___________ 。
利用反应:
 ,反应过程中溶液出现乳白色浑浊,比较浑浊现象出现时间的长短,判断反应进行的快慢。实验数据如下表。
,反应过程中溶液出现乳白色浑浊,比较浑浊现象出现时间的长短,判断反应进行的快慢。实验数据如下表。| 实验编号 | 加入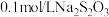 溶液的体积 溶液的体积 | 加入水的体积 | 加入 溶液的体积 溶液的体积 | 溶液出现浑浊的时间(S) |
 |  |  | ||
| 1 | 2 | 0 | 2 |  |
| 2 | 1 |  | 2 |  |
| 3 |  |  |  |  |
(2)实验1、2探究
 溶液浓度对化学反应速率的影响。
溶液浓度对化学反应速率的影响。①

②“实验2”中加入
 水的主要目的是
水的主要目的是(3)实验1、3探究
 溶液的浓度对化学反应速率的影响。则
溶液的浓度对化学反应速率的影响。则


(4)该实验能说明增大反应物的浓度,化学反应速率增大。实验依据是
(5)用
 传感器测得实验1在
传感器测得实验1在 时
时 为
为 ,则该反应在
,则该反应在 内的化学反应速率
内的化学反应速率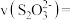
 。有同学校认为这样的计算结果误差较大,理由是
。有同学校认为这样的计算结果误差较大,理由是
您最近一年使用:0次
8 . 根据要求,回答下列问题:
(1)为比较 、
、 对
对 分解的催化效果,某实验小组同学设计了如图所示的实验。通过观察
分解的催化效果,某实验小组同学设计了如图所示的实验。通过观察______ (填实验现象),即可得出 、
、 的催化效果的差异。有同学提出将
的催化效果的差异。有同学提出将 溶液改为
溶液改为 溶液更合理,其理由是
溶液更合理,其理由是______  和
和 (草酸)反应速率的影响,设计实验方案如下:
(草酸)反应速率的影响,设计实验方案如下:
上述反应的离子方程式为______ ,该实验是探究______ 对反应速率的影响。
(3)工业制硫酸的反应之一为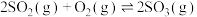 ,在2L恒温恒容密闭容器中投入2mol
,在2L恒温恒容密闭容器中投入2mol 和1mol
和1mol 在一定条件下充分反应,下图是
在一定条件下充分反应,下图是 和
和 随时间的变化曲线。
随时间的变化曲线。 的平均反应速率为
的平均反应速率为______ 。
(2)A点的
______  (填“>”“<”或“=”)。
(填“>”“<”或“=”)。
(1)为比较
 、
、 对
对 分解的催化效果,某实验小组同学设计了如图所示的实验。通过观察
分解的催化效果,某实验小组同学设计了如图所示的实验。通过观察 、
、 的催化效果的差异。有同学提出将
的催化效果的差异。有同学提出将 溶液改为
溶液改为 溶液更合理,其理由是
溶液更合理,其理由是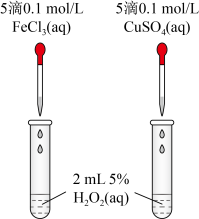
 和
和 (草酸)反应速率的影响,设计实验方案如下:
(草酸)反应速率的影响,设计实验方案如下:实验序号 | 草酸溶液 | 酸性高锰酸钾溶液 |
① |
|
|
② |
|
|
(3)工业制硫酸的反应之一为
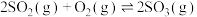 ,在2L恒温恒容密闭容器中投入2mol
,在2L恒温恒容密闭容器中投入2mol 和1mol
和1mol 在一定条件下充分反应,下图是
在一定条件下充分反应,下图是 和
和 随时间的变化曲线。
随时间的变化曲线。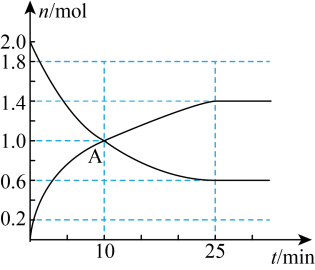
 的平均反应速率为
的平均反应速率为(2)A点的

 (填“>”“<”或“=”)。
(填“>”“<”或“=”)。
您最近一年使用:0次
9 . 某化学课外小组的同学通过实验探究温度和浓度对反应速率的影响。实验原理及方案:在酸性溶液中,KIO3和Na2SO3可发生反应生成I2,生成的I2可用淀粉溶液检验,根据出现蓝色的时间来衡量该反应的速率。
回答下列问题:
(1)实验①③中V1=_______ ,V2=_______ 。
(2)出现蓝色的时间t1与t3大到小关系_______ 。
(3)实验②③的目的是_______ 。
(4)实验中加水的目的是_______ 。
(5)资料显示序号①的反应进行至10 s时,测得Na2SO3溶液的浓度为0.02 mol·L-1,则5 s内消耗Na2SO3的平均速率v(Na2SO3)=_______ 。
| 实验序号 | 0.1 mol·L-1KIO3酸性溶液(含淀粉)的体积/mL | 0.1 mol·L-1Na2SO3溶液的体积/mL | 水的体积/mL | 实验温度/℃ | 出现蓝色的时间/s |
| ① | 5 | 5 | V1 | 5 | t1 |
| ② | 5 | 5 | 30 | 25 | t2 |
| ③ | 5 | V2 | 20 | 25 | t3 |
(1)实验①③中V1=
(2)出现蓝色的时间t1与t3大到小关系
(3)实验②③的目的是
(4)实验中加水的目的是
(5)资料显示序号①的反应进行至10 s时,测得Na2SO3溶液的浓度为0.02 mol·L-1,则5 s内消耗Na2SO3的平均速率v(Na2SO3)=
您最近一年使用:0次
名校
解题方法
10 . 某实验小组为探究外界条件对化学反应速率的影响进行如下实验:
实验1:探究常温下影响等质量金属与酸反应生成氢气速率的因素:
(1)实验I、Ⅱ探究的是___________ 对反应速率的影响。
(2)实验I、Ⅲ及相应实验现象得到的结论是___________ 。
(3)实验1中三组的反应速率由快到慢的顺序可能是___________ (填编号)。
(4)甲同学在进行实验Ⅲ时又加入了少量硫酸铜固体,发现生成气体速率明显加快,试分析其原因:___________ 。
实验2:探究影响反应 的因素。(编号Ⅳ为对照组)
的因素。(编号Ⅳ为对照组)
(5)请写出表中
___________ 。
(6)实验Ⅵ研究“温度对该反应速率的影响”,请填写合理的数据。①:___________ ;②:___________ ;③:___________ 。
(7)该小组同学依据实V条件进行反应并测定其化学反应速率,所得数据如图所示。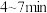 内用
内用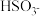 表示的平均反应速率为
表示的平均反应速率为___________  。(写出计算过程)
。(写出计算过程)
实验1:探究常温下影响等质量金属与酸反应生成氢气速率的因素:
| 实验编号 | 金属 | c(酸)/( ) ) | 溶液体积/ |
| I | 铁粉 |  硫酸 硫酸 | 10 |
| Ⅱ | 铁粉 |  盐酸 盐酸 | 10 |
| Ⅲ | 铁块 |  硫酸 硫酸 | 10 |
(1)实验I、Ⅱ探究的是
(2)实验I、Ⅲ及相应实验现象得到的结论是
(3)实验1中三组的反应速率由快到慢的顺序可能是
(4)甲同学在进行实验Ⅲ时又加入了少量硫酸铜固体,发现生成气体速率明显加快,试分析其原因:
实验2:探究影响反应
 的因素。(编号Ⅳ为对照组)
的因素。(编号Ⅳ为对照组)| 实验编号 |  溶液的体积/ 溶液的体积/ | 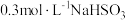 溶液的体积/ 溶液的体积/ | 水的体积/ | 反应温度 |
| Ⅳ | 10 | 10 | 0 |  |
| V | 10 | 5 | a |  |
| Ⅵ | ① | ② | ③ |  |
(5)请写出表中

(6)实验Ⅵ研究“温度对该反应速率的影响”,请填写合理的数据。①:
(7)该小组同学依据实V条件进行反应并测定其化学反应速率,所得数据如图所示。
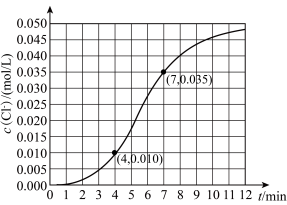
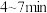 内用
内用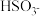 表示的平均反应速率为
表示的平均反应速率为 。(写出计算过程)
。(写出计算过程)
您最近一年使用:0次



 、20mL
、20mL 、30mL
、30mL 、20mL
、20mL

