1 . 在自然界的氮循环中,羟胺 以中间产物的形式参与氮循环。例如在微生物作用下,
以中间产物的形式参与氮循环。例如在微生物作用下, 转化为
转化为 的途径为:
的途径为: 。
。
(1)上述转化途径称为_____ 。
A.硝化作用 B.反硝化作用
羟胺熔点为32.05℃,极易溶于水,且在水中稳定。其分子结构模型如图所示。

(2)图中的分子结构模型属于_____ 。
A.球棍模型 B.空间填充模型
(3)解释羟胺极易溶于水的原因。_____ 、_____ 。
研究表明:在酸性水体中 与
与 反应时,含氮产物随两者比例不同而发生变化。
反应时,含氮产物随两者比例不同而发生变化。
(4)用 含
含 与
与 混合溶液发生反应。测出反应过程中
混合溶液发生反应。测出反应过程中 随时间变化曲线如图所示。从反应开始至
随时间变化曲线如图所示。从反应开始至 时,
时, 的平均反应速率
的平均反应速率
_____ 。

研究表明:反应①分为三步,各步反应及其焓变见下表。
(5)根据价层电子对互斥理论,预测 分子(N为中心原子)的空间结构为_____。
分子(N为中心原子)的空间结构为_____。
(6) 属于_____。
属于_____。
(7)反应①的焓变=_____ 。(用 、
、 、
、 表示)
表示)
(8)在细菌作用下, 与
与 反应生成
反应生成 。可通过
。可通过_____ 方法确定 的中心氮原子来源于
的中心氮原子来源于 还是
还是 。
。
 以中间产物的形式参与氮循环。例如在微生物作用下,
以中间产物的形式参与氮循环。例如在微生物作用下, 转化为
转化为 的途径为:
的途径为: 。
。(1)上述转化途径称为
A.硝化作用 B.反硝化作用
羟胺熔点为32.05℃,极易溶于水,且在水中稳定。其分子结构模型如图所示。

(2)图中的分子结构模型属于
A.球棍模型 B.空间填充模型
(3)解释羟胺极易溶于水的原因。
研究表明:在酸性水体中
 与
与 反应时,含氮产物随两者比例不同而发生变化。
反应时,含氮产物随两者比例不同而发生变化。| 物质的量之比 | 反应原理 |
 | 反应①: |
 | 反应②: |
(4)用
 含
含 与
与 混合溶液发生反应。测出反应过程中
混合溶液发生反应。测出反应过程中 随时间变化曲线如图所示。从反应开始至
随时间变化曲线如图所示。从反应开始至 时,
时, 的平均反应速率
的平均反应速率

研究表明:反应①分为三步,各步反应及其焓变见下表。
| 反应原理 | 反应焓变 | |
| 第1步 |  |  |
| 第2步 |  |  |
| 第3步 |  |  |
(5)根据价层电子对互斥理论,预测
 分子(N为中心原子)的空间结构为_____。
分子(N为中心原子)的空间结构为_____。| A.直线形 | B.角形 | C.三角锥形 | D.四面体形 |
(6)
 属于_____。
属于_____。| A.反应物 | B.生成物 | C.中间产物 | D.催化剂 |
(7)反应①的焓变=
 、
、 、
、 表示)
表示)(8)在细菌作用下,
 与
与 反应生成
反应生成 。可通过
。可通过 的中心氮原子来源于
的中心氮原子来源于 还是
还是 。
。
您最近一年使用:0次
名校
2 . 新型纳米材料 ,可用于除去工业废气中的某些氧化物。
,可用于除去工业废气中的某些氧化物。
I.铁酸锌难溶于水,其晶胞由A、B结构按照1∶1交替累积而成,如图1所示。

(1)B结构的化学式为________ 。
Ⅱ.含铁锌精矿(主要含有 和
和 )焙烧可以得到
)焙烧可以得到 。废渣通常作为锌渣处理,一种回收利用锌渣制取
。废渣通常作为锌渣处理,一种回收利用锌渣制取 溶液和
溶液和 的流程如图1所示。
的流程如图1所示。

(2)写出由含铁锌精矿焙烧得到 的化学方程式:
的化学方程式:________ 。
(3)锌渣浸出时发生如下反应:
反应1:
反应2:
反应3: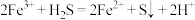
已知 ,则反应2的平衡常数
,则反应2的平衡常数
________ 。
(4)浸出过程中,溶液中 、总
、总 的浓度随时间的变化关系如图3所示。
的浓度随时间的变化关系如图3所示。
 时间内,溶液中
时间内,溶液中 的浓度随时间延长而逐渐增大的原因是
的浓度随时间延长而逐渐增大的原因是________ 。
Ⅲ.纳米 用于除去废气时转化关系为:
用于除去废气时转化关系为:

(5) 时,上述转化反应中消耗的
时,上述转化反应中消耗的
________ .
(6) 除去
除去 的化学方程式为:
的化学方程式为:________ 。
 ,可用于除去工业废气中的某些氧化物。
,可用于除去工业废气中的某些氧化物。I.铁酸锌难溶于水,其晶胞由A、B结构按照1∶1交替累积而成,如图1所示。

(1)B结构的化学式为
Ⅱ.含铁锌精矿(主要含有
 和
和 )焙烧可以得到
)焙烧可以得到 。废渣通常作为锌渣处理,一种回收利用锌渣制取
。废渣通常作为锌渣处理,一种回收利用锌渣制取 溶液和
溶液和 的流程如图1所示。
的流程如图1所示。
(2)写出由含铁锌精矿焙烧得到
 的化学方程式:
的化学方程式:(3)锌渣浸出时发生如下反应:
反应1:

反应2:

反应3:
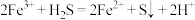
已知
 ,则反应2的平衡常数
,则反应2的平衡常数
(4)浸出过程中,溶液中
 、总
、总 的浓度随时间的变化关系如图3所示。
的浓度随时间的变化关系如图3所示。 时间内,溶液中
时间内,溶液中 的浓度随时间延长而逐渐增大的原因是
的浓度随时间延长而逐渐增大的原因是Ⅲ.纳米
 用于除去废气时转化关系为:
用于除去废气时转化关系为:
(5)
 时,上述转化反应中消耗的
时,上述转化反应中消耗的
(6)
 除去
除去 的化学方程式为:
的化学方程式为:
您最近一年使用:0次
名校
解题方法
3 . 回答下列问题
(1)研究发现,在 低压合成甲醇反应(
低压合成甲醇反应(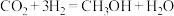 )中,Co氧化物负载的Mn氧化物纳米粒子催化剂具有高活性,显示出良好的应用前景。
)中,Co氧化物负载的Mn氧化物纳米粒子催化剂具有高活性,显示出良好的应用前景。
Co基态原子核外电子排布式为___________ 。元素Mn与O中,第一电离能较大的是______ ,基态原子核外未成对电子数较多的是____________ 。
(2)我国科学家成功合成了世界上首个五氮阴离子盐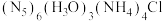 。
。
①氮原子的价电子排布图为__________________ 。
②元素的基态气态原子得到一个电子形成气态负一价离子时所放出的能量称作第一电子亲和能( )。第二周期部分元素的
)。第二周期部分元素的 变化趋势如图所示。
变化趋势如图所示。
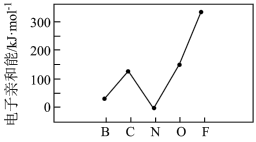
其中除氮元素外,其他元素的 自左而右依次增大的原因是
自左而右依次增大的原因是________ ,氮元素的 呈现异常的原因是
呈现异常的原因是______ 。
(3)工业上常用CO与 合成甲醇,热化学方程式为:
合成甲醇,热化学方程式为:
 kJ/mol在温度T时,向体积为2 L的恒容容器中充入物质的量之和为3 mol的CO和
kJ/mol在温度T时,向体积为2 L的恒容容器中充入物质的量之和为3 mol的CO和 ,发生反应:
,发生反应: ,反应达到平衡时
,反应达到平衡时 的体积分数(中)与
的体积分数(中)与 的关系如图所示。
的关系如图所示。

①当起始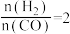 时,经过5 min达到平衡,CO的转化率为60%,则0~5 min内平均反应速率
时,经过5 min达到平衡,CO的转化率为60%,则0~5 min内平均反应速率
_______ 。
②当 时,达到平衡后,
时,达到平衡后, 的体积分数可能是图像中的
的体积分数可能是图像中的____ (填“D”“E”或“F”)点。
(4)CO和 是最为常见的两种碳氧化物,可以实现相互转化。已知由
是最为常见的两种碳氧化物,可以实现相互转化。已知由 生成CO的过程中存在如下基元反应:
生成CO的过程中存在如下基元反应: ,其正反应速率为
,其正反应速率为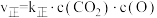 ,逆反应速率为
,逆反应速率为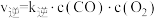 ,k为速率常数。2500K时,
,k为速率常数。2500K时,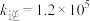 L·s
L·s ·mol
·mol ,
,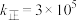 L·s
L·s ·mol
·mol ,则该温度下该反应的平衡常数K为
,则该温度下该反应的平衡常数K为______ 。
(1)研究发现,在
 低压合成甲醇反应(
低压合成甲醇反应(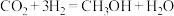 )中,Co氧化物负载的Mn氧化物纳米粒子催化剂具有高活性,显示出良好的应用前景。
)中,Co氧化物负载的Mn氧化物纳米粒子催化剂具有高活性,显示出良好的应用前景。Co基态原子核外电子排布式为
(2)我国科学家成功合成了世界上首个五氮阴离子盐
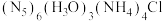 。
。①氮原子的价电子排布图为
②元素的基态气态原子得到一个电子形成气态负一价离子时所放出的能量称作第一电子亲和能(
 )。第二周期部分元素的
)。第二周期部分元素的 变化趋势如图所示。
变化趋势如图所示。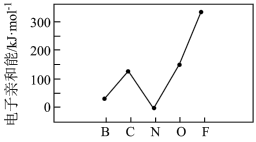
其中除氮元素外,其他元素的
 自左而右依次增大的原因是
自左而右依次增大的原因是 呈现异常的原因是
呈现异常的原因是(3)工业上常用CO与
 合成甲醇,热化学方程式为:
合成甲醇,热化学方程式为:
 kJ/mol在温度T时,向体积为2 L的恒容容器中充入物质的量之和为3 mol的CO和
kJ/mol在温度T时,向体积为2 L的恒容容器中充入物质的量之和为3 mol的CO和 ,发生反应:
,发生反应: ,反应达到平衡时
,反应达到平衡时 的体积分数(中)与
的体积分数(中)与 的关系如图所示。
的关系如图所示。
①当起始
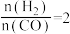 时,经过5 min达到平衡,CO的转化率为60%,则0~5 min内平均反应速率
时,经过5 min达到平衡,CO的转化率为60%,则0~5 min内平均反应速率
②当
 时,达到平衡后,
时,达到平衡后, 的体积分数可能是图像中的
的体积分数可能是图像中的(4)CO和
 是最为常见的两种碳氧化物,可以实现相互转化。已知由
是最为常见的两种碳氧化物,可以实现相互转化。已知由 生成CO的过程中存在如下基元反应:
生成CO的过程中存在如下基元反应: ,其正反应速率为
,其正反应速率为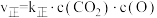 ,逆反应速率为
,逆反应速率为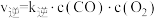 ,k为速率常数。2500K时,
,k为速率常数。2500K时,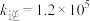 L·s
L·s ·mol
·mol ,
,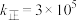 L·s
L·s ·mol
·mol ,则该温度下该反应的平衡常数K为
,则该温度下该反应的平衡常数K为
您最近一年使用:0次
名校
4 . 锌冶炼过程中产生的锌渣主要成分为铁酸锌(ZnFe2O4)和二氧化硅,以及少量的铜、铁、锌的氧化物和硫化物。利用酸溶的方法可溶出金属离子,使锌渣得到充分利用。.
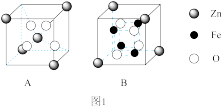
(1)铁酸锌酸溶。铁酸锌难溶于水,其晶胞由A、B结构按照1:1交替累积而成,如图1所示。将铁酸锌粉末投入到1L lmol·L-1H2SO4中,保温80 °C,匀速搅拌。浸出液中Fe3+和Zn2+的浓度随时间的变化如下表所示。
①酸溶时,溶出效率较高的金属离子是_________ ;
②B结构的化学式为________ ;
③铁酸锌和硫酸完全反应的离子方程式为_________ 。
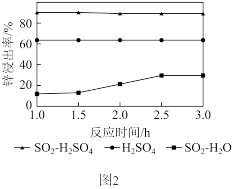
(2)锌渣酸溶。将锌渣分别在SO2- lmol·L1H2SO4、lmol·L-1H2SO4以及SO2-H2O三种体系中实验,均保持80°C,匀速搅拌,所得结果如图2所示。已知:FeS和ZnS可溶于稀硫酸,CuS和Cu2S不溶于稀硫酸。
 已知
已知
①在SO2-H2SO4体系中,Zn2+浸出率比其它两种体系明显要高的原因有__________ ;
②在SO2- H2SO4体系中,溶渣中Cu2S的质量会增加的原因是_________ 。
(1)铁酸锌酸溶。铁酸锌难溶于水,其晶胞由A、B结构按照1:1交替累积而成,如图1所示。将铁酸锌粉末投入到1L lmol·L-1H2SO4中,保温80 °C,匀速搅拌。浸出液中Fe3+和Zn2+的浓度随时间的变化如下表所示。

| 时间/h | 0.5 | 1.0 | 1.5 | 2.0 | 2.5 |
| c(Zn2+)/mol·L-1 | 0.10 | 0.11 | 0.15 | 0.21 | 0.21 |
| c(Fe3+)/mol·L-1 | 0.12 | 0.13 | 0.16 | 0.21 | 0.30 |
①酸溶时,溶出效率较高的金属离子是
②B结构的化学式为
③铁酸锌和硫酸完全反应的离子方程式为
(2)锌渣酸溶。将锌渣分别在SO2- lmol·L1H2SO4、lmol·L-1H2SO4以及SO2-H2O三种体系中实验,均保持80°C,匀速搅拌,所得结果如图2所示。已知:FeS和ZnS可溶于稀硫酸,CuS和Cu2S不溶于稀硫酸。
 已知
已知①在SO2-H2SO4体系中,Zn2+浸出率比其它两种体系明显要高的原因有
②在SO2- H2SO4体系中,溶渣中Cu2S的质量会增加的原因是
您最近一年使用:0次
名校
5 . VA族元素及其化合物在生产、生活中用途广泛。
(1)P4S3常用于制造火柴。试比较下列关系:原子半径P_______ S(填选项序号,下同),气态氢化物的稳定性P_______ S,含氧酸的酸性P_______ S。
a.大于 b. 小于 c.等于 d.无法确定
(2)As4S4俗称雄黄。As原子的核外电子排布式为:1s22s22p63s23p6_______ (补充完整),该原子核外有_______ 个未成对电子。
(3)NH4NO3受撞击分解:2NH4NO3=2N2+O2+ 4H2O,其中发生还原过程元素的变化为_______ ;若在反应中转移5mol电子,则反应产生的气体在标准状况下体积为_______ 。
(4)制取氮化硼(新型陶瓷材料)的反应必须在密闭的耐高温容器中进行:B2O3(S) + 2NH3(g) 2BN(s) + 3H2O(g) + Q (Q<0)。若反应在2L的密闭容器中进行,经5分钟反应炉内固体的质量减少60.0g,则用氨气来表示该反应在5分钟内的平均速率为
2BN(s) + 3H2O(g) + Q (Q<0)。若反应在2L的密闭容器中进行,经5分钟反应炉内固体的质量减少60.0g,则用氨气来表示该反应在5分钟内的平均速率为 _______ 。达到平衡后,增大反应容器体积,在平衡移动过程中,直至达新平衡,逆反应速率的变化状况为_______ 。
(5)白磷在氯气中燃烧可以得到PCl3和PCl5,其中气态PCl3分子属于极性分子,其空间构型为_______ 。PCl5水解生成两种酸,请写出发生反应的方程式_______ 。
(1)P4S3常用于制造火柴。试比较下列关系:原子半径P
a.大于 b. 小于 c.等于 d.无法确定
(2)As4S4俗称雄黄。As原子的核外电子排布式为:1s22s22p63s23p6
(3)NH4NO3受撞击分解:2NH4NO3=2N2+O2+ 4H2O,其中发生还原过程元素的变化为
(4)制取氮化硼(新型陶瓷材料)的反应必须在密闭的耐高温容器中进行:B2O3(S) + 2NH3(g)
 2BN(s) + 3H2O(g) + Q (Q<0)。若反应在2L的密闭容器中进行,经5分钟反应炉内固体的质量减少60.0g,则用氨气来表示该反应在5分钟内的平均速率为
2BN(s) + 3H2O(g) + Q (Q<0)。若反应在2L的密闭容器中进行,经5分钟反应炉内固体的质量减少60.0g,则用氨气来表示该反应在5分钟内的平均速率为 (5)白磷在氯气中燃烧可以得到PCl3和PCl5,其中气态PCl3分子属于极性分子,其空间构型为
您最近一年使用:0次
名校
解题方法
6 . 研究NO2、SO2、CO等大气污染气体的处理具有重要意义。
Ⅰ.利用反应:6NO2+8NH3 7N2+12H2O处理
7N2+12H2O处理
Ⅱ.一定条件下NO2与SO2可发生反应:NO2(g)+SO2(g) SO3(g)+NO(g)-Q (Q>0)
SO3(g)+NO(g)-Q (Q>0)
Ⅲ.CO可用于合成甲醇,反应方程式为:CO(g)+2H2(g) CH3OH(g)
CH3OH(g)
(1)硫离子的电子结构示意图为_____ ,氨气分子的电子式为______ ,氨气分子属于______ 分子(填“极性”或者“非极性”)。
(2)C、O、S这三种元素中属于同周期元素的非金属性由强到弱的顺序为_____________ ,能证明其递变规律的事实是_______ 。
a.最高价氧化物对应水化物的酸性 b.气态氢化物的沸点
c.单质与氢气反应的难易程度 d.其两两组合形成的化合物中元素的化合价
(3)对于Ⅰ中的反应,120℃时,该反应在一容积为2L的容器内反应,20min时达到平衡,10min时电子转移了1.2mol,则0~10min时,平均速率v(NO2)=______________ 。
(4)对于Ⅱ中的反应,将NO2与SO2以体积比1:2置于密闭容器中反应,下列能说明反应达到平衡状态的是______ 。
a.体系压强保持不变 b.NO2浓度保持不变
c.NO2和SO3的体积比保持不变 d.混合气体的平均相对分子质量保持不变
Ⅰ.利用反应:6NO2+8NH3
 7N2+12H2O处理
7N2+12H2O处理Ⅱ.一定条件下NO2与SO2可发生反应:NO2(g)+SO2(g)
 SO3(g)+NO(g)-Q (Q>0)
SO3(g)+NO(g)-Q (Q>0)Ⅲ.CO可用于合成甲醇,反应方程式为:CO(g)+2H2(g)
 CH3OH(g)
CH3OH(g)(1)硫离子的电子结构示意图为
(2)C、O、S这三种元素中属于同周期元素的非金属性由强到弱的顺序为
a.最高价氧化物对应水化物的酸性 b.气态氢化物的沸点
c.单质与氢气反应的难易程度 d.其两两组合形成的化合物中元素的化合价
(3)对于Ⅰ中的反应,120℃时,该反应在一容积为2L的容器内反应,20min时达到平衡,10min时电子转移了1.2mol,则0~10min时,平均速率v(NO2)=
(4)对于Ⅱ中的反应,将NO2与SO2以体积比1:2置于密闭容器中反应,下列能说明反应达到平衡状态的是
a.体系压强保持不变 b.NO2浓度保持不变
c.NO2和SO3的体积比保持不变 d.混合气体的平均相对分子质量保持不变
您最近一年使用:0次
2020-09-20更新
|
608次组卷
|
4卷引用:湖南省湘西土家族苗族自治州花垣县边城高级中学2020-2021学年高二上学期入学考试化学试题
湖南省湘西土家族苗族自治州花垣县边城高级中学2020-2021学年高二上学期入学考试化学试题(已下线)第二章 化学反应速率与化学平衡(能力提升)-2020-2021学年高二化学单元测试定心卷(人教版2019选择性必修一)辽宁省辽阳市第二高级中学2022-2023学年高二上学期12月月考化学试题河南省周口恒大中学2023-2024学年高二上学期9月月考化学试题
7 . 氮化硅(Si3N4)耐高温、硬度大,可用石英与焦炭在1400~1450℃的氮气中合成:3SiO2(s)+6C(s)+2N2(g)=Si3N4(s)+6CO(g)-Q(Q>0),在一定条件下,向10L密闭容器中加入反应物,10min后达到平衡。完成下列问题:
(1)上述反应所涉及的属于第三周期的元素,其原子的最外层电子轨道表示式为______ 。其中一种元素的原子核外s电子数与p电子数相等,其原子的核外电子能量不同的有_____ 种。
(2)上述反应混合物中的极性分子是______ ,写出非极性分子的电子式________ 。分析用氮化硅制造轴承和发动机中耐热部件的原因是___________ 。
(3)该反应的平衡常数表达式为__________ 。可以提高二氧化硅转化率的措施是________ (任写一条),该措施对平衡常数的影响为__________ (填“增大”、“减小”或“保持不变”)。
(4)测得平衡时固体质量减少了5.6g,则用氮气表示的平均反应速率为__________ 。
(1)上述反应所涉及的属于第三周期的元素,其原子的最外层电子轨道表示式为
(2)上述反应混合物中的极性分子是
(3)该反应的平衡常数表达式为
(4)测得平衡时固体质量减少了5.6g,则用氮气表示的平均反应速率为
您最近一年使用:0次
解题方法
8 . 科学家研究出一种以天然气为燃料的“燃烧前捕获系统”,其简单流程如图所示(条件及部分物质未标出)。
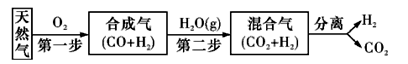
(1) 已知:CH4 、CO, 、H2的燃烧热分别为890. 3 kJ·mol-1、283. 0 kJ·mol-1、285. 8 kJ·mol-1。则上述流程中第一步反应2CH4(g)+O2(g) 2CO(g)+4H2(g)的△H=
2CO(g)+4H2(g)的△H=_________
(2)工业上可用H2和CO2制备甲醇,其反应方程式为CO2 ( g) + 3H2 (g) CH3OH(g)+ H2O(g)。某温度下,将1 mol CO2和3 mol H2充人体积不变的2L密闭容器中,发生上述反应,测得不同时刻反应前后的压强关系如下表所示:
CH3OH(g)+ H2O(g)。某温度下,将1 mol CO2和3 mol H2充人体积不变的2L密闭容器中,发生上述反应,测得不同时刻反应前后的压强关系如下表所示:

①用H2表示的前2h的平均反应速率v(H2)=_________
②该温度下,CO2的平衡转化率为______________
(3)在300℃、8 MPa下,将CO2和H2按物质的量之比1:3通入一密闭容器中发生(2)中反应,达到平衡时,测得CO2的平衡转化率为50%,则该反应条件下的平衡常数为Kp=_____ (用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
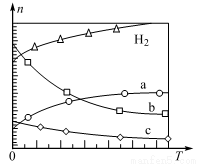
(4)CO2经催化加氢可合成低碳烯烃:2CO2 ( g)+6H2 (g) C2H4 (g)+4H2O(g) △H。在0 .1 MPa时,按
C2H4 (g)+4H2O(g) △H。在0 .1 MPa时,按 (CO2):
(CO2): (H2)=1:3投料,如图所示为不同温度(
(H2)=1:3投料,如图所示为不同温度( )下,平衡时四种气态物质的物质的量(
)下,平衡时四种气态物质的物质的量( )的关系。
)的关系。
①该反应的△H_______ 0(填“>”或“<”)。
②曲线 表示的物质为
表示的物质为______ (填化学式)。

(1) 已知:CH4 、CO, 、H2的燃烧热分别为890. 3 kJ·mol-1、283. 0 kJ·mol-1、285. 8 kJ·mol-1。则上述流程中第一步反应2CH4(g)+O2(g)
 2CO(g)+4H2(g)的△H=
2CO(g)+4H2(g)的△H=(2)工业上可用H2和CO2制备甲醇,其反应方程式为CO2 ( g) + 3H2 (g)
 CH3OH(g)+ H2O(g)。某温度下,将1 mol CO2和3 mol H2充人体积不变的2L密闭容器中,发生上述反应,测得不同时刻反应前后的压强关系如下表所示:
CH3OH(g)+ H2O(g)。某温度下,将1 mol CO2和3 mol H2充人体积不变的2L密闭容器中,发生上述反应,测得不同时刻反应前后的压强关系如下表所示:

①用H2表示的前2h的平均反应速率v(H2)=
②该温度下,CO2的平衡转化率为
(3)在300℃、8 MPa下,将CO2和H2按物质的量之比1:3通入一密闭容器中发生(2)中反应,达到平衡时,测得CO2的平衡转化率为50%,则该反应条件下的平衡常数为Kp=
(4)CO2经催化加氢可合成低碳烯烃:2CO2 ( g)+6H2 (g)
 C2H4 (g)+4H2O(g) △H。在0 .1 MPa时,按
C2H4 (g)+4H2O(g) △H。在0 .1 MPa时,按 (CO2):
(CO2): (H2)=1:3投料,如图所示为不同温度(
(H2)=1:3投料,如图所示为不同温度( )下,平衡时四种气态物质的物质的量(
)下,平衡时四种气态物质的物质的量( )的关系。
)的关系。①该反应的△H
②曲线
 表示的物质为
表示的物质为
您最近一年使用:0次
真题
解题方法
9 . 合成氨工艺的一个重要工序是铜洗,其目的是用铜液[醋酸二氨合铜(I)、氨水]吸收在生产过程中产生的CO和CO2等气体。铜液吸收CO的反应是放热反应,其反应方程式为:
Cu(NH3)2Ac+CO+NH3 [Cu(NH3)3CO]Ac
[Cu(NH3)3CO]Ac
完成下列填空:
(1)如果要提高上述反应的反应速率,可以采取的措施是_________ 。(选填编号)
a.减压 b.增加NH3的浓度 c.升温 d.及时移走产物
(2)铜液中的氨可吸收二氧化碳,写出该反应的化学方程式_______________
(3)简述铜液吸收CO及铜液再生的操作步骤(注明吸收和再生的条件)。
__________________________________________
(4)铜液的组成元素中,短周期元素原子半径从大到小的排列顺序为_______________ 。其中氮元素原子最外层电子排布的轨道表达式是_________________________ 。通过比较_____________ 可判断氮、磷两种非金属元素的非金属性强弱。
(5)已知CS2与CO2分子结构相似,CS2的电子式是____________ 。CS2熔点高于CO2,其原因是__________ 。
Cu(NH3)2Ac+CO+NH3
 [Cu(NH3)3CO]Ac
[Cu(NH3)3CO]Ac完成下列填空:
(1)如果要提高上述反应的反应速率,可以采取的措施是
a.减压 b.增加NH3的浓度 c.升温 d.及时移走产物
(2)铜液中的氨可吸收二氧化碳,写出该反应的化学方程式
(3)简述铜液吸收CO及铜液再生的操作步骤(注明吸收和再生的条件)。
(4)铜液的组成元素中,短周期元素原子半径从大到小的排列顺序为
(5)已知CS2与CO2分子结构相似,CS2的电子式是
您最近一年使用:0次
2016-12-09更新
|
2469次组卷
|
4卷引用:2014年全国普通高等学校招生统一考试理科综合能力测试化学(上海卷)
2014年全国普通高等学校招生统一考试理科综合能力测试化学(上海卷)2020届高三化学二轮物质结构题型专攻——原子结构与性质【基础专练】(已下线)上海市中原中学2015届高三第二次月考化学试题湖南省株洲市第十三中学2023-2024学年高二上学期1月期末考试化学试题



