1 . 二氧化碳加氢制甲烷和甲烷重整对碳资源利用具有重要的战略意义。回答下列问题:
I.CO2加氢选择合成甲烷的主要反应如下:
①CO2(g)+4H2 CH4(g)+2H2O(g) △H1(298K)
CH4(g)+2H2O(g) △H1(298K)
②CO2(g)+H2(g) CO(g)+H2O(g) △H2(298K)
CO(g)+H2O(g) △H2(298K)
③2CO(g)+2H2(g) CO2(g)+CH4(g) △H3(298K)
CO2(g)+CH4(g) △H3(298K)
在一定温度下,由最稳定单质生成1mol某物质的焓变叫做该物质的标准摩尔生成焓,如表为298K时几种物质的标准摩尔生成焓。
(1)有利于反应①自发进行的条件是_______ (填“高温”或“低温”);根据表中数据计算反应②的焓变△H2(298K)=_______ kJ·mol-1。
(2)在一定条件下,向体积为VL的恒容密闭容器中通入1molCO2和4molH2发生上述反应,反应20min容器内反应达到平衡时,容器中CH4为amol,CO为bmol,以H2表示的0~20min内平均反应速率v(H2)=_______ mol·L-1·min-1(用含a、b、V的代数式表示,下同),此时H2O(g)的浓度为_______ mol·L-1,反应II的平衡常数为_______ (列出计算式)。
II.甲烷重整工艺主要包括甲烷水蒸气重整制氢、甲烷部分氧化重整制氢、甲烷二氧化碳重整制氢、甲烷三重整制氢等。
(3)甲烷三重整制氢的逆反应CO(g)+3H2 CH4(g)+H2O(g)。合成总反应在起始物
CH4(g)+H2O(g)。合成总反应在起始物 =3时,在不同条件下达到平衡,设体系中CH4的物质的量分数为x(CH4),在t=250℃下的x(CH4)-p、在p=5×105Pa下的x(CH4)-t如图所示。
=3时,在不同条件下达到平衡,设体系中CH4的物质的量分数为x(CH4),在t=250℃下的x(CH4)-p、在p=5×105Pa下的x(CH4)-t如图所示。
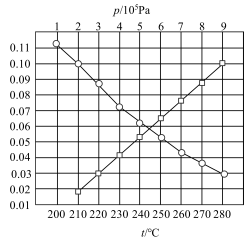
①当CO的平衡转化率为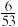 时,反应条件可能是
时,反应条件可能是_______ 。
②甲烷三重整制氢工业一般将反应温度设置为750℃~920℃,将反应压力设置为2~3MPa并向转化炉内通入空气或氧气,通入空气或氧气的目的是_______ 。
I.CO2加氢选择合成甲烷的主要反应如下:
①CO2(g)+4H2
 CH4(g)+2H2O(g) △H1(298K)
CH4(g)+2H2O(g) △H1(298K)②CO2(g)+H2(g)
 CO(g)+H2O(g) △H2(298K)
CO(g)+H2O(g) △H2(298K)③2CO(g)+2H2(g)
 CO2(g)+CH4(g) △H3(298K)
CO2(g)+CH4(g) △H3(298K)在一定温度下,由最稳定单质生成1mol某物质的焓变叫做该物质的标准摩尔生成焓,如表为298K时几种物质的标准摩尔生成焓。
| 物质 | H2(g) | O2(g) | CO(g) | CO2(g) | H2O(g) | CH4(g) |
| 标准摩尔生成焓(kJ·mol-1) | 0 | 0 | -110.5 | -393.5 | -241.8 | -74.81 |
(1)有利于反应①自发进行的条件是
(2)在一定条件下,向体积为VL的恒容密闭容器中通入1molCO2和4molH2发生上述反应,反应20min容器内反应达到平衡时,容器中CH4为amol,CO为bmol,以H2表示的0~20min内平均反应速率v(H2)=
II.甲烷重整工艺主要包括甲烷水蒸气重整制氢、甲烷部分氧化重整制氢、甲烷二氧化碳重整制氢、甲烷三重整制氢等。
(3)甲烷三重整制氢的逆反应CO(g)+3H2
 CH4(g)+H2O(g)。合成总反应在起始物
CH4(g)+H2O(g)。合成总反应在起始物 =3时,在不同条件下达到平衡,设体系中CH4的物质的量分数为x(CH4),在t=250℃下的x(CH4)-p、在p=5×105Pa下的x(CH4)-t如图所示。
=3时,在不同条件下达到平衡,设体系中CH4的物质的量分数为x(CH4),在t=250℃下的x(CH4)-p、在p=5×105Pa下的x(CH4)-t如图所示。
①当CO的平衡转化率为
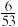 时,反应条件可能是
时,反应条件可能是②甲烷三重整制氢工业一般将反应温度设置为750℃~920℃,将反应压力设置为2~3MPa并向转化炉内通入空气或氧气,通入空气或氧气的目的是
您最近一年使用:0次
解题方法
2 . 二氧化碳甲烷化助力我国2060年前实现“碳中和”,其中涉及的主要反应如下:
反应Ⅰ:CO₂(g)+4H₂(g) CH₄(g)+2H₂O(g) △H=-164.7kJ·mol⁻¹
CH₄(g)+2H₂O(g) △H=-164.7kJ·mol⁻¹
反应Ⅱ:CO₂(g)+H₂(g) CO(g)+H₂O(g) △H=+41.2kJ·mol⁻¹
CO(g)+H₂O(g) △H=+41.2kJ·mol⁻¹
回答下列问题:
(1)由热化学方程式可知,反应Ⅰ属于反应_______(填写序号)
(2)动力学研究:在多个1L恒容密闭装置中,分别充入1molCO₂和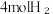 发生上述反应Ⅰ,在不同温度下反应到10分钟时,测得H₂转化率与温度关系如图1所示。已知该反应的速率方程为
发生上述反应Ⅰ,在不同温度下反应到10分钟时,测得H₂转化率与温度关系如图1所示。已知该反应的速率方程为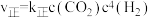 ,
,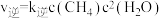 ,其中
,其中 、
、 为速率常数,只受温度影响。
为速率常数,只受温度影响。

①图1中,至a点的H₂平均反应速率为_______  。
。
②图1中,v(a)逆_______ v(c)逆(填“>”、“=”或“<”)。
③图1中c点的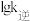 对应的是图2中的
对应的是图2中的_______ 点。
④图1中a点的v正,v逆与a点的K(平衡常数)、Q(浓度商)的关系是
______ 。
(3)热动力学研究:向10L的恒压密闭装置中充入5mol CO₂和20mol H₂,在不同温度下同时发生上述反应Ⅰ和反应Ⅱ,得到平衡时各含碳物质的物质的量n(X)与温度T的关系如下图所示。

①当反应Ⅰ和反应Ⅱ均达到化学平衡状态时,维持温度不变,压缩装置体积,则反应Ⅱ的平衡移动方向是_______ (填序号)。
A.正向移动 B.逆向移动 C.不移动 D.无法确定
②曲线Z表示的是_______ (填写含碳元素物质的化学式)的物质的量与温度的关系,简述其在温度段500K~800K物质的量增大的原因_______ 。
③800K时,反应Ⅱ的平衡常数为_______ (计算结果保留两位有效数字)。
反应Ⅰ:CO₂(g)+4H₂(g)
 CH₄(g)+2H₂O(g) △H=-164.7kJ·mol⁻¹
CH₄(g)+2H₂O(g) △H=-164.7kJ·mol⁻¹反应Ⅱ:CO₂(g)+H₂(g)
 CO(g)+H₂O(g) △H=+41.2kJ·mol⁻¹
CO(g)+H₂O(g) △H=+41.2kJ·mol⁻¹回答下列问题:
(1)由热化学方程式可知,反应Ⅰ属于反应_______(填写序号)
| A.高温自发 | B.低温自发 | C.恒自发 | D.恒不自发 |
 发生上述反应Ⅰ,在不同温度下反应到10分钟时,测得H₂转化率与温度关系如图1所示。已知该反应的速率方程为
发生上述反应Ⅰ,在不同温度下反应到10分钟时,测得H₂转化率与温度关系如图1所示。已知该反应的速率方程为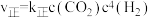 ,
,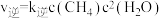 ,其中
,其中 、
、 为速率常数,只受温度影响。
为速率常数,只受温度影响。
①图1中,至a点的H₂平均反应速率为
 。
。②图1中,v(a)逆
③图1中c点的
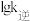 对应的是图2中的
对应的是图2中的④图1中a点的v正,v逆与a点的K(平衡常数)、Q(浓度商)的关系是

(3)热动力学研究:向10L的恒压密闭装置中充入5mol CO₂和20mol H₂,在不同温度下同时发生上述反应Ⅰ和反应Ⅱ,得到平衡时各含碳物质的物质的量n(X)与温度T的关系如下图所示。

①当反应Ⅰ和反应Ⅱ均达到化学平衡状态时,维持温度不变,压缩装置体积,则反应Ⅱ的平衡移动方向是
A.正向移动 B.逆向移动 C.不移动 D.无法确定
②曲线Z表示的是
③800K时,反应Ⅱ的平衡常数为
您最近一年使用:0次
名校
3 . 下列说法错误的是
| A.某吸热反应能自发进行,因此该反应是熵增反应 |
B. 水溶液中含有 水溶液中含有 ,因此 ,因此 溶液不能存放于玻璃试剂瓶中 溶液不能存放于玻璃试剂瓶中 |
C.反应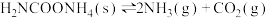 在恒温恒容密闭容器中进行,当混合气体的平均相对分子质量不变时,该反应达到化学平衡状态 在恒温恒容密闭容器中进行,当混合气体的平均相对分子质量不变时,该反应达到化学平衡状态 |
D.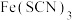 溶液中加入固体 溶液中加入固体 后颜色变深的原因可用勒夏特列原理来解释 后颜色变深的原因可用勒夏特列原理来解释 |
您最近一年使用:0次
2022-01-21更新
|
258次组卷
|
2卷引用:湖北省荆州中学2022-2023学年高二上学期期末考试化学试题
4 . 氨气中氢含量高,是一种优良的小分子储氢载体,且安全、易储运,可通过下面两种方法由氨气得到氢气。
方法I:氨热分解法制氢气
相关化学键的键能数据
一定温度下,利用催化剂将 分解为
分解为 和
和 。回答下列问题:
。回答下列问题:
(1)反应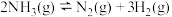

_______  ;
;
(2)已知该反应的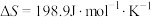 ,在下列哪些温度下反应能自发进行?
,在下列哪些温度下反应能自发进行?_______ (填标号)
A.25℃ B.125℃ C.225℃ D.325℃
(3)某兴趣小组对该反应进行了实验探究。在一定温度和催化剂的条件下,将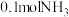 通入3L的密闭容器中进行反应(此时容器内总压为200kPa),各物质的分压随时间的变化曲线如图所示。
通入3L的密闭容器中进行反应(此时容器内总压为200kPa),各物质的分压随时间的变化曲线如图所示。
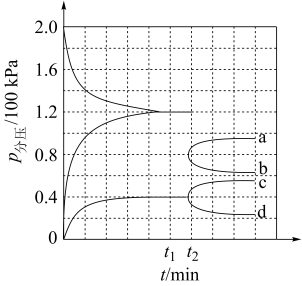
①若保持容器体积不变, 时反应达到平衡,用
时反应达到平衡,用 的浓度变化表示
的浓度变化表示 时间内的反应速率
时间内的反应速率
_______  (用含
(用含 的代数式表示)
的代数式表示)
② 时将容器体积迅速缩小至原来的一半并保持不变,图中能正确表示压缩后
时将容器体积迅速缩小至原来的一半并保持不变,图中能正确表示压缩后 分压变化趋势的曲线是
分压变化趋势的曲线是_______ (用图中a、b、c、d表示),理由是_______ ;
③在该温度下,反应的标准平衡常数
_______ 。(已知:分压=总压×该组分物质的量分数,对于反应 ,
, ,其中
,其中 ,
, 、
、 、
、 、
、 为各组分的平衡分压)。
为各组分的平衡分压)。
方法Ⅱ:氨电解法制氢气
利用电解原理,将氨转化为高纯氢气,其装置如图所示。
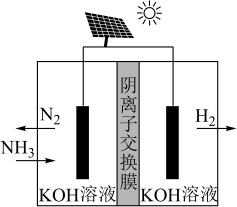
(4)电解过程中 的移动方向为
的移动方向为_______ (填“从左往右”或“从右往左”);
(5)阳极的电极反应式为_______ 。
方法I:氨热分解法制氢气
相关化学键的键能数据
| 化学键 |  |  |  |
键能 | 946 | 436.0 | 390.8 |
 分解为
分解为 和
和 。回答下列问题:
。回答下列问题:(1)反应
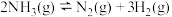

 ;
;(2)已知该反应的
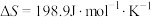 ,在下列哪些温度下反应能自发进行?
,在下列哪些温度下反应能自发进行?A.25℃ B.125℃ C.225℃ D.325℃
(3)某兴趣小组对该反应进行了实验探究。在一定温度和催化剂的条件下,将
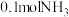 通入3L的密闭容器中进行反应(此时容器内总压为200kPa),各物质的分压随时间的变化曲线如图所示。
通入3L的密闭容器中进行反应(此时容器内总压为200kPa),各物质的分压随时间的变化曲线如图所示。
①若保持容器体积不变,
 时反应达到平衡,用
时反应达到平衡,用 的浓度变化表示
的浓度变化表示 时间内的反应速率
时间内的反应速率
 (用含
(用含 的代数式表示)
的代数式表示)②
 时将容器体积迅速缩小至原来的一半并保持不变,图中能正确表示压缩后
时将容器体积迅速缩小至原来的一半并保持不变,图中能正确表示压缩后 分压变化趋势的曲线是
分压变化趋势的曲线是③在该温度下,反应的标准平衡常数

 ,
, ,其中
,其中 ,
, 、
、 、
、 、
、 为各组分的平衡分压)。
为各组分的平衡分压)。方法Ⅱ:氨电解法制氢气
利用电解原理,将氨转化为高纯氢气,其装置如图所示。

(4)电解过程中
 的移动方向为
的移动方向为(5)阳极的电极反应式为
您最近一年使用:0次
2021-06-09更新
|
10661次组卷
|
14卷引用:湖北省鄂西南三校2023-2024学年高二下学期3月联考化学试题
湖北省鄂西南三校2023-2024学年高二下学期3月联考化学试题2021年新高考湖南化学高考真题(已下线)考点19 化学平衡常数 化学反应进行的方向-备战2022年高考化学一轮复习考点帮(全国通用)(已下线)考点19 化学平衡常数 化学反应进行的方向-备战2022年高考化学一轮复习考点帮(浙江专用)2021年湖南省高考化学试卷变式题11-19(已下线)专题12 化学反应原理综合题—2022年高考化学二轮复习讲练测(全国版)-练习(已下线)回归教材重难点09 化学反应原理综合-【查漏补缺】2022年高考化学三轮冲刺过关(新高考专用)(已下线)押新高考卷17题 化学反应原理综合题-备战2022年高考化学临考题号押题(新高考通版)天津市第一中学2022届高三下学期5月月考化学试题(已下线)专题15 化学反应原理综合题-三年(2020-2022)高考真题分项汇编(已下线)考点23 化学平衡常数-备战2023年高考化学一轮复习考点帮(全国通用)(已下线)专题17 原理综合题(已下线)专题17 原理综合题(已下线)专题15 化学反应原理综合题-2023年高考化学真题题源解密(全国通用)
12-13高三上·湖北·期中
解题方法
5 . 已知H2(g)+Br2(l)=2HBr(g) △H=—72 kJ/mol,蒸发1mol Br2(l)需要吸收的能量为30kJ,其它相关数据如下表:
则下列说法正确的是( )
| H2(g) | Br2(g) | HBr(g) | |
| 1mol分子中的化学键断裂时需要吸收的能量/kJ | 436 | a | 369 |
则下列说法正确的是( )
| A.Br2(l)=Br2(g) △S<0 |
| B.Br2(l)=Br2(g) △H=—30 kJ/mol |
| C.H-H键的键能为436 kJ |
| D.a=200 |
您最近一年使用:0次



