二氧化碳甲烷化助力我国2060年前实现“碳中和”,其中涉及的主要反应如下:
反应Ⅰ:CO₂(g)+4H₂(g) CH₄(g)+2H₂O(g) △H=-164.7kJ·mol⁻¹
CH₄(g)+2H₂O(g) △H=-164.7kJ·mol⁻¹
反应Ⅱ:CO₂(g)+H₂(g) CO(g)+H₂O(g) △H=+41.2kJ·mol⁻¹
CO(g)+H₂O(g) △H=+41.2kJ·mol⁻¹
回答下列问题:
(1)由热化学方程式可知,反应Ⅰ属于反应_______(填写序号)
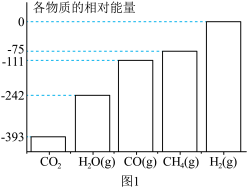
(2)动力学研究:在多个1L恒容密闭装置中,分别充入1molCO₂和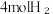 发生上述反应Ⅰ,在不同温度下反应到10分钟时,测得H₂转化率与温度关系如图1所示。已知该反应的速率方程为
发生上述反应Ⅰ,在不同温度下反应到10分钟时,测得H₂转化率与温度关系如图1所示。已知该反应的速率方程为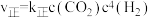 ,
,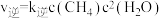 ,其中
,其中 、
、 为速率常数,只受温度影响。
为速率常数,只受温度影响。

①图1中,至a点的H₂平均反应速率为_______  。
。
②图1中,v(a)逆_______ v(c)逆(填“>”、“=”或“<”)。
③图1中c点的 对应的是图2中的
对应的是图2中的_______ 点。
④图1中a点的v正,v逆与a点的K(平衡常数)、Q(浓度商)的关系是
______ 。
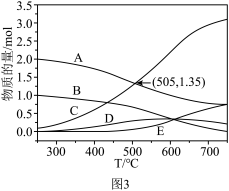
(3)热动力学研究:向10L的恒压密闭装置中充入5mol CO₂和20mol H₂,在不同温度下同时发生上述反应Ⅰ和反应Ⅱ,得到平衡时各含碳物质的物质的量n(X)与温度T的关系如下图所示。

①当反应Ⅰ和反应Ⅱ均达到化学平衡状态时,维持温度不变,压缩装置体积,则反应Ⅱ的平衡移动方向是_______ (填序号)。
A.正向移动 B.逆向移动 C.不移动 D.无法确定
②曲线Z表示的是_______ (填写含碳元素物质的化学式)的物质的量与温度的关系,简述其在温度段500K~800K物质的量增大的原因_______ 。
③800K时,反应Ⅱ的平衡常数为_______ (计算结果保留两位有效数字)。
反应Ⅰ:CO₂(g)+4H₂(g)
 CH₄(g)+2H₂O(g) △H=-164.7kJ·mol⁻¹
CH₄(g)+2H₂O(g) △H=-164.7kJ·mol⁻¹反应Ⅱ:CO₂(g)+H₂(g)
 CO(g)+H₂O(g) △H=+41.2kJ·mol⁻¹
CO(g)+H₂O(g) △H=+41.2kJ·mol⁻¹回答下列问题:
(1)由热化学方程式可知,反应Ⅰ属于反应_______(填写序号)
| A.高温自发 | B.低温自发 | C.恒自发 | D.恒不自发 |
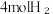 发生上述反应Ⅰ,在不同温度下反应到10分钟时,测得H₂转化率与温度关系如图1所示。已知该反应的速率方程为
发生上述反应Ⅰ,在不同温度下反应到10分钟时,测得H₂转化率与温度关系如图1所示。已知该反应的速率方程为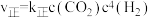 ,
,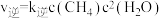 ,其中
,其中 、
、 为速率常数,只受温度影响。
为速率常数,只受温度影响。
①图1中,至a点的H₂平均反应速率为
 。
。②图1中,v(a)逆
③图1中c点的
 对应的是图2中的
对应的是图2中的④图1中a点的v正,v逆与a点的K(平衡常数)、Q(浓度商)的关系是

(3)热动力学研究:向10L的恒压密闭装置中充入5mol CO₂和20mol H₂,在不同温度下同时发生上述反应Ⅰ和反应Ⅱ,得到平衡时各含碳物质的物质的量n(X)与温度T的关系如下图所示。

①当反应Ⅰ和反应Ⅱ均达到化学平衡状态时,维持温度不变,压缩装置体积,则反应Ⅱ的平衡移动方向是
A.正向移动 B.逆向移动 C.不移动 D.无法确定
②曲线Z表示的是
③800K时,反应Ⅱ的平衡常数为
更新时间:2022/11/15 22:53:29
|
相似题推荐
解答题-原理综合题
|
困难
(0.15)
【推荐1】国际能源界高端会议“剑桥能源周”于3月6日至10日在美国“能源之都”休斯敦召开,重点讨论如何应对能源安全和能源转型的双重挑战。将甲烷催化裂解制备乙烯、乙炔以增加化工原料。其中涉及以下反应:
反应Ⅰ:2CH4(g) C2H2(g)+3H2(g)
C2H2(g)+3H2(g)  H1= +376.4 kJ/mol
H1= +376.4 kJ/mol
反应Ⅱ:C2H2(g)+H2(g) C2H4(g)
C2H4(g)  H2= -174. 4kJ/mol
H2= -174. 4kJ/mol
反应Ⅲ:2CH4(g) C2H4(g)+2H2(g)
C2H4(g)+2H2(g)  H3
H3
(1) H3=
H3=_______ 。
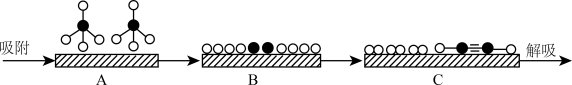
(2)甲烷在固体催化剂表面发生反应Ⅰ的过程如图所示。_______ 。
②某温度下,反应1的v正=k正·p2(CH4)、v逆=k逆·p(C2H2)·p3(H2),(k为速率常数),部分数据如表所示。
试计算表中P2 =_______ ;温度升高,速率常数增大的倍数:k正_______ k逆(填“>”“<“或“=”)。
(3)某温度下,向恒容密闭容器中充入一定量CH4和催化剂,仅发生反应Ⅲ。
①测得平衡时p(H2):p(CH4)=2:1,CH4的平衡转化率为_______ (保留3位有效数字);写出反应Ⅲ的平衡常数表达式K=_______ 。
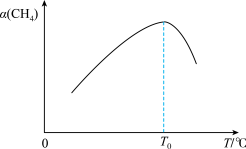
②若升高反应体系温度,在相同时间内测得甲烷的转化率与温度的关系如图所示。T0℃之后甲烷转化率减小,试分析可能的原因:_______ 。_______ 。
反应Ⅰ:2CH4(g)
 C2H2(g)+3H2(g)
C2H2(g)+3H2(g)  H1= +376.4 kJ/mol
H1= +376.4 kJ/mol反应Ⅱ:C2H2(g)+H2(g)
 C2H4(g)
C2H4(g)  H2= -174. 4kJ/mol
H2= -174. 4kJ/mol 反应Ⅲ:2CH4(g)
 C2H4(g)+2H2(g)
C2H4(g)+2H2(g)  H3
H3(1)
 H3=
H3=(2)甲烷在固体催化剂表面发生反应Ⅰ的过程如图所示。
②某温度下,反应1的v正=k正·p2(CH4)、v逆=k逆·p(C2H2)·p3(H2),(k为速率常数),部分数据如表所示。
| p(C2H2)/MPa | p(H2)/MPa | v逆/(MPa·min-1) |
| 0.05 | p1 | 4.8 |
| p2 | p1 | 19.2 |
| p2 | 0.15 | 8.1 |
(3)某温度下,向恒容密闭容器中充入一定量CH4和催化剂,仅发生反应Ⅲ。
①测得平衡时p(H2):p(CH4)=2:1,CH4的平衡转化率为
②若升高反应体系温度,在相同时间内测得甲烷的转化率与温度的关系如图所示。T0℃之后甲烷转化率减小,试分析可能的原因:
您最近一年使用:0次
解答题-原理综合题
|
困难
(0.15)
名校
解题方法
【推荐2】研究含氮元素物质的反应对生产、生活、科研等方面具有重要的意义。
(1)发射“神舟十三”号的火箭推进剂为液态四氧化二氮和液态偏二甲肼(C2H8N2)。
已知:①C2H8N2(l)+4O2(g)=2CO2(g)+N2(g)+4H2O(l) ΔH1=-2765.0kJ/mol
②2O2(g) +N2(g)=N2O4(l) ΔH2=-19.5kJ/mol
③H2O(g)= H2O(l) ΔH3=-44.0kJ/mol
则C2H8N2(1)+2N2O4(1)=3N2(g)+2CO2(g)+4H2O(g)的ΔH为_______ 。
(2)碘蒸气存在能大幅度提高N2O的分解速率,反应历程为:
第一步:I2(g)→2I(g)(快反应)
第二步:I(g)+N2O(g)→N2(g)+IO(g)(慢反应)
第三步:IO(g)+N2O(g)→N2(g)+O2(g)+I2(g)(快反应)
实验表明,含碘时N2O分解速率方程v=k·c(N2O)·[c(I2)]0.5(k为速率常数)。下列表述正确的是_______
(3)为避免汽车尾气中的氮氧化合物对大气的污染,需给汽车安装尾气净化装置。在净化装置中CO和NO发生反应2NO(g)+2CO(g)=N2(g)+2CO2(g) ΔH=-746.8kJ-mol-1。实验测得:v正=k正·p2(NO)·p2(CO),v逆=k逆·p(N2)·p2(CO2)。其中k正、k逆分别为正、逆反应速率常数,只与温度有关;p为气体分压(分压=物质的量分数x总压)。
①达到平衡后,仅升高温度,k正增大的倍数_______ (填“大于”“小于”或“等于”)k逆增大的倍数。
②一定温度下在刚性密闭容器中充入CO、NO和N2物质的量之比为2:2:1,压强为p0kPa。达平衡时压强为0.9p0kPa,则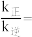
_______ 。
(4)我国科技人员计算了在一定温度范围内下列反应的平衡常数Kp:
①3N2H4(1)=4NH3(g)+N2(g) ΔH1 Kp1
②4NH3(g)=2N2(g)+6H2(g) ΔH2 Kp2
绘制pKp1-T和pKp2-T的线性关系图如图所示:(已知:pKp=-1gKp)
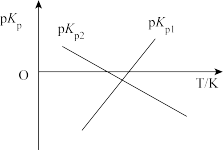
①由图可知,ΔH1_______ 0(填“>”或“<”)
②反应3N2H4(1)=3N2(g)+6H2(g)的K=_______ (用Kp1、Kp2表示);该反应的ΔH_______ 0(填“>”或“<”),写出推理过程_______
(1)发射“神舟十三”号的火箭推进剂为液态四氧化二氮和液态偏二甲肼(C2H8N2)。
已知:①C2H8N2(l)+4O2(g)=2CO2(g)+N2(g)+4H2O(l) ΔH1=-2765.0kJ/mol
②2O2(g) +N2(g)=N2O4(l) ΔH2=-19.5kJ/mol
③H2O(g)= H2O(l) ΔH3=-44.0kJ/mol
则C2H8N2(1)+2N2O4(1)=3N2(g)+2CO2(g)+4H2O(g)的ΔH为
(2)碘蒸气存在能大幅度提高N2O的分解速率,反应历程为:
第一步:I2(g)→2I(g)(快反应)
第二步:I(g)+N2O(g)→N2(g)+IO(g)(慢反应)
第三步:IO(g)+N2O(g)→N2(g)+O2(g)+I2(g)(快反应)
实验表明,含碘时N2O分解速率方程v=k·c(N2O)·[c(I2)]0.5(k为速率常数)。下列表述正确的是_______
| A.N2O分解反应中,k值与碘蒸气浓度大小有关 |
| B.v(第二步的逆反应)<v(第三步反应) |
| C.IO为反应的催化剂 |
| D.第二步活化能比第三步大 |
①达到平衡后,仅升高温度,k正增大的倍数
②一定温度下在刚性密闭容器中充入CO、NO和N2物质的量之比为2:2:1,压强为p0kPa。达平衡时压强为0.9p0kPa,则
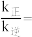
(4)我国科技人员计算了在一定温度范围内下列反应的平衡常数Kp:
①3N2H4(1)=4NH3(g)+N2(g) ΔH1 Kp1
②4NH3(g)=2N2(g)+6H2(g) ΔH2 Kp2
绘制pKp1-T和pKp2-T的线性关系图如图所示:(已知:pKp=-1gKp)

①由图可知,ΔH1
②反应3N2H4(1)=3N2(g)+6H2(g)的K=
您最近一年使用:0次
解答题-原理综合题
|
困难
(0.15)
名校
解题方法
【推荐3】碘及其化合物在合成杀菌剂、药物等方面具有广泛用途。科学家对反应2HI(g) H2(g)+I2(g)进行了大量研究。回答下列问题:
H2(g)+I2(g)进行了大量研究。回答下列问题:
(1)在632K时,气体混合物中碘化氢的物质的量分数x(HI)与反应时间t的关系如表:
①根据上述实验结果,该反应的平衡常数K为_____ (可用分数表示)。
②上述反应中,正反应速率为v正=k正•x2(HI),逆反应速率为v逆=k逆•x(H2)•x(I2),其中k正、k逆为速率常数,则k逆为_____ (以K和k正表示)。若k正=0.0025min-1,则k逆=_____ min-1。
(2)实验测定和计算了在136℃~180℃范围内下列反应的分压平衡常数Kp。
I.Br2(g)+2HI(g) 2HBr(g)+I2(g) Kp1
2HBr(g)+I2(g) Kp1
II.2HBr(g) H2(g)+Br2(g) Kp2
H2(g)+Br2(g) Kp2
得到lgKp1~ 和lgKp2~
和lgKp2~ 均为线性关系,如图所示:
均为线性关系,如图所示:
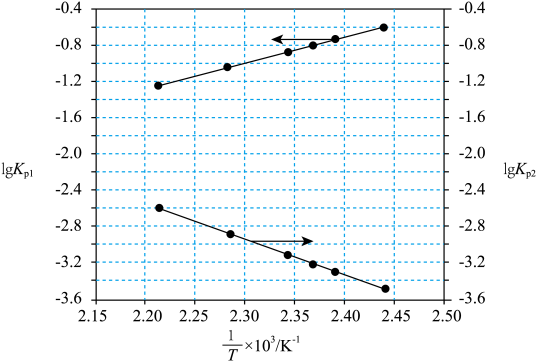
①由图可知,2HBr(g) H2(g)+Br2(g)反应的△H
H2(g)+Br2(g)反应的△H_____ 0(填“大于”或“小于”)。
②反应2HI(g) H2(g)+I2(g)的K=
H2(g)+I2(g)的K=______ (用Kp1、Kp2表示);该反应的△H_____ 0(填“大于”或“小于”)。
(3)1530K恒温条件下,将0.1molI2和0.1molI2置于预先抽成真空的特制1L密闭容器中,起始总压强为25bar(1bar=100kPa),体系达到平衡后,总压强为27.5bar(1bar=100kPa)。体系中存在如下反应关系:
I.I2(g) 2I(g) K
2I(g) K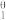 =
=
II.I2(g)+H2(g) 2HI(g) K
2HI(g) K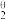
①计算1530K平衡体系中I2(g)的分压p=_____ bar。
②计算K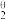 =
=_____ (可用分数表示)。
(已知:分压=总压x该组分物质的量分数,对于反应dD(g)+eE(g) gG(g)+hH(g)Kθ=
gG(g)+hH(g)Kθ=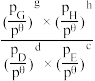 ,其中pθ=100kPa,pG、pH、pD、pE为各组分的平衡分压)。
,其中pθ=100kPa,pG、pH、pD、pE为各组分的平衡分压)。
 H2(g)+I2(g)进行了大量研究。回答下列问题:
H2(g)+I2(g)进行了大量研究。回答下列问题:(1)在632K时,气体混合物中碘化氢的物质的量分数x(HI)与反应时间t的关系如表:
| t/min | 0 | 20 | 40 | 60 | 80 | 100 |
| x(HI) | 1 | 0.901 | 0.842 | 0.810 | 0.800 | 0.800 |
②上述反应中,正反应速率为v正=k正•x2(HI),逆反应速率为v逆=k逆•x(H2)•x(I2),其中k正、k逆为速率常数,则k逆为
(2)实验测定和计算了在136℃~180℃范围内下列反应的分压平衡常数Kp。
I.Br2(g)+2HI(g)
 2HBr(g)+I2(g) Kp1
2HBr(g)+I2(g) Kp1II.2HBr(g)
 H2(g)+Br2(g) Kp2
H2(g)+Br2(g) Kp2得到lgKp1~
 和lgKp2~
和lgKp2~ 均为线性关系,如图所示:
均为线性关系,如图所示:
①由图可知,2HBr(g)
 H2(g)+Br2(g)反应的△H
H2(g)+Br2(g)反应的△H②反应2HI(g)
 H2(g)+I2(g)的K=
H2(g)+I2(g)的K=(3)1530K恒温条件下,将0.1molI2和0.1molI2置于预先抽成真空的特制1L密闭容器中,起始总压强为25bar(1bar=100kPa),体系达到平衡后,总压强为27.5bar(1bar=100kPa)。体系中存在如下反应关系:
I.I2(g)
 2I(g) K
2I(g) K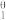 =
=
II.I2(g)+H2(g)
 2HI(g) K
2HI(g) K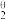
①计算1530K平衡体系中I2(g)的分压p=
②计算K
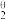 =
=(已知:分压=总压x该组分物质的量分数,对于反应dD(g)+eE(g)
 gG(g)+hH(g)Kθ=
gG(g)+hH(g)Kθ=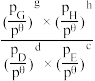 ,其中pθ=100kPa,pG、pH、pD、pE为各组分的平衡分压)。
,其中pθ=100kPa,pG、pH、pD、pE为各组分的平衡分压)。
您最近一年使用:0次
解答题-工业流程题
|
困难
(0.15)
解题方法
【推荐1】稀土工业生产中,草酸(H2C2O4)是稀土元素沉淀剂。工业生产中会产生稀土草酸沉淀废水,其主要成分为盐酸和草酸的混合溶液及微量的草酸稀土杂质等。此废水腐蚀性较强,直接排放会造成环境污染。工业上处理废水的方法包括“①氧化法”和“②沉淀法”。相关工业流程如图所示:
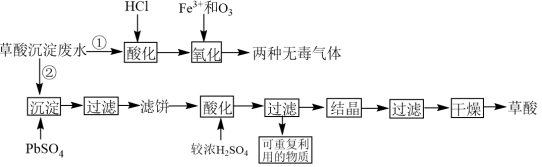
25℃时,各物质的溶度积常数如下表:
回答下列问题:
(1)“①氧化法”中Fe3+是反应的催化剂,反应产生了两种无毒气体。则草酸和臭氧反应的化学方程式为_______ 。
(2)“氧化”步骤中,当废水pH=1.0时,单位时间内的草酸去除率接近55%;当废水的pH上升至5.5时,单位时间内的草酸去除率只有5%,其原因是_______ 。为了使加入的17.5mg·L-1的Fe3+催化效果达到最佳,废水酸化时应将pH调整至小于_______ (已知lg2=0.3,1g5=0.7)。
(3)“②沉淀法”:将1.5mol PbSO4沉淀剂加到1L含有0.1mol·L-1草酸的模拟废水中。沉淀时发生的离子反应为PbSO4(s)+H2C2O4(aq)=PbC2O4(s)+2H+(aq)+ (aq)。请计算此反应的平衡常数K=
(aq)。请计算此反应的平衡常数K=_______ 。
(4)滤饼“酸化”“过滤”后可重复利用的物质为_______ (填化学式)。
(5)比较“①氧化法”和“②沉淀法”,从原料利用率角度分析,方法_______ (填“①”或“②”)更好,原因是_______ 。

25℃时,各物质的溶度积常数如下表:
| Ksp[Fe(OH)3] | Ksp(PbSO4) | Ksp(PbC2O4) | Ka1(H2C2O4)] | Ka2(H2C2O4) |
| 2.5×10-39 | 2.0×10-8 | 5.0×10-10 | 6.0×10-2 | 6.25×10-5 |
(1)“①氧化法”中Fe3+是反应的催化剂,反应产生了两种无毒气体。则草酸和臭氧反应的化学方程式为
(2)“氧化”步骤中,当废水pH=1.0时,单位时间内的草酸去除率接近55%;当废水的pH上升至5.5时,单位时间内的草酸去除率只有5%,其原因是
(3)“②沉淀法”:将1.5mol PbSO4沉淀剂加到1L含有0.1mol·L-1草酸的模拟废水中。沉淀时发生的离子反应为PbSO4(s)+H2C2O4(aq)=PbC2O4(s)+2H+(aq)+
 (aq)。请计算此反应的平衡常数K=
(aq)。请计算此反应的平衡常数K=(4)滤饼“酸化”“过滤”后可重复利用的物质为
(5)比较“①氧化法”和“②沉淀法”,从原料利用率角度分析,方法
您最近一年使用:0次
解答题-工业流程题
|
困难
(0.15)
名校
【推荐2】高纯镓广泛用于半导体、光电材料等领域。可以利用炼锌渣(主要含ZnO、CuO、 、FeO和一定量的
、FeO和一定量的 、不溶性杂质)为原料制备高纯镓,同时获得ZnS,流程如图所示:
、不溶性杂质)为原料制备高纯镓,同时获得ZnS,流程如图所示:
①电解制取镓时,溶液中的氯离子会影响镓的析出。
②溶液中存在反应: 。
。
③室温时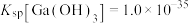 ;
;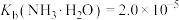 。
。
④黄钠铁矾晶体颗粒大,易沉降易过滤。
(1) 的价层电子排布式为
的价层电子排布式为_____ ,1mol 中含有σ键的物质的量为
中含有σ键的物质的量为_____ 。
(2)黄钠铁矾的化学式为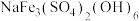 ,写出“沉铁”时的离子方程式
,写出“沉铁”时的离子方程式_____ 。
(3)不采用调节pH的方式沉铁,可能的原因是:①直接调pH沉铁易生成 胶体,不容易过滤;②
胶体,不容易过滤;②_____ ;③_____ 。
(4)“还原除杂”时先向溶液中加入一定量的铜粉,反应一段时间后再向溶液中加入稍过量Zn粉,加入铜粉的目的是_____ 。
(5) 与
与 的各物种的分布分数随pH的变化如图所示。“调节pH=8.2”时,pH不能过高的原因是
的各物种的分布分数随pH的变化如图所示。“调节pH=8.2”时,pH不能过高的原因是_____ 。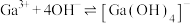 ,
,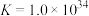 。通过计算探究氨水能否溶解
。通过计算探究氨水能否溶解 ,反应
,反应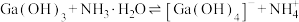 的平衡常数为
的平衡常数为_____ 。
(7)在沉铁前可以加入铁氰化钾检验 是否被完全氧化,若有
是否被完全氧化,若有 则会观察到蓝色沉淀。该蓝色沉淀是一种铁配合物
则会观察到蓝色沉淀。该蓝色沉淀是一种铁配合物 (其摩尔质量为M
(其摩尔质量为M ),其晶胞的
),其晶胞的 如图[
如图[ 未标出,占据四个互不相你的小方体晶胞的
未标出,占据四个互不相你的小方体晶胞的 部分)的体心。若该晶体的密度为
部分)的体心。若该晶体的密度为 ,则
,则 和
和 的最短距离为
的最短距离为_____ cm(设 为阿伏加德罗常数的值)。
为阿伏加德罗常数的值)。
 、FeO和一定量的
、FeO和一定量的 、不溶性杂质)为原料制备高纯镓,同时获得ZnS,流程如图所示:
、不溶性杂质)为原料制备高纯镓,同时获得ZnS,流程如图所示: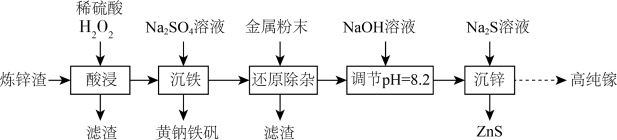
①电解制取镓时,溶液中的氯离子会影响镓的析出。
②溶液中存在反应:
 。
。③室温时
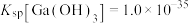 ;
;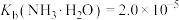 。
。④黄钠铁矾晶体颗粒大,易沉降易过滤。
(1)
 的价层电子排布式为
的价层电子排布式为 中含有σ键的物质的量为
中含有σ键的物质的量为(2)黄钠铁矾的化学式为
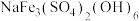 ,写出“沉铁”时的离子方程式
,写出“沉铁”时的离子方程式(3)不采用调节pH的方式沉铁,可能的原因是:①直接调pH沉铁易生成
 胶体,不容易过滤;②
胶体,不容易过滤;②(4)“还原除杂”时先向溶液中加入一定量的铜粉,反应一段时间后再向溶液中加入稍过量Zn粉,加入铜粉的目的是
(5)
 与
与 的各物种的分布分数随pH的变化如图所示。“调节pH=8.2”时,pH不能过高的原因是
的各物种的分布分数随pH的变化如图所示。“调节pH=8.2”时,pH不能过高的原因是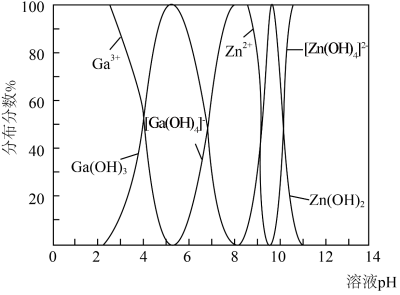
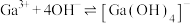 ,
,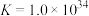 。通过计算探究氨水能否溶解
。通过计算探究氨水能否溶解 ,反应
,反应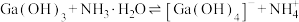 的平衡常数为
的平衡常数为(7)在沉铁前可以加入铁氰化钾检验
 是否被完全氧化,若有
是否被完全氧化,若有 则会观察到蓝色沉淀。该蓝色沉淀是一种铁配合物
则会观察到蓝色沉淀。该蓝色沉淀是一种铁配合物 (其摩尔质量为M
(其摩尔质量为M ),其晶胞的
),其晶胞的 如图[
如图[ 未标出,占据四个互不相你的小方体晶胞的
未标出,占据四个互不相你的小方体晶胞的 部分)的体心。若该晶体的密度为
部分)的体心。若该晶体的密度为 ,则
,则 和
和 的最短距离为
的最短距离为 为阿伏加德罗常数的值)。
为阿伏加德罗常数的值)。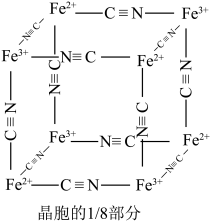
您最近一年使用:0次
解答题-原理综合题
|
困难
(0.15)
名校
【推荐3】铜及其化合物是高中化学的重要组成部分,在工农业生产中具有重要的应用。
(1)在农业上可用含铜的波尔多液作为农药,配制波尔多液需要___________ (填化学式)。
(2)已知CuCl在氨水中络合后极易被空气中的 氧化。
氧化。
①补齐下列离子方程式:__________ 。
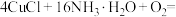 ___________
___________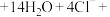 ___________
___________
②现将Cu置于 溶液中,通入
溶液中,通入 ,反应1小时,测得体系中铜离子总浓度为160mg/L,Cu的溶解速率为
,反应1小时,测得体系中铜离子总浓度为160mg/L,Cu的溶解速率为___________ 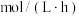 。
。
(3)查阅文献:在无氧条件下CuCl在氨水溶液中存下如下平衡(含足量CuCl固体)
ⅰ:

ⅱ: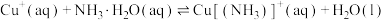

ⅲ: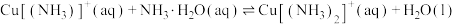
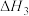
①反应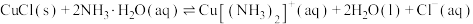
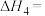
___________ (用 、
、 、
、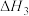 来表示);在上述反应中,配原子是
来表示);在上述反应中,配原子是___________ (填元素符号)。
②对于上述相关平衡体系,下列说法不正确的是:___________ (填编号)
A.加水稀释,平衡后溶液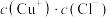 不变
不变
B.向体系中通入 ,有利于提高
,有利于提高 平衡转化率
平衡转化率
C.升高温度,有利于生成
D.溶液中存在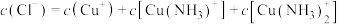
③向一定浓度的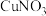 溶液中通入足量
溶液中通入足量 得到澄清溶液(设溶液体积不变),测得平衡体系中含铜微粒分布系数
得到澄清溶液(设溶液体积不变),测得平衡体系中含铜微粒分布系数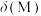 与
与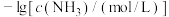 关系如下图所示(其中M代表体系中含铜微粒)。如
关系如下图所示(其中M代表体系中含铜微粒)。如 的分布系数
的分布系数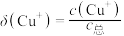 ,
, 。
。___________ 分布系数(填离子符号)。
(b)反应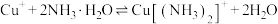 的
的
___________ 。(已知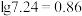 )
)
(c)c点的坐标为___________ 。(已知 )
)
(1)在农业上可用含铜的波尔多液作为农药,配制波尔多液需要
(2)已知CuCl在氨水中络合后极易被空气中的
 氧化。
氧化。①补齐下列离子方程式:
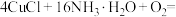 ___________
___________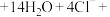 ___________
___________②现将Cu置于
 溶液中,通入
溶液中,通入 ,反应1小时,测得体系中铜离子总浓度为160mg/L,Cu的溶解速率为
,反应1小时,测得体系中铜离子总浓度为160mg/L,Cu的溶解速率为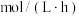 。
。(3)查阅文献:在无氧条件下CuCl在氨水溶液中存下如下平衡(含足量CuCl固体)
ⅰ:


ⅱ:
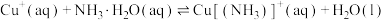

ⅲ:
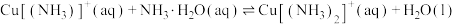
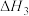
①反应
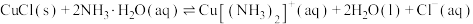
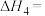
 、
、 、
、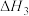 来表示);在上述反应中,配原子是
来表示);在上述反应中,配原子是②对于上述相关平衡体系,下列说法不正确的是:
A.加水稀释,平衡后溶液
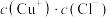 不变
不变B.向体系中通入
 ,有利于提高
,有利于提高 平衡转化率
平衡转化率C.升高温度,有利于生成

D.溶液中存在
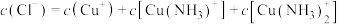
③向一定浓度的
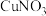 溶液中通入足量
溶液中通入足量 得到澄清溶液(设溶液体积不变),测得平衡体系中含铜微粒分布系数
得到澄清溶液(设溶液体积不变),测得平衡体系中含铜微粒分布系数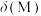 与
与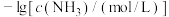 关系如下图所示(其中M代表体系中含铜微粒)。如
关系如下图所示(其中M代表体系中含铜微粒)。如 的分布系数
的分布系数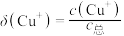 ,
, 。
。
(b)反应
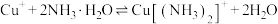 的
的
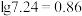 )
)(c)c点的坐标为
 )
)
您最近一年使用:0次
【推荐1】“双碳”目标大背景下,采取高效经济方式利用 对人类社会发展具有重要意义。
对人类社会发展具有重要意义。
(1) 可用于人工合成淀粉,共需要11步,其中前两步涉及的反应如图1所示。
可用于人工合成淀粉,共需要11步,其中前两步涉及的反应如图1所示。
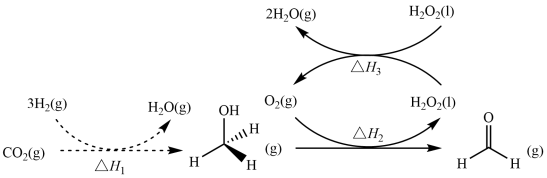
图1
已知: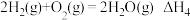
则反应: 的
的
_______ 。(用 、
、 、
、 和
和 表示)
表示)
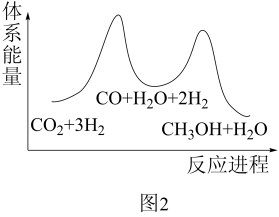
(2)二氧化碳加氢可用于合成甲醇.总反应可表示为: ,该反应一般认为分两步完成,反应过程中能量变化示意图如图2所示:
,该反应一般认为分两步完成,反应过程中能量变化示意图如图2所示:
①在不同压强下,按照 投料合成甲醇,实验测定
投料合成甲醇,实验测定 的平衡转化率和
的平衡转化率和 的平衡产率随温度的变化关系如上图3、图4所示。
的平衡产率随温度的变化关系如上图3、图4所示。
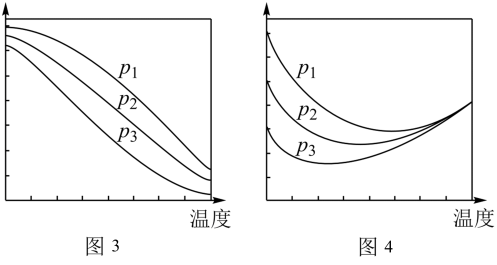
下列说法正确的是_______ 。
A.图4纵坐标表示 的平衡产率
的平衡产率
B.
C.为了同时提高 的平衡转化率和
的平衡转化率和 的平衡产率,应选择低温,高压的反应条件
的平衡产率,应选择低温,高压的反应条件
D.一定温度、压强下,寻找活性更高的催化剂,是提高 的平衡转化率的主要研究方向
的平衡转化率的主要研究方向
②甲醇脱水可制得二甲醚: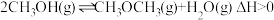 。实验测得:
。实验测得: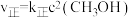 ,
,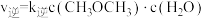 ,
, 、
、 为速率常数。
为速率常数。 温度下,向
温度下,向 恒容密闭容器中加入
恒容密闭容器中加入 ,起始压强为
,起始压强为 ,
, 时该反应达到平衡。此时测得
时该反应达到平衡。此时测得 的体积分数为
的体积分数为 ,则平衡时
,则平衡时 的转化率
的转化率
_______ ;当温度改变为 时,
时,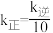 ,则
,则
_______  (填“<”、“>”或“=”)。
(填“<”、“>”或“=”)。
(3)通过电解器可将 高效转化为乙烯、乙醇、甲酸、乙酸等有机物,如下图5所示。
高效转化为乙烯、乙醇、甲酸、乙酸等有机物,如下图5所示。
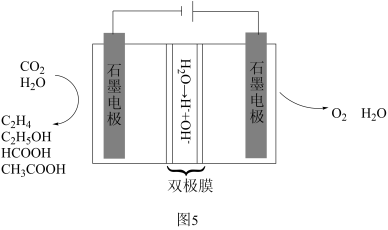
①该装置生成乙醇的电极方程式为_______ 。
②现有通过电解所得 、
、 的混合溶液。测得此溶液
的混合溶液。测得此溶液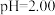 ,
, 浓度为
浓度为 ,估算
,估算 浓度为
浓度为_______  。已知
。已知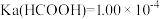 ,
, 。
。
③已知E为电池电动势(电池电动势即电池的理论电压,是两个电极电位之差)。反应的吉布斯自由能变 与E存在如下关系:
与E存在如下关系: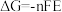 ,其中n表示在电池中发生单位反应(电池反应对应的计量系数为最简整数比)时转移电子的物质的量,F为法拉第常数,可取
,其中n表示在电池中发生单位反应(电池反应对应的计量系数为最简整数比)时转移电子的物质的量,F为法拉第常数,可取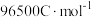 。该电解池所用电池为
。该电解池所用电池为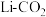 电池,电池仅由
电池,电池仅由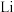 与
与 反应,得到
反应,得到 与另一种固体单质,反应的
与另一种固体单质,反应的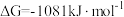 ,则电池电动势
,则电池电动势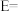
_______ V(结果保留两位小数)。
 对人类社会发展具有重要意义。
对人类社会发展具有重要意义。(1)
 可用于人工合成淀粉,共需要11步,其中前两步涉及的反应如图1所示。
可用于人工合成淀粉,共需要11步,其中前两步涉及的反应如图1所示。
图1
已知:
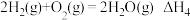
则反应:
 的
的
 、
、 、
、 和
和 表示)
表示)(2)二氧化碳加氢可用于合成甲醇.总反应可表示为:
 ,该反应一般认为分两步完成,反应过程中能量变化示意图如图2所示:
,该反应一般认为分两步完成,反应过程中能量变化示意图如图2所示:
①在不同压强下,按照
 投料合成甲醇,实验测定
投料合成甲醇,实验测定 的平衡转化率和
的平衡转化率和 的平衡产率随温度的变化关系如上图3、图4所示。
的平衡产率随温度的变化关系如上图3、图4所示。
下列说法正确的是
A.图4纵坐标表示
 的平衡产率
的平衡产率B.

C.为了同时提高
 的平衡转化率和
的平衡转化率和 的平衡产率,应选择低温,高压的反应条件
的平衡产率,应选择低温,高压的反应条件D.一定温度、压强下,寻找活性更高的催化剂,是提高
 的平衡转化率的主要研究方向
的平衡转化率的主要研究方向②甲醇脱水可制得二甲醚:
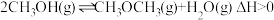 。实验测得:
。实验测得: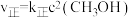 ,
,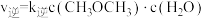 ,
, 、
、 为速率常数。
为速率常数。 温度下,向
温度下,向 恒容密闭容器中加入
恒容密闭容器中加入 ,起始压强为
,起始压强为 ,
, 时该反应达到平衡。此时测得
时该反应达到平衡。此时测得 的体积分数为
的体积分数为 ,则平衡时
,则平衡时 的转化率
的转化率
 时,
时,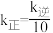 ,则
,则
 (填“<”、“>”或“=”)。
(填“<”、“>”或“=”)。(3)通过电解器可将
 高效转化为乙烯、乙醇、甲酸、乙酸等有机物,如下图5所示。
高效转化为乙烯、乙醇、甲酸、乙酸等有机物,如下图5所示。
①该装置生成乙醇的电极方程式为
②现有通过电解所得
 、
、 的混合溶液。测得此溶液
的混合溶液。测得此溶液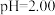 ,
, 浓度为
浓度为 ,估算
,估算 浓度为
浓度为 。已知
。已知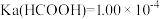 ,
, 。
。③已知E为电池电动势(电池电动势即电池的理论电压,是两个电极电位之差)。反应的吉布斯自由能变
 与E存在如下关系:
与E存在如下关系: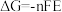 ,其中n表示在电池中发生单位反应(电池反应对应的计量系数为最简整数比)时转移电子的物质的量,F为法拉第常数,可取
,其中n表示在电池中发生单位反应(电池反应对应的计量系数为最简整数比)时转移电子的物质的量,F为法拉第常数,可取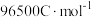 。该电解池所用电池为
。该电解池所用电池为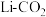 电池,电池仅由
电池,电池仅由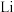 与
与 反应,得到
反应,得到 与另一种固体单质,反应的
与另一种固体单质,反应的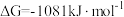 ,则电池电动势
,则电池电动势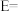
您最近一年使用:0次
【推荐2】我国科学家首次实现利用甲烷在温和条件下高选择性氧化制甲醇。
反应Ⅰ: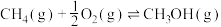

反应Ⅱ: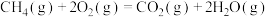
(1)已知:①
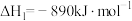
②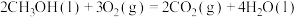
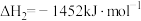
③
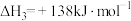
上述反应Ⅰ中的
___________  。
。
(2)在密闭容器中投入2mol 和1mol
和1mol ,起始投料量不变,在不同温度、压强下做平行实验,测得
,起始投料量不变,在不同温度、压强下做平行实验,测得 的平衡体积分数与温度、压强的关系如图所示:
的平衡体积分数与温度、压强的关系如图所示:

①由图可知,当 时,以反应
时,以反应___________ (填“Ⅰ”或“Ⅱ”)为主,理由是___________ ;
② 时,三条曲线几乎相连的原因可能是
时,三条曲线几乎相连的原因可能是___________ ;
③a、b、c由大到小排序为___________ 。
(3)在恒温的刚性(恒容)密闭容器中,分别按照(a) 、
、 的体积比为2:1以及(b)
的体积比为2:1以及(b) 、
、 、
、 (
( 的作用是活化催化剂)的体积比为2:1:8进行投料,反应相同的时间(都加入相同催化剂),所得产物的选择性[如甲醇的选择性=
的作用是活化催化剂)的体积比为2:1:8进行投料,反应相同的时间(都加入相同催化剂),所得产物的选择性[如甲醇的选择性= ]如表所示:
]如表所示:
①投料b能显著提高甲醇选择性的原因是___________ 。
②向上述刚性密闭容器中按照体积比2:1:8充入 、
、 和
和 ,在450K下达到平衡状态时,
,在450K下达到平衡状态时, 的转化率为50%,
的转化率为50%, 的选择性为90%,则副反应的压强平衡常数
的选择性为90%,则副反应的压强平衡常数
___________ (计算结果保留1位小数)。
(4)我国科学家研发新型催化剂,利用电催化法实现甲烷转化成甲醇,装置如图所示:

交换膜M的名称是___________ ;阳极的电极反应式为___________ 。
反应Ⅰ:
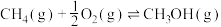

反应Ⅱ:
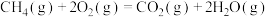
(1)已知:①

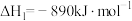
②
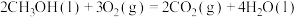
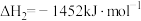
③

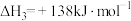
上述反应Ⅰ中的

 。
。(2)在密闭容器中投入2mol
 和1mol
和1mol ,起始投料量不变,在不同温度、压强下做平行实验,测得
,起始投料量不变,在不同温度、压强下做平行实验,测得 的平衡体积分数与温度、压强的关系如图所示:
的平衡体积分数与温度、压强的关系如图所示:
①由图可知,当
 时,以反应
时,以反应②
 时,三条曲线几乎相连的原因可能是
时,三条曲线几乎相连的原因可能是③a、b、c由大到小排序为
(3)在恒温的刚性(恒容)密闭容器中,分别按照(a)
 、
、 的体积比为2:1以及(b)
的体积比为2:1以及(b) 、
、 、
、 (
( 的作用是活化催化剂)的体积比为2:1:8进行投料,反应相同的时间(都加入相同催化剂),所得产物的选择性[如甲醇的选择性=
的作用是活化催化剂)的体积比为2:1:8进行投料,反应相同的时间(都加入相同催化剂),所得产物的选择性[如甲醇的选择性= ]如表所示:
]如表所示:| 投料方式 | a | b |
 的选择性/% 的选择性/% | 90 | 15 |
 的选择性/% 的选择性/% | 10 | 85 |
①投料b能显著提高甲醇选择性的原因是
②向上述刚性密闭容器中按照体积比2:1:8充入
 、
、 和
和 ,在450K下达到平衡状态时,
,在450K下达到平衡状态时, 的转化率为50%,
的转化率为50%, 的选择性为90%,则副反应的压强平衡常数
的选择性为90%,则副反应的压强平衡常数
(4)我国科学家研发新型催化剂,利用电催化法实现甲烷转化成甲醇,装置如图所示:

交换膜M的名称是
您最近一年使用:0次
解答题-原理综合题
|
困难
(0.15)
解题方法
【推荐3】二氧化碳加氢制甲烷过程中的主要反应为
Ⅰ.CO2(g)+4H2(g)=CH4(g)+2H2O(g) △H1<0
Ⅱ.CO2(g)+H2(g)=CO(g)+H2O(g) △H2>0
Ⅲ.2CO(g)+2H2(g)=CO2(g)+CH4(g) △H3
在密闭容器中,1.01×105Pa、n起始(CO2):n起始(H2)=1:4时,在催化剂作用下反应相同时间所测得的CO2平衡转化率、CO2实际转化率随温度的变化如图2所示。CH4的选择性可表示为 ×100%。
×100%。______ kJ•mol-1,平衡时CH4的选择性随着温度的升高______ ,用该催化剂催化二氧化碳反应的最佳温度为______ ,450℃时,使CO2平衡转化率达到X点的值,可以采用的措施为_______ (写出一条)。______ 。在505℃,反应Ⅱ的平衡常数K=______ 。(保留两位有效数字)______ 种价态,催化剂中掺入少量CaO,用Ca2+替代CeO2结构中部分Ce4+形成CaxCe1-xOy,可提高催化效率的原因是_______ 。
Ⅰ.CO2(g)+4H2(g)=CH4(g)+2H2O(g) △H1<0
Ⅱ.CO2(g)+H2(g)=CO(g)+H2O(g) △H2>0
Ⅲ.2CO(g)+2H2(g)=CO2(g)+CH4(g) △H3
在密闭容器中,1.01×105Pa、n起始(CO2):n起始(H2)=1:4时,在催化剂作用下反应相同时间所测得的CO2平衡转化率、CO2实际转化率随温度的变化如图2所示。CH4的选择性可表示为
 ×100%。
×100%。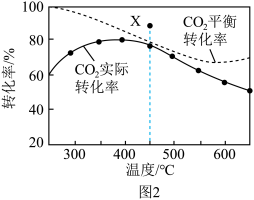

您最近一年使用:0次




