9-10高一下·辽宁大连·期末
名校
解题方法
1 . 对于任何一个化学反应平衡体系,采用以下措施,一定会使化学反应发生平衡移动的是
| A.加入一种反应物 | B.升高温度 |
| C.对平衡体系增加压强 | D.使用催化剂 |
您最近一年使用:0次
2022-11-12更新
|
108次组卷
|
77卷引用:宁夏吴忠市吴忠中学2021-2022学年高二上学期月考化学试题
宁夏吴忠市吴忠中学2021-2022学年高二上学期月考化学试题(已下线)09~10年大连23中高一下学期期末考试化学卷(已下线)2010-2011学年广西北海市合浦县教研室高二上学期期末考试化学试卷(已下线)2011-2012学年高二上学期单元测试期中考试化学试卷(已下线)2011-2012学年陕西省咸阳市渭城中学高二上学期期中考试化学试卷(已下线)2011-2012学年甘肃省张掖中学高二上学期期中考试化学(理)试卷(已下线)2011-2012学年吉林省扶余一中高二上学期期中考试化学试卷(已下线)2011-2012学年黑龙江省绥棱县第一中学高二上学期期末考试化学试卷(已下线)2011-2012学年广东省汕头市达濠中学高二上学期期末考试化学试卷(已下线)2011-2012学年浙江省嘉兴八校高二下学期期中联考化学试卷(已下线)2011-2012学年浙江湖州菱湖中学高二下学期期中考试化学试卷(已下线)2012-2013学年广东省汕头市达濠中学高二上学期期末理科化学试卷(已下线)2012-2013学年湖北省武汉市重点中学高二上学期期中考试化学试卷(已下线)2014年化学高考总复习课时演练 7-2化学平衡状态化学平衡移动练习卷(已下线)2013-2014学年江苏省淮安市高中协作体高二下学期期中考试化学试卷(已下线)2014届海南省海南中学高二下学期期中考试化学(理)试卷(已下线)2015届江苏省泰州市姜堰区高二上学期中考试化学试卷(选修)(已下线)2014秋季甘肃省白银市一中高二第一学期期中理科化学试卷2014-2015学年重庆复旦中学高二上学期期中化学试卷2014-2015学年广东省东莞市三校高二上学期期中联考化学试卷2015-2016学年宁夏育才中学高二上学期期中测试化学试卷2015-2016学年海南省文昌中学高二上期中(理)化学试卷2015-2016学年辽宁师大附中高一下学期6月月考化学试卷2016-2017学年宁夏育才中学高二上第一次月考化学卷2016-2017学年陕西西藏民族学院附中高二上月考二化学卷2016-2017学年江苏省泰州中学高二上月考一化学试卷2017届宁夏银川二中高三上学期统练二化学试卷2017届广东省清远市清城区高三上期末B卷化学试卷2016-2017学年辽宁省大连市高二上学期期末考试(理)化学试卷天津市第一中学2017-2018学年高二上学期期末考试化学试题湖南省邵东县第十中学2018-2019学年高二上学期期中考试理科班化学试题2019年10月22日《每日一题》2019-2020学年高二化学人教选修4——化学平衡移动的判断浙江省诸暨中学2019-2020学年高二上学期10月阶段性考试化学试题福建省永安市第三中学2019-2020学年高二10月月考化学试题甘肃省白银市会宁县第四中学2019-2020学年高二上学期期中考试化学试题安徽省蚌埠市第二中学2019-2020学年高二上学期期中考试化学试题浙江省东阳中学2019-2020学年高二上学期期中考试化学试题陕西省西安电子科技大学附属中学2019-2020学年高二上学期期中考试化学(理)试题湖南省永州市双牌县第二中学2019-2020学年高二上学期期中考试化学试题(选考)安徽省淮北市第一中学2019-2020学年高二12月月考化学试题陕西省渭南三贤中学2019-2020学年高二上学期期中考试化学试题吉林省普通高中联合体2018-2019学年高二下学期期末联考化学试题【懂做原理题】2020届高三化学选修4二轮专题练——化学平衡移动及其影响因素【精编25题】贵州省毕节市民族中学2019-2020学年高二上学期第二次月考化学试题福建省三明市2019-2020学年高二下学期期末考试化学试题(已下线)第02章 化学反应速率和化学平衡(A卷基础篇)——2020-2021学年高二化学选修四同步单元AB卷(人教版)鲁科版(2019)选择性必修1 第2章 化学反应的方向、限度与速率 第2节 化学反应的限度(已下线)2.3.2+影响化学平衡状态的因素-2020-2021学年高二化学同步课堂帮帮帮(人教版选修4)(已下线)2.3.2影响化学平衡状态的因素(基础练)-2020-2021学年高二化学上学期十分钟同步课堂专练(人教版选修4)河南省安阳市第一中学2020-2021学年高二上学期第一次阶段考试化学试题山西省新绛县第二中学2019-2020学年高二上学期第一次考试化学试题天津市第八中学2020-2021学年高二上学期第三次统练化学试题安徽省蚌埠田家炳中学2020-2021学年高二12月月考化学试题江苏省泰州中学2020-2021学年高二上学期第一次月度质量检测化学试题浙江省杭州市西湖高级中学2020-2021学年高二上学期期末考试化学试题陕西省眉县槐芽中学2020-2021学年高二上学期期中考试化学试题四川省成都市蒲江县蒲江中学2020-2021学年高二3月月考化学试题云南省丽江市第一中学2020-2021学年高二下学期期中考试化学试题吉林省长春市第二十九中学2021-2022学年高二上学期第一学程考试化学试题广东省深圳市福田区外国语高级中学2021-2022学年高二上学期期中考试化学试题陕西省宝鸡市金台区2021-2022学年高二上学期期中考试化学(理)试题福建省南平市浦城县2021-2022学年高二上学期期中考试化学试题云南昆明师范专科学校附属中学2021-2022学年高二上学期期中考试化学试题新疆叶城县第八中学2021-2022学年高二上学期期末考试化学(理)试题 黑龙江省鸡西市第四中学2022-2023学年高二上学期第一次月考化学试题(已下线)2.2.1 化学平衡状态——同步学习必备知识云南省曲靖市富源县第一中学2021-2022学年高二下学期期中考试化学试题江西省赣州市十校协作2022-2023学年高二上学期期中联考化学试题安徽省宿州市十三所重点中学2022-2023学年高二上学期期中质量检测化学试题新疆乌鲁木齐市第八十中学2022-2023学年高二上学期期中考试化学试题黑龙江省哈尔滨市第三中学校2022-2023学年高二上学期第三次验收考试化学试题四川省广安市育才学校2022-2023学年高二上学期11月期中考试化学试题云南省蒙自市第一高级中学2022-2023学年高二下学期3月月考化学试题黑龙江省哈尔滨市第三中学校2022-2023学年高二上学期11月期中考试化学试题黑龙江省鹤岗市第一中学2022-2023学年高三上学期11月月考化学试题浙江省金华市东阳市外国语学校2023-2024学年高二上学期10月月考化学试题上海市建平世纪中学2023-2024学年高二上学期阶段练习二 化学(等级)试题
名校
2 . 下列关于化学反应速率的说法中,正确的是
①用铁片与稀硫酸反应制取氢气时,改用98%的浓硫酸可以加快产生氢气的速率
②SO2的催化氧化是一个放热反应,所以升高温度,反应速率减慢
③决定化学反应速率的主要因素是反应物的浓度
④汽车尾气中的NO与CO反应转化为无害的N2和CO2,减小压强,反应速率减慢
⑤增大压强,一定能加快化学反应速率
⑥用锌与稀硫酸反应制H2时,滴加几滴硫酸铜溶液能加快反应速率
⑦使用催化剂,使反应的活化能降低,反应速率加快
⑧光是影响某些化学反应速率的外界条件之一
⑨增加反应物的用量,一定会增大化学反应速率
①用铁片与稀硫酸反应制取氢气时,改用98%的浓硫酸可以加快产生氢气的速率
②SO2的催化氧化是一个放热反应,所以升高温度,反应速率减慢
③决定化学反应速率的主要因素是反应物的浓度
④汽车尾气中的NO与CO反应转化为无害的N2和CO2,减小压强,反应速率减慢
⑤增大压强,一定能加快化学反应速率
⑥用锌与稀硫酸反应制H2时,滴加几滴硫酸铜溶液能加快反应速率
⑦使用催化剂,使反应的活化能降低,反应速率加快
⑧光是影响某些化学反应速率的外界条件之一
⑨增加反应物的用量,一定会增大化学反应速率
| A.①②⑤⑨ | B.④⑥⑦⑧ | C.④⑥⑦⑨ | D.③④⑥⑦ |
您最近一年使用:0次
名校
3 . 下图是用钌 (Ru )基催化剂催化CO2(g)和H2(g)的反应的示意图,当反应生成46g液态HCOOH时放出31.2 kJ的热量。下列说法正确的是
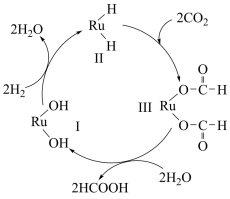
| A.图示中物质I、II、III均为该反应的催化剂 |
| B.使用催化剂可以降低反应的活化能,从而改变反应的焓变 |
| C.由题意知:HCOOH(l)=CO2(g)+H2(g) ΔH = +31.2kJ· mol-1 |
| D.因使用钌基催化剂使反应CO2(g) + H2(g)= HCOOH(l)分两步进行 |
您最近一年使用:0次
2022-09-06更新
|
491次组卷
|
7卷引用:宁夏吴忠中学2022-2023学年高二上学期期中考试化学试题
名校
4 . 少量铁片与100mL 0.01mol/L的稀盐酸反应,反应速率太慢。为了加快此反应速率而不改变 的产量,可以使用如下方法中的
的产量,可以使用如下方法中的
①加 ②加
②加 溶液 ③滴入几滴浓盐酸 ④加入少量铁粉 ⑤加NaCl溶液 ⑥滴入几滴硫酸铜溶液 ⑦升高温度(不考虑盐酸挥发) ⑧改为足量的浓盐酸
溶液 ③滴入几滴浓盐酸 ④加入少量铁粉 ⑤加NaCl溶液 ⑥滴入几滴硫酸铜溶液 ⑦升高温度(不考虑盐酸挥发) ⑧改为足量的浓盐酸
 的产量,可以使用如下方法中的
的产量,可以使用如下方法中的 ①加
 ②加
②加 溶液 ③滴入几滴浓盐酸 ④加入少量铁粉 ⑤加NaCl溶液 ⑥滴入几滴硫酸铜溶液 ⑦升高温度(不考虑盐酸挥发) ⑧改为足量的浓盐酸
溶液 ③滴入几滴浓盐酸 ④加入少量铁粉 ⑤加NaCl溶液 ⑥滴入几滴硫酸铜溶液 ⑦升高温度(不考虑盐酸挥发) ⑧改为足量的浓盐酸| A.①⑥⑦ | B.③⑤⑧ | C.③⑦⑧ | D.③④⑥⑦⑧ |
您最近一年使用:0次
名校
5 . 分析图象是学习化学的基本能力。在密闭容器中进行反应: ,下列能正确表示该反应有关物理量变化规律的是
,下列能正确表示该反应有关物理量变化规律的是
 ,下列能正确表示该反应有关物理量变化规律的是
,下列能正确表示该反应有关物理量变化规律的是A. | B.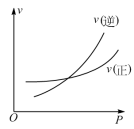 |
C.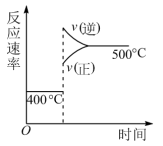 | D. |
您最近一年使用:0次
2022-01-08更新
|
231次组卷
|
3卷引用:宁夏青铜峡市高级中学2021-2022学年高二下学期开学考试化学试题
9-10高一下·河南郑州·期末
名校
解题方法
6 . 200 mL浓度为1 mol/L的盐酸跟过量的锌片反应,为加快反应速率,又不影响生成氢气的量,可采用的方法是
| A.加入适量的6 mol/L的盐酸 | B.加入数滴氯化铜溶液 |
| C.加入适量蒸馏水 | D.加入适量的氯化钠溶液 |
您最近一年使用:0次
2021-12-04更新
|
235次组卷
|
64卷引用:宁夏青铜峡市高级中学2019-2020学年高二上学期期中考试化学试题
宁夏青铜峡市高级中学2019-2020学年高二上学期期中考试化学试题宁夏青铜峡市高级中学2021-2022学年高二上学期期中考试化学试题(已下线)2010年郑州市智林学校高一下学期期末考试化学试题(已下线)2010-2011学年山西省临汾一中高二上学期期末考试化学试卷(已下线)2010—2011浙江省嘉兴一中高一下学期期中考试化学试卷(已下线)2011-2012年云南省建水一中高二上学期期中考试化学(理)试题(已下线)2011-2012学年山东省日照一中高二上学期期中考试化学(理)试卷(已下线)2011-2012学年内蒙古巴彦淖尔市中学巴市一中高二上学期12月月考化学试卷(已下线)2011-2012学年辽宁省东北育才学校高一下学期期中考试化学试卷(已下线)2011-2012学年四川省资阳中学高一下半期考试化学试卷(已下线)2011-2012学年河北省保定三中高二上学期期中考试文科化学试卷(已下线)2012年苏教版高中化学选修4 1.2化学能与电能的转化(已下线)2012-2013学年福建省晋江市养正中学高二下学期第一次月考化学试卷(已下线)2013-2014学年江苏省响水中学高二上学期期中考试化学试卷(选修)(已下线)2013-2014学年浙江省温州市十校联合体高一下学期期中联考化学试卷2014-2015学年福建省清流一中高二上学期月考化学理试卷2014-2015学年河北省成安县第一中学高一6月月考化学试卷2015-2016学年安徽省亳州市高二上学期期末质检化学试卷2016届贵州省习水县第一中学高三下学期期中化学试卷2015-2016学年湖北市宜昌夷陵中学高一5月月考化学试卷2016-2017学年吉林省长春实验中学高二上9月月考化学卷2016-2017学年贵州省思南中学高二上半期考试化学卷【全国百强校】重庆市第八中学2017-2018学年高一下学期期末考试化学试题吉林省扶余市第一中学2017-2018学年高一下学期期末考试化学试题【校级联考】吉林省辽源市田家炳高级中学(第六十六届友好学校)2018-2019学年高二上学期期末联考化学试题(已下线)2019年3月24日 《每日一题》 必修2 每周一测【全国百强校】黑龙江省双鸭山市第一中学2018-2019学年高一下学期期中考试化学试题【全国百强校】内蒙古北方重工业集团有限公司第三中学2018-2019学年高一下学期期中考试化学试题山东省惠民县第一中学2018-2019学年高一下学期联考化学试题河北省黄骅中学2018-2019学年高一下学期第二次月考化学试题安徽省蚌埠铁路中学2019-2020学年高二上学期期中考试化学试题广东省广州市2019-2020学年高二上学期期中模拟测试化学试题(二)安徽省滁州市六校2019-2020学年高二12月联考化学试题2020届高三化学化学二轮复习——原电池【精编选择24题】河北省邯郸市第一中学2019—2020学年高一4月月考化学试题贵州省铜仁第一中学2019-2020学年高一下学期第七次周测化学试题浙江省宁波市咸祥中学2019-2020学年高一下学期期中考试化学试题河北省石家庄市元氏县第四中学2019-2020学年高一下学期月考化学试题黑龙江省鸡西市鸡东县第二中学2019-2020学年高一下学期期末考试化学试题上海市金山中学2019-2020学年高一下学期期中考试化学试题山东省济宁市泗水县2019-2020学年高二上学期期中考试化学试题云南省云天化中学、下关一中2021届高三复习备考联合质量检测卷(一) 化学试题河南省驻马店市正阳县高级中学2020-2021学年高二上学期第一次月考化学试题北京市北大附中实验学校2020-2021学年高二上学期10月月考化学试题吉林省长春市第一五一中学2020-2021学年高二上学期第一次月考化学试题(希望班)甘肃省张掖市第二中学2020-2021学年高二上学期期中考试化学试题北京市理工大学附属中学2020-2021学年高二上学期10月月考化学试题黑龙江省哈尔滨市第三十二中学2020-2021学年高二上学期期末考试化学试题江苏省泗洪县洪翔中学2019-2020学年高一下学期6月月考化学试题新疆哈密市第八中学2019-2020学年高一下学期期中考试化学试题河南省豫南九校2020-2021学年高二上学期第四次联考化学试题新疆维吾尔自治区呼图壁县第一中学2020-2021学年高二上学期期末考试化学试题江苏省沭阳县修远中学2020-2021学年高二下学期第一次联考化学试题湖南省长沙市第一中学2020-2021学年高一下学期第一次月考化学试题(已下线)1.2.1 原电池的工作原理(备作业)-【上好课】2021-2022学年高二化学同步备课系列(苏教版2019选择性必修1)(已下线)第14讲 原电池-2020-2021学年秋季班高一上学期化学教材知识点精讲练(沪科版)陕西省宝鸡市陈仓区2020-2021学年高一下学期期中考试化学试题海南省海口市第四中学2021-2022学年高二上学期第一次月考化学试题陕西省宝鸡市陈仓区2021-2022学年高一下学期期中考试化学试题 陕西省咸阳市武功县2021--2022学年高二上学期质量调研化学试题甘肃省民勤县第四中学2021-2022学年高二上学期期中考试化学试题5.3.2 化学变化中的能量变化(第2课时)-【帮课堂】高一化学同步精品讲义(沪科版2020必修第二册)陕西省渭南市杜桥中学2023-2024学年高二上学期期中考试化学试卷 海南省海口市第一中学2023-2024学年高二上学期期末考试化学试题(非重点班)
名校
解题方法
7 . 下列关于有效碰撞理论与影响速率因素之间关系正确的是
| A.增大反应物浓度,可以提高活化分子百分数,从而提高反应速率 |
| B.升高温度,可以提高活化分子的能量,会减慢反应速率 |
| C.加入催化剂可以降低活化能,活化分子百分比虽然没变,但可以加快反应速率 |
| D.通过压缩体积增大压强,可提高单位体积内活化分子数,从而提高反应速率 |
您最近一年使用:0次
2021-10-13更新
|
324次组卷
|
5卷引用:宁夏吴忠中学2022-2023学年高二上学期期中考试化学试题
名校
8 . 已知可逆反应: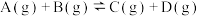
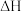 ,在某密闭体系中进行该反应,反应过程中能量变化如图所示。下列说法正确的是
,在某密闭体系中进行该反应,反应过程中能量变化如图所示。下列说法正确的是
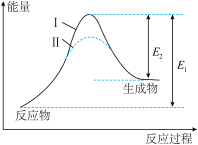
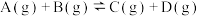
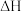 ,在某密闭体系中进行该反应,反应过程中能量变化如图所示。下列说法正确的是
,在某密闭体系中进行该反应,反应过程中能量变化如图所示。下列说法正确的是
A.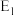 为逆反应的活化能, 为逆反应的活化能, 为正反应的活化能 为正反应的活化能 |
| B.曲线Ⅱ使用了催化剂,降低了反应的焓变 |
C.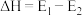 ,该反应为吸热反应 ,该反应为吸热反应 |
| D.活化能越大,反应越容易进行 |
您最近一年使用:0次
2021-07-31更新
|
1254次组卷
|
10卷引用:宁夏吴忠中学2023-2024学年高二上学期11月期中考试化学试题
宁夏吴忠中学2023-2024学年高二上学期11月期中考试化学试题选择性必修1(SJ)专题2第一单元课时2 影响化学反应速率的因素(已下线)第2章 化学反应速率与化学平衡(基础过关卷)-【高效检测】2021-2022学年高二化学章末测试卷(人教版2019选择性必修1)吉林省永吉县第四中学2021-2022学年高二上学期第一次月考化学试题辽宁省辽东南协作体2021-2022学年高二上学期第一次月考化学试题广东省梅州市大埔县虎山中学2021-2022学年高二上学期第一次段考(10月)化学试题2.1.2影响化学反应速率的因素 课后黑龙江省鹤岗市第一中学2022-2023学年高二上学期11月期中考试化学试题云南省大理市大理白族自治州民族中学2023-2024学年高二上学期12月月考化学试题新疆维吾尔自治区喀什市第十四中学2023-2024学年高二上学期1月期末质量检测化学试题
名校
9 . 下列措施是为了降低化学反应速率的是
| A.食品放在冰箱中贮藏 |
| B.双氧水制氧气时加入少量二氧化锰 |
| C.用锌粉代替锌片与稀硫酸反应制取氢气 |
| D.在试管中进行铝和盐酸反应时稍微加热 |
您最近一年使用:0次
2021-06-15更新
|
171次组卷
|
2卷引用:宁夏青铜峡市高级中学2020-2021学年高一下学期学考模拟化学试题
名校
10 . 下列各组反应中,产生氢气的速率最快的是
| A.60℃,Mg粉与3mol/L硫酸溶液 |
| B.60℃,Mg粉与2mol/L盐酸溶液 |
| C.50℃,Mg粉与3mol/L硫酸溶液 |
| D.50℃,Mg粉与2mol/L盐酸溶液 |
您最近一年使用:0次
2021-06-05更新
|
140次组卷
|
2卷引用:宁夏青铜峡市高级中学2020-2021学年高一6月普通高中学业水平合格性考试训练化学试题



