(1)已知下列热化学方程式:
ⅰ.CH2=CHCH3(g)+ Cl2(g)=CH2ClCHClCH3(g) H1=-133 kJ·mol-1
ⅱ.CH2=CHCH3(g)+Cl2(g)=CH2=CHCH2Cl(g)+HCl(g) ΔH2=-100 kJ·mol-1
又已知在相同条件下,CH2=CHCH2Cl(g)+HCl(g)=CH2ClCHClCH3(g) 的正反应的活化能Ea(正)为132 kJ·mol-1,则逆反应的活化能Ea(逆)为
(2)查阅资料得知,反应CH3CHO(aq)=CH4(g)+CO(g)在含有少量I2的溶液中分两步进行:
第Ⅰ步反应为CH3CHO(aq)+I2(aq)→CH3I(l)+HI(aq)+CO(g)(慢反应);
第Ⅱ步为快反应。增大I2的浓度
(3)用催化剂Fe3(CO)12/ZSM5催化CO2加氢合成乙烯的反应,所得产物含CH4、C3H6、C4H8等副产物,反应过程如图。
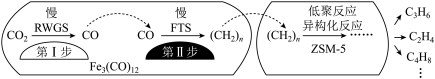
催化剂中添加Na、K、Cu助剂后(助剂也起催化作用)可改变反应的选择性,在其他条件相同时,添加不同助剂,经过相同时间后测得CO2转化率和各产物的物质的量分数如下表。
助剂 | CO2转化率(%) | 各产物在所有产物中的占比(%) | ||
C2H4 | C3H6 | 其他 | ||
Na | 42.5 | 35.9 | 39.6 | 24.5 |
K | 27.2 | 75.6 | 22.8 | 1.6 |
Cu | 9.8 | 80.7 | 12.5 | 6.8 |
(4)在一密闭容器中,起始时向该容器中充入H2S和CH4且n(H2S)∶n(CH4) =2∶1,发生反应:CH4(g)+2H2S(g)=CS2(g)+4H2(g)。0.11 MPa时,温度变化对平衡时产物的物质的量分数的影响如图所示:
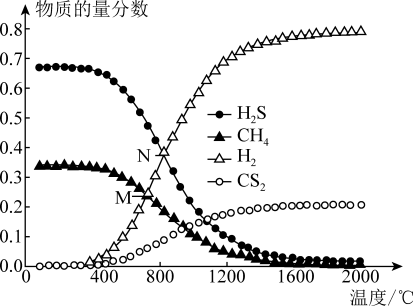
为提高H2S的平衡转化率,除改变温度外,还可采取的措施是
(5)合成碳酸二甲酯的工作原理如图所示。
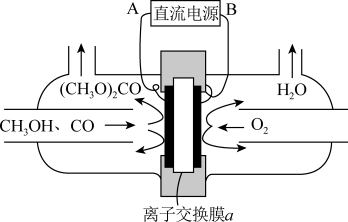
阳极的电极反应式为
2 . 氮的氧化物是造成大气污染的主要物质。研究氮氧化物的反应机理和化学平衡对于消除环境污染有重要意义。
(1)NO在空气中存在如下反应:2NO(g)+O2(g) 2NO2(g)ΔH。上述反应分两步完成,其反应历程如图所示。
2NO2(g)ΔH。上述反应分两步完成,其反应历程如图所示。

请回答下列问题:
①写出反应II的热化学方程式
②反应I和反应II中,一个是快反应,会快速建立平衡状态,而另一个是慢反应。决定2NO(g)+O2(g) 2NO2(g)反应速率的是
2NO2(g)反应速率的是
(2)用活性炭还原法处理氮氧化物的有关反应为:C(s)+2NO(g) N2(g)+CO2(g)。向恒容密闭容器中加入一定量的活性炭和NO,T℃时,各物质起始浓度及12min和15min时各物质的平衡浓度如表所示:
N2(g)+CO2(g)。向恒容密闭容器中加入一定量的活性炭和NO,T℃时,各物质起始浓度及12min和15min时各物质的平衡浓度如表所示:
浓度(mol·L-1) 时间(min) | NO | CO2 | N2 |
0 | 0.200 | 0 | 0 |
12 | 0.050 | 0.075 | 0.075 |
15 | 0.100 | 0.050 | 0.450 |
①T℃时,该反应的平衡常数为
②在12min时,若只改变某一条件使平衡发生移动,15min时重新达到平衡,则改变的条件是
③在15min时,保持温度和容器体积不变再充入NO和N2,使NO、N2的浓度分别增加至原来的2倍4倍,此时反应v正
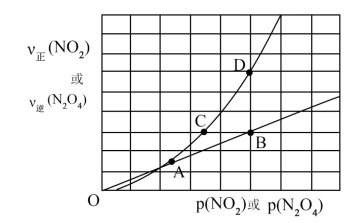
(3)NO2存在如下平衡:2NO2(g) N2O4(g)△H<0,在一定条件下NO2与N2O4的消耗速率与各自的分压(分压=总压×物质的量分数)有如下关系式:v正(NO2)=k1·P2(NO2),v逆(N2O4)=k2·P(N2O4),速率与分压关系如图所示。一定温度下,k1、k2与平衡常数Kp(压力平衡常数,用平衡分压代替平衡浓度计算)间的关系是Kp=
N2O4(g)△H<0,在一定条件下NO2与N2O4的消耗速率与各自的分压(分压=总压×物质的量分数)有如下关系式:v正(NO2)=k1·P2(NO2),v逆(N2O4)=k2·P(N2O4),速率与分压关系如图所示。一定温度下,k1、k2与平衡常数Kp(压力平衡常数,用平衡分压代替平衡浓度计算)间的关系是Kp=
(1)我国学者结合实验与计算机模拟结果,研究了在金催化剂表面上水煤气变换的反应历程,如图1所示,其中吸附在金催化剂表面上的物种用*标注。可知水煤气变换的ΔH


(2)用水煤气变换所得的CO2(g)和H2(g)可以合成甲醇,可能发生的反应如下:
反应ⅠCO2(g)+3H2(g)
 CH3OH(g)+H2O(g)ΔH1=-58kJ·mol-1
CH3OH(g)+H2O(g)ΔH1=-58kJ·mol-1反应ⅡCO2(g)+H2(g)=CO(g)+H2O(g)ΔH2
向刚性容器中按初始体积比为1:3充入CO2(g)和H2(g),在不同催化剂(Cat.1,Cat.2)下反应相同时间,CO2(g)的转化率和甲醇的选择性(甲醇的选择性=
 ×100%)随温度的变化如图2所示。
×100%)随温度的变化如图2所示。①由图2可知,催化效果Cat.1
②在210~270℃间,CH3OH的选择性随温度的升高而下降,可能的原因是
③若使用催化剂Cat.1,温度为T℃时,CO2(g)转化率为a%,此时甲醇的选择性为b%,则该反应混合物中甲醇的体积分数为
(3)可以由水煤气变换所得的H2(g)和分离液态空气所得的N2(g)在高温高压及铁触媒条件下合成氨。
①基态N原子的价电子排布图为
②合成氨工业通常将氨液化后分离出来,再将N2(g)和H2(g)循环使用。氨容易液化的原因有二:一是氨分子为极性分子,二是
③一定条件下,氨气可以和铁反应生成Fe4N,其晶胞与钛酸钙晶胞属于相同类型的晶胞,两种晶胞如图3所示。甲中N原子与乙中

(1)有学者指出:含硫物质可进行太阳能的转化和存储,具体过程如图所示。
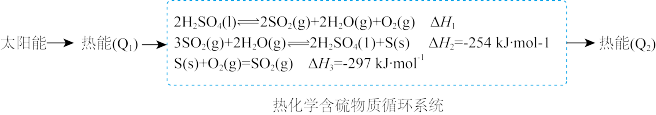
①△H1=
②经上述过程实际存储的热能Q2小于Q1,原因为
(2)SO2在含KI的溶液中发生反应的能量变化如图所示。
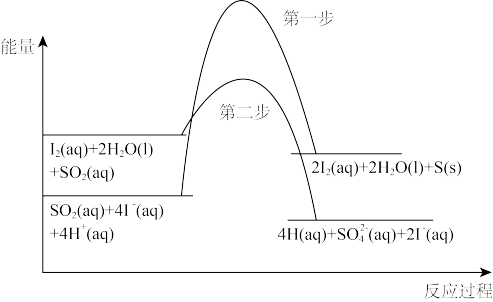
①总反应的化学方程式为
②转化过程中的决速步骤为
(3)反应H2S(g) + CO2 (g)
 COS(g)+ H2O(g)△H>0 可用于制备有机化工原料COS。
COS(g)+ H2O(g)△H>0 可用于制备有机化工原料COS。①275°C时,将等物质的量的H2S(g)与CO2(g)充入密闭容器中,测得H2O(g)的平衡体积分数为26%。则CO2(g)的平衡转化率α=
②在300℃、320℃时上述反应中H2S(g)和COS(g)的体积分数(
 )随时间(t)的变化关系如图所示。起始密闭容器中
)随时间(t)的变化关系如图所示。起始密闭容器中 [H2S(g)]和
[H2S(g)]和 [CO2(g)]、
[CO2(g)]、 [COS(g)]和
[COS(g)]和 [H2O(g)]分别相等。则300℃时反应的平衡常数K=
[H2O(g)]分别相等。则300℃时反应的平衡常数K= [H2S(g)]、
[H2S(g)]、 [COS(g)]随时间变化的曲线分别为
[COS(g)]随时间变化的曲线分别为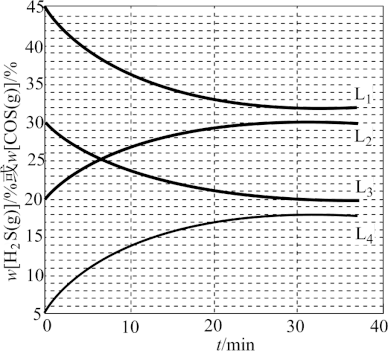
I.氮氧化物间的相互转化
(1)已知2NO(g)+O2(g)
 2NO2(g)的反应历程分两步:
2NO2(g)的反应历程分两步:第一步2NO(g)
 N2O2(g)(快速平衡)
N2O2(g)(快速平衡)第二步N2O2(g)+O2(g)
 2NO2(g)(慢反应)
2NO2(g)(慢反应)①用O2表示的速率方程为v(O2)=k1·c2(NO)·c(O2);NO2表示的速率方程为v(NO2)=k2·c2(NO)·c(O2),k1与k2分别表示速率常数,则
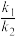 =
=②下列关于反应2NO(g)+O2(g)=2NO2(g)的说法正确的是
A.增大压强,反应速率常数一定增大
B.第一步反应的活化能小于第二步反应的活化能
C.反应的总活化能等于第一步和第二步反应的活化能之和
(2)2NO2(g)
 N2O4(g) (△H<0),用分压(某组分的分压等于总压与其物质的量分数的积)表示的平衡常数KP与
N2O4(g) (△H<0),用分压(某组分的分压等于总压与其物质的量分数的积)表示的平衡常数KP与 (T为温度)的关系如图。
(T为温度)的关系如图。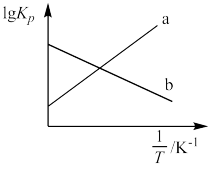
①能正确表示lgKP与
 关系的曲线是
关系的曲线是②298K时,在体积固定的密闭容器中充入一定量的NO2,平衡时NO2的分压为100kPa。已知KP=2.7×10-3kPa-1,则NO2的转化率为
II.烟气中氮氧化物的脱除
(3)以NH3为还原剂在脱硝装置中消除烟气中的氮氧化物。
主反应:4NH3(g)+4NO(g)+O2(g)=4N2(g)+6H2O(g) △H1
副反应:4NH3(g)+3O2(g)=2N2(g)+6H2O(g) △H2=-1267.1kJ/mol
4NH3(g)+5O2(g)=4NO(g)+6H2O(g) △H3=-907.3kJ/mol
△H1=
(4)以连二亚硫酸盐(
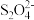 )为还原剂脱除烟气中的NO,并通过电解再生,装置如下图。
)为还原剂脱除烟气中的NO,并通过电解再生,装置如下图。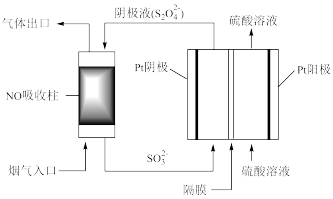
阴极的电极反应式为
 CH3OH(g)+H2O(g)使用不同催化剂的调控中,研究人员发现,一定条件下,Pt 单原子催化剂有着高达 90.3%的甲醇选择性。反应历程如图,其中吸附在催化剂表面上的物种用*表示,TS 表示过渡态。
CH3OH(g)+H2O(g)使用不同催化剂的调控中,研究人员发现,一定条件下,Pt 单原子催化剂有着高达 90.3%的甲醇选择性。反应历程如图,其中吸附在催化剂表面上的物种用*表示,TS 表示过渡态。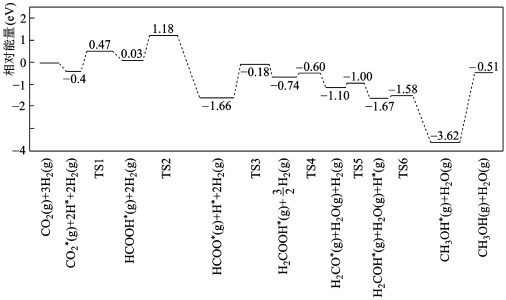
下列说法正确的是
| A.该反应的△H>0 |
| B.经历 TS1,CO2共价键发生断裂,且生成羧基 |
C.能垒(活化能)为 1.48ev 的反应为 HCOOH*(g)+2H2(g)=H2COOH*(g)+ H2(g) H2(g) |
| D.如果换用铜系催化剂,所得反应历程与上图相同 |
①2NO(g)⇌N2O2(g) v1正=k1正c2(NO) v1逆=k1逆c(N2O2)
②N2O2(g)+O2(g)⇌2NO2(g) v2正=k2正c(N2O2)c(O2) v2逆=k2逆c2(NO2)

下列说法正确的是
| A.NO氧化反应速率快慢的决定步骤的活化能是E5—E3 |
B.一定温度下,2NO(g)+O2(g)⇌2NO2 (g)平衡常数表达式K= |
| C.升高温度,NO氧化反应的化学平衡向逆反应方向移动 |
D.该温度下,将等物质的量的NO和O2混合反应(忽略2NO2⇌N2O4),NO的平衡转化率为40%时,该反应的平衡常数Kp= kPa-1 kPa-1 |
(1)合成氨反应。
已知,氨的分解反应:2NH3(g)⇌ N2(g)+3H2 (g),活化能Ea=600kJ•mol-1,合成氨有关化学键的键能如下表:
| 化学键 | H—H | N≡N | N—H |
| E/kJ•mol-1 | 436 | 946 | 391 |
则合成氨反应:
 N2(g)+
N2(g)+ H2(g)⇌NH3(g)的活化能Ea=
H2(g)⇌NH3(g)的活化能Ea=(2)已知2NO+O2=2NO2反应历程分两步
| 方程式 | 活化能 | 焓变 | |
| 总反应 | 2NO(g)+O2(g)=2NO2(g) | 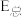 | △H<0 |
| 第一步(快速平衡) | 2NO(g)⇌N2O2(g) | Ea1 | △H1 |
| 第二步(慢反应) | N2O2(g) +O2(g)=2NO2(g) | Ea2 | △H2 |
①平衡常数K可用气体分压来表示,即K的表达式中用平衡分压代替平衡浓度,分压=总压×物质的量分数(例如:
 ),某一时刻第一步达到平衡,写出第一步反应的平衡常数
),某一时刻第一步达到平衡,写出第一步反应的平衡常数
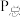 和各气体的物质的分数来表示)。
和各气体的物质的分数来表示)。②用NO表示总反应的速率方程为
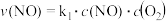 ;NO2表示的总反应速率方程为
;NO2表示的总反应速率方程为 ,
, 与
与 是速率常数,则
是速率常数,则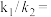
③下列关于反应2NO(g)+O2(g)=2NO2(g)的说法正确的是
A.
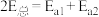 B.增大压强,反应速率常数增大 C.温度升高,正逆反应速率都增大 D.总反应快慢由第二步决定
B.增大压强,反应速率常数增大 C.温度升高,正逆反应速率都增大 D.总反应快慢由第二步决定(3)NH3催化还原氮氧化物(SCR)技术是目前应用最广泛的烟气氮氧化物脱除技术。
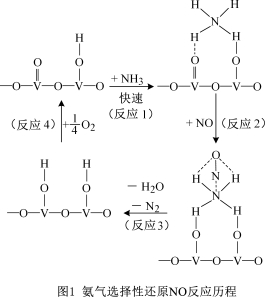
①用活化后的V2O5作催化剂,氨气将NO还原成N2的一种反应历程如图1所示,请写出图1中所示的总反应方程式
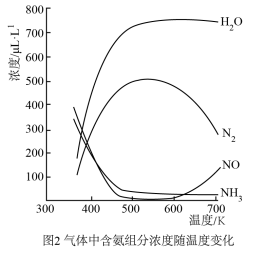
②在有催化剂的作用下,经过相同时间,测得脱氮率随反应温度的变化情况如下图所示,其他条件相同时,请在图中补充在无催化剂作用下脱氮率随温度变化的曲线
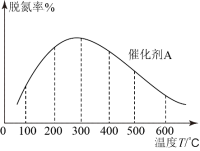
(4)电解法处理氮氧化合物是目前大气污染治理的一个新思路,原理是将NOx在电解池中分解成无污染的N2和O2除去,如下图示,两电极间是新型固体氧化物陶瓷,在一定条件下可自由传导O2-,电解池阴极反应为
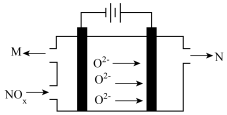
(1)已知:N2O4(g)
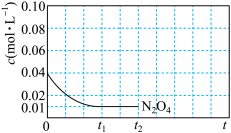
 2NO2(g) ΔH>0 将一定量N2O4气体充入恒容的密闭容器中,控制反应温度为T1。
2NO2(g) ΔH>0 将一定量N2O4气体充入恒容的密闭容器中,控制反应温度为T1。①下列可以作为反应达到平衡的判据是
A.气体的压强不变 B.v正(N2O4)=2v逆(NO2) C.K不变 D.容器内气体的密度不变 E.容器内颜色不变
②t1时刻反应达到平衡,混合气体平衡总压强为p,N2O4气体的平衡转化率为75%,则反应N2O4(g)
 2NO2(g)的平衡常数Kp=
2NO2(g)的平衡常数Kp=③反应温度T1时,c(N2O4)随t(时间)变化曲线如图,画出0~t2时段,c(NO2)随t变化曲线。保持其它条件不变,改变反应温度为T2(T2>T1),再次画出0~t2时段,c(NO2)随t变化趋势的曲线
(2) NO氧化反应:2NO(g)+O2(g)=2NO2(g)分两步进行,其反应过程能量变化示意图如图。
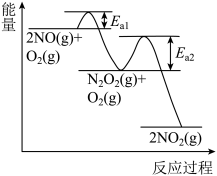
Ⅰ 2NO(g)=N2O2(g) ΔH1
Ⅱ N2O2(g)+O2(g)→2NO2(g) ΔH2
①决定NO氧化反应速率的步骤是
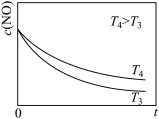
②在恒容的密闭容器中充入一定量的NO和O2气体,保持其它条件不变,控制反应温度分别为T3和T4(T4>T3),测得c(NO)随t(时间)的变化曲线如图。转化相同量的NO,在温度
①物质的键能越大,能量越高
②物质的键能越大,熔沸点一定越高
③吸热反应一定要在加热条件下进行
④催化剂能够降低反应的活化能,进而降低反应的焓变
⑤催化剂能改变反应的路径,但不参与反应
⑥化学反应速率改变,平衡一定发生移动
⑦若平衡发生移动,化学反应速率一定改变
⑧平衡正向移动,原料转化率一定提高
⑨平衡发生移动,平衡常数一定改变
⑩平衡常数改变,平衡一定发生移动
| A.2个 | B.4个 | C.6个 | D.8个 |



