1 . 对于反应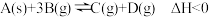 ,下列说法正确的是
,下列说法正确的是
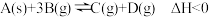 ,下列说法正确的是
,下列说法正确的是| A.加入催化剂,改变了反应的途径,反应的△H也随之改变 |
| B.该反应△S>0,△H<0,在任何条件下能自发进行 |
| C.恒温恒容条件下,混合气体密度不变达到化学平衡状态 |
| D.达到平衡状态后,若增加A的量,平衡向正反应方向移动 |
您最近一年使用:0次
2021-06-28更新
|
919次组卷
|
6卷引用:辽宁省葫芦岛市第八高级中学2021-2022学年高二上学期实验班第一次月考化学试题
辽宁省葫芦岛市第八高级中学2021-2022学年高二上学期实验班第一次月考化学试题浙江省嘉兴市2020-2021学年高二下学期期末检测化学试题(已下线)第二章 第四节 化学反应进行的方向(备作业)-【上好课】2021-2022学年高二化学同步备课系列(人教版选修4)(已下线)专题2.3 化学反应的方向(备作业)-【上好课】2021-2022学年高二化学同步备课系列(人教版2019选择性必修1)浙江省天台中学2021-2022学年高二上学期返校考试化学试题(已下线)考点24 化学反应的方向-备战2023年高考化学一轮复习考点帮(全国通用)
名校
解题方法
2 . 下列有关化学反应速率的说法中,正确的是
| A.汽车尾气中的CO和NO可以缓慢反应生成N2和CO2,减小压强,反应速率减慢 |
| B.用铁片和稀硫酸反应制取H2时,改用铁片和浓硫酸可以加快产生H2的速率 |
| C.二氧化硫的催化氧化反应是一个放热反应,所以升高温度,反应速率减慢 |
| D.100mL2mol·L-1的盐酸与锌反应时,加入适量的NaCl溶液,生成H2的速率不变 |
您最近一年使用:0次
2021-06-24更新
|
2065次组卷
|
11卷引用:辽宁省庄河市高级中学2021-2022学年高二上学期10月月考化学试题
辽宁省庄河市高级中学2021-2022学年高二上学期10月月考化学试题广西玉林市普通中学2020-2021学年高二下学期月考化学试题(已下线)2.1.2 影响化学反应速率的因素(基础过关A练)-2021-2022学年高二化学课时过关提优AB练(人教版2019选择性必修1)(已下线)第二章 化学反应速率与化学平衡(A卷·知识通关练)【单元测试】2022-2023学年高二化学分层训练AB卷(人教版2019选择性必修1)云南省昆明市寻甸县2022-2023学年高二上学期期中考试化学试题甘肃省酒泉市玉门油田第一中学2022-2023学年高二上学期期中考试化学试题吉林省长春市第五中学2022-2023学年高二上学期期中考试化学试题广东省潮州湘桥区南春中学2021-2022学年高二上学期第一次月考化学试题广东华侨中学2022-2023学年高二上学期期中考试化学试题山西省山西大学附属中学校2021-2022学年高一下学期4月考化学试题(已下线)第26练 化学反应速率-2023年高考化学一轮复习小题多维练(全国通用)
3 . 在含有Fe3+、S2O 和I-的混合溶液中,反应S2O
和I-的混合溶液中,反应S2O (aq)+2I-(aq)=2SO
(aq)+2I-(aq)=2SO (aq)+I2(aq)的分部机理如下,反应进程中的能量变化如图所示。
(aq)+I2(aq)的分部机理如下,反应进程中的能量变化如图所示。
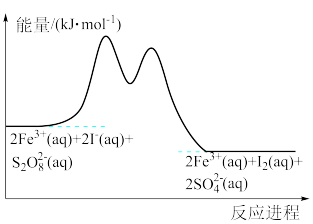
步骤①:2Fe3+(aq)+2I-(aq)=2Fe2+(aq)+I2(aq)
步骤②:S2O (aq)+2Fe2+(aq)=2SO
(aq)+2Fe2+(aq)=2SO (aq)+2Fe3+(aq)
(aq)+2Fe3+(aq)
下列关于该反应的说法错误的是
 和I-的混合溶液中,反应S2O
和I-的混合溶液中,反应S2O (aq)+2I-(aq)=2SO
(aq)+2I-(aq)=2SO (aq)+I2(aq)的分部机理如下,反应进程中的能量变化如图所示。
(aq)+I2(aq)的分部机理如下,反应进程中的能量变化如图所示。
步骤①:2Fe3+(aq)+2I-(aq)=2Fe2+(aq)+I2(aq)
步骤②:S2O
 (aq)+2Fe2+(aq)=2SO
(aq)+2Fe2+(aq)=2SO (aq)+2Fe3+(aq)
(aq)+2Fe3+(aq)下列关于该反应的说法错误的是
| A.Fe3+是该反应的催化剂 |
| B.步骤②比步骤①速率快 |
| C.该反应为放热反应 |
| D.若不加Fe3+,则正反应的活化能比逆反应的大 |
您最近一年使用:0次
2021-06-15更新
|
609次组卷
|
5卷引用:辽宁省东北育才学校高中部2023-2024学年高二上学期第一次月考化学试题
辽宁省东北育才学校高中部2023-2024学年高二上学期第一次月考化学试题辽宁省阜新二高2021届高三下学期第六次模拟考试化学试题(已下线)第一章 第三节 化学反应热的计算(备作业)-【上好课】2021-2022学年高二化学同步备课系列(人教版选修4)河北省承德隆化存瑞中学2021-2022学年高三上学期期中考试化学试题重庆市缙云教育联盟2021-2022学年高三下学期3月质量检测化学试题
名校
解题方法
4 . 下列图中的实验方案,能达到实验目的的是
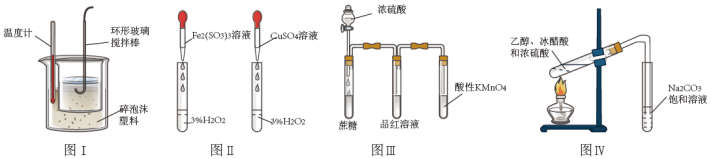

| A.图I测定中和热 |
| B.图II探究不同催化剂对H2O2分解速率的影响 |
| C.图III验证浓硫酸具有脱水性和强氧化性 |
| D.图IV制取乙酸乙酯 |
您最近一年使用:0次
2021-05-31更新
|
392次组卷
|
4卷引用:辽宁省朝阳市凌源市实验中学2022-2023学年高二上学期9月月考化学试题
辽宁省朝阳市凌源市实验中学2022-2023学年高二上学期9月月考化学试题黑龙江省齐齐哈尔市五校2021-2022学年高二上学期期中联考化学试题四川省达州市普通高中2021届高三第二次诊断性测试理科综合化学试题(已下线)第29讲 化学综合实验(精练)-2022年高考化学一轮复习讲练测
名校
解题方法
5 . 氮的化合物在生产、生活中有着重要作用。如何增加氨的产量,减少机动车尾气中NOx和CO的排放是科学家一直关注研究的课题。
(1)工业合成氨:N2(g)+3H2(g) 2NH3(g) △H=akJ·mol-1的反应历程和能量变化如图所示,标注“*”表示在催化剂表面吸附的物质。
2NH3(g) △H=akJ·mol-1的反应历程和能量变化如图所示,标注“*”表示在催化剂表面吸附的物质。
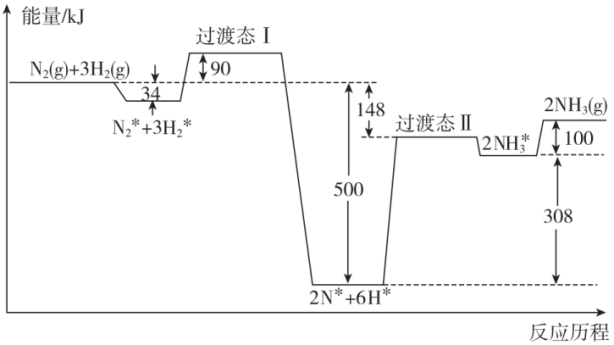
①a=_______ ;用化学方程式表示出对总反应速率影响较大的步骤_______ 。
②控制压强为P0 MPa、温度在700K,将N2(g)和H2(g)按照体积比1:3充入密闭容器合成NH3(g)。反应达到平衡状态时体系中NH3的体积分数为60%,则化学平衡常数Kp=_______ (用平衡分压代替平衡浓度计算,气体分压=气体总压×气体体积分数)。
(2)汽车排气管装有三元催化剂装置,在催化剂表面通过发生吸附、解吸消除CO、NO等污染物。反应机理如下[Pt(s)表示催化剂,右上角带“*”表示吸附状态]:
I.NO+Pt(s)=NO* II.CO+Pt(s)=CO* III.NO*=N*+O*
IV.CO*+O*=CO2+Pt(s) V.N*+ N*=N2+Pt(s) VI.NO*+N*=N2O+Pt(s)
经测定汽车尾气中反应物浓度及生成物浓度随温度T变化关系如图1和图2所示。
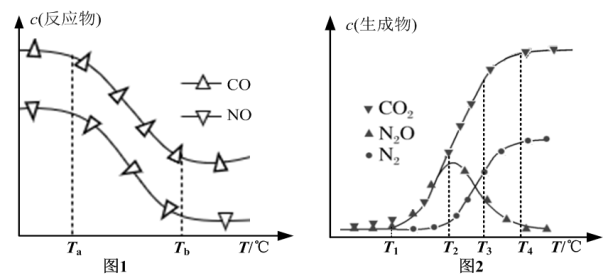
①图1中温度从Ta升至Tb的过程中,反应物浓度急剧减小的主要原因是_______ 。
②图2中温度T2℃时反应V的活化能_______ 反应VI的活化能(填“<”、“>”或“=”);温度T3℃时发生的主要反应为_______ (填“IV”、“V”或“VI”)。
③模拟汽车的“催化转化器”,将2 mol NO(g)和2mol CO(g)充入1L的密闭容器中,发生反应2NO(g)+2CO(g) N2(g)+2CO2(g),测得CO的平衡转化率α随温度T变化曲线如图所示。
N2(g)+2CO2(g),测得CO的平衡转化率α随温度T变化曲线如图所示。
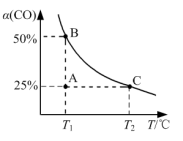
图象中A点逆反应速率_______ C点正反应速率(填“>”“=”或“<”);实验测得:v正=k正·c2(NO)·c2(CO),v逆=k逆·c(N2)·c2(CO2),k正、k逆分别是正、逆反应速率常数。则T1℃时A点处对应的v正:v逆=_______ 。
(1)工业合成氨:N2(g)+3H2(g)
 2NH3(g) △H=akJ·mol-1的反应历程和能量变化如图所示,标注“*”表示在催化剂表面吸附的物质。
2NH3(g) △H=akJ·mol-1的反应历程和能量变化如图所示,标注“*”表示在催化剂表面吸附的物质。
①a=
②控制压强为P0 MPa、温度在700K,将N2(g)和H2(g)按照体积比1:3充入密闭容器合成NH3(g)。反应达到平衡状态时体系中NH3的体积分数为60%,则化学平衡常数Kp=
(2)汽车排气管装有三元催化剂装置,在催化剂表面通过发生吸附、解吸消除CO、NO等污染物。反应机理如下[Pt(s)表示催化剂,右上角带“*”表示吸附状态]:
I.NO+Pt(s)=NO* II.CO+Pt(s)=CO* III.NO*=N*+O*
IV.CO*+O*=CO2+Pt(s) V.N*+ N*=N2+Pt(s) VI.NO*+N*=N2O+Pt(s)
经测定汽车尾气中反应物浓度及生成物浓度随温度T变化关系如图1和图2所示。

①图1中温度从Ta升至Tb的过程中,反应物浓度急剧减小的主要原因是
②图2中温度T2℃时反应V的活化能
③模拟汽车的“催化转化器”,将2 mol NO(g)和2mol CO(g)充入1L的密闭容器中,发生反应2NO(g)+2CO(g)
 N2(g)+2CO2(g),测得CO的平衡转化率α随温度T变化曲线如图所示。
N2(g)+2CO2(g),测得CO的平衡转化率α随温度T变化曲线如图所示。
图象中A点逆反应速率
您最近一年使用:0次
2021-04-04更新
|
782次组卷
|
5卷引用:辽宁省沈阳市第二中学2023-2024学年高二上学期10月阶段考试化学试题
辽宁省沈阳市第二中学2023-2024学年高二上学期10月阶段考试化学试题山东省烟台市2021届高考一模(诊断性测试)化学试题(已下线)难点5 化学反应速率与化学平衡图表分析-2021年高考化学【热点·重点·难点】专练(山东专用)(已下线)专题15 化学反应原理综合-备战2022年高考化学真题及地市好题专项集训【山东专用】山东省济南大学城实验高中2021-2022学年高三2月阶段性调研化学试题
14-15高二上·辽宁沈阳·期末
6 . 某酸性工业废水中含有 。光照下,草酸(
。光照下,草酸( )能将其中的
)能将其中的 今转化为
今转化为 。某课题组研究发现,少量铁明矾
。某课题组研究发现,少量铁明矾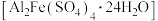 能对该反应起催化作用。为进一步研究有关因素对该反应速率的影响,探究如下:
能对该反应起催化作用。为进一步研究有关因素对该反应速率的影响,探究如下:
(1)在25 下,控制光照强度、废水样品初始浓度和催化剂用量相同,调节不同的初始pH和一定浓度的草酸溶液用量,作对比实验,完成以下实验设计表(表中不要留空格)。
下,控制光照强度、废水样品初始浓度和催化剂用量相同,调节不同的初始pH和一定浓度的草酸溶液用量,作对比实验,完成以下实验设计表(表中不要留空格)。
测得实验①和②溶液中的 浓度随时间变化关系如图所示。
浓度随时间变化关系如图所示。
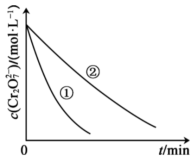
(2)实验①和②的结果表明___________ 对该反应的速率有影响。
(3)该课题组对铁明矾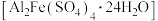 中起催化作用的成分提出如下假设(请你完成假设二和假设三):
中起催化作用的成分提出如下假设(请你完成假设二和假设三):
假设一: 起催化作用;
起催化作用;
假设二:___________ ;
假设三:___________ ;……
(4)请你设计实验验证上述假设一完成下表中内容[除了上述实验提供的试剂外,可供选择的药品有 、
、 、
、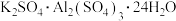 、
、 等。溶液中
等。溶液中 的浓度可用仪器测定]。
的浓度可用仪器测定]。
 。光照下,草酸(
。光照下,草酸( )能将其中的
)能将其中的 今转化为
今转化为 。某课题组研究发现,少量铁明矾
。某课题组研究发现,少量铁明矾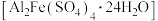 能对该反应起催化作用。为进一步研究有关因素对该反应速率的影响,探究如下:
能对该反应起催化作用。为进一步研究有关因素对该反应速率的影响,探究如下:(1)在25
 下,控制光照强度、废水样品初始浓度和催化剂用量相同,调节不同的初始pH和一定浓度的草酸溶液用量,作对比实验,完成以下实验设计表(表中不要留空格)。
下,控制光照强度、废水样品初始浓度和催化剂用量相同,调节不同的初始pH和一定浓度的草酸溶液用量,作对比实验,完成以下实验设计表(表中不要留空格)。| 实验编号 | 初始pH | 废水样品体积/mL | 草酸溶液体积/mL | 蒸馏水体积/mL |
| ① | 4 | 10 | 30 | |
| ② | 5 | 60 | 10 | |
| ③ | 60 | 20 |
测得实验①和②溶液中的
 浓度随时间变化关系如图所示。
浓度随时间变化关系如图所示。
(2)实验①和②的结果表明
(3)该课题组对铁明矾
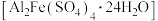 中起催化作用的成分提出如下假设(请你完成假设二和假设三):
中起催化作用的成分提出如下假设(请你完成假设二和假设三):假设一:
 起催化作用;
起催化作用;假设二:
假设三:
(4)请你设计实验验证上述假设一完成下表中内容[除了上述实验提供的试剂外,可供选择的药品有
 、
、 、
、 、
、 等。溶液中
等。溶液中 的浓度可用仪器测定]。
的浓度可用仪器测定]。| 实验方案(不要求写具体操作过程) | 预期实验结果和结论 |
| 取 | 反应进行相同时间后:若溶液中的 浓度,则假设一成立;若溶液中的 浓度,则假设一成立;若溶液中的 浓度 浓度 |
您最近一年使用:0次
2021-03-09更新
|
131次组卷
|
4卷引用:2013-2014学年辽宁省沈阳市高二上教学质量监测化学试卷
(已下线)2013-2014学年辽宁省沈阳市高二上教学质量监测化学试卷(已下线)2014届辽宁省沈阳市高二上教学质量监测化学试卷 广西南宁市2020-2021学年高二上学期期末考试(原理)化学试题安徽省滁州九校2021-2022学年高二上学期第四次调研考试化学试题
名校
7 . Burns和Dainton研究发现Cl2与CO合成COCl2的反应机理如下:
①Cl2(g)⇌2Cl•(g) 快
②CO(g)+Cl•(g)⇌COCl•(g) 快
③COCl•(g)+Cl2(g)⇌COCl2(g)+Cl•(g) 慢
反应②的速率方程为v正=k正c(CO)×c(Cl•),v逆=k逆c(COCl•)。下列说法错误的是
①Cl2(g)⇌2Cl•(g) 快
②CO(g)+Cl•(g)⇌COCl•(g) 快
③COCl•(g)+Cl2(g)⇌COCl2(g)+Cl•(g) 慢
反应②的速率方程为v正=k正c(CO)×c(Cl•),v逆=k逆c(COCl•)。下列说法错误的是
| A.反应①的活化能大于反应③的活化能 |
B.反应②的平衡常数K= |
| C.要提高合成COCl2的速率,关键是提高反应③的速率 |
| D.选择合适的催化剂能提高单位时间内COCl2的产率 |
您最近一年使用:0次
2021-01-28更新
|
614次组卷
|
8卷引用:辽宁省东北育才学校高中部2023-2024学年高二上学期第一次月考化学试题
解题方法
8 . 氮及其化合物的转化过程如图所示。下列分析合理的是
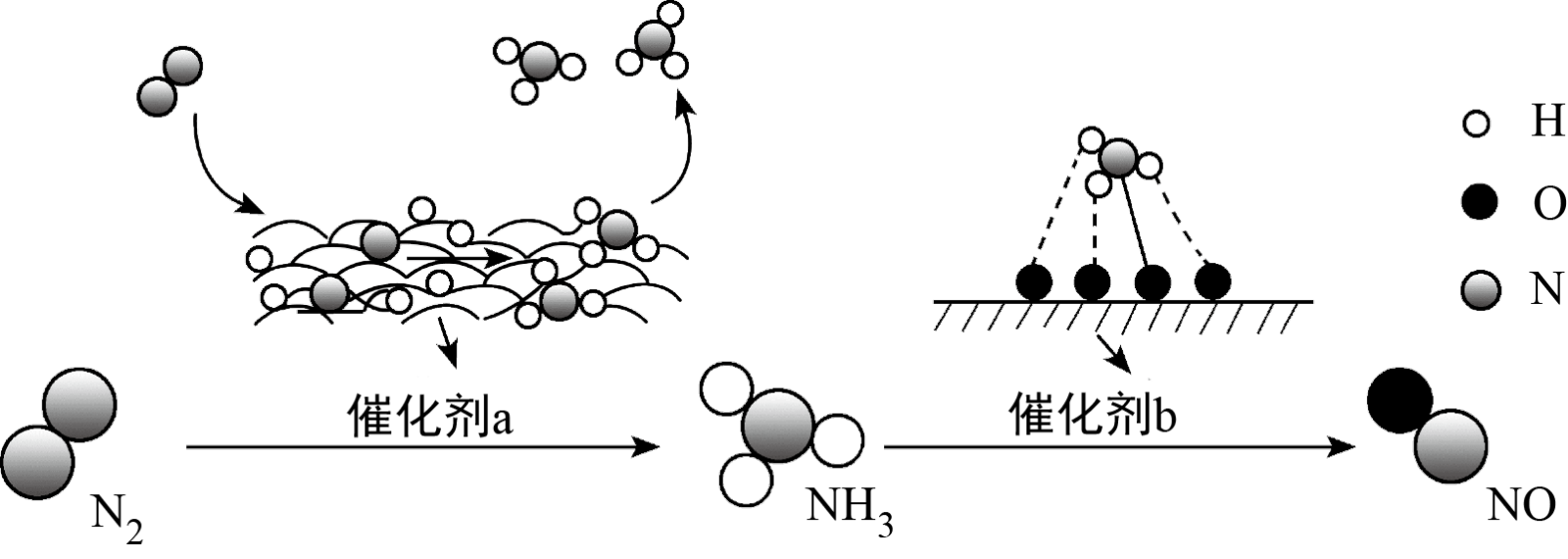

| A.催化剂a、b能改变反应的反应热 |
| B.在催化剂b表面形成氮氧键时不涉及电子转移 |
| C.催化剂a表面发生了非极性共价键的断裂和极性共价键的形成 |
| D.如果向容器中放入lmolN2和3molH2,最终可以生成2molNH3 |
您最近一年使用:0次
9 . 化学与生产生活密切相关,下列说法正确的是
| A.漂白粉和明矾都常用于自来水的处理,二者的作用原理是相同的 |
| B.TiO2是一种稳定的白色颜料,可通过往TiCl4中加入大量水,同时加热来制备TiO2∙xH2O,而后经焙烧制得 |
| C.采用催化转换技术能提高汽车尾气中有害气体的平衡转化率 |
| D.盐碱地(含较多Na2CO3等)不利于作物生长,可施加生石灰降低土壤的碱性 |
您最近一年使用:0次
10 . 根据下列实验操作和现象所得到的结论不正确的是
| 选项 | 实验操作 | 实验现象 | 结论 |
| A | 向 A、B两支试管中各加入2 mL10%的H2O2溶液,向B试管中加入2滴1 mol·L-1FeCl3溶液 | B试管中产生气泡快 | 当其它条件不变时,催化剂可以改变化学反应速率 |
| B | 蒸干并灼烧AlCl3溶液 | 得到白色固体 | 获得Al2O3固体 |
| C | 分别将1 mL pH=3的HA和HB溶液加水稀释至100 mL,测溶液pH | pH(HA)>pH(HB) | 酸性:HA<HB |
| D | 向某溶液中滴加 K3[Fe(CN)6]溶液 | 产生蓝色沉淀 | 溶液中存在Fe2+ |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2021-01-14更新
|
176次组卷
|
2卷引用:辽宁省2020-2021学年高二上学期期末考试化学试题



