名校
解题方法
1 . 甲烷是一种清洁燃料,与水制氢和天然气脱硫具有重要的现实意义。回答下列问题:
Ⅰ.一定条件下,甲烷和水蒸气催化制氢主要有如下两个反应:
①
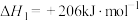
②
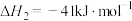
恒定压强为100kPa时,将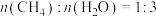 的混合气体投入反应器中,平衡时,各组分的物质的量分数与温度的关系如图所示。
的混合气体投入反应器中,平衡时,各组分的物质的量分数与温度的关系如图所示。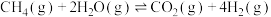

______  ,反应在
,反应在______ 条件下能自发进行。
(2)600℃时, 的平衡分压为
的平衡分压为______ kPa,反应②的物质的量分数的平衡常数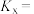
______ (用物质的量分数代替平衡浓度计算,保留2位有效数字)。
(3)系统中q的含量在700℃左右出现峰值,试从化学平衡的角度解释出现峰值的原因:______ 。
Ⅱ.H2S与 重整,不但可以消除污染,还可以制氢。主要反应如下:
重整,不但可以消除污染,还可以制氢。主要反应如下: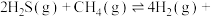
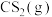
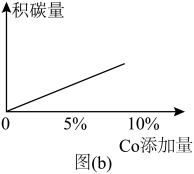
 。在研究反应发生的适宜条件时,Co助剂有稳定催化剂的作用。
。在研究反应发生的适宜条件时,Co助剂有稳定催化剂的作用。
(4)图(a)为800℃、 催化剂条件下投入等量
催化剂条件下投入等量 ,不同投料比分别达到平衡时
,不同投料比分别达到平衡时 转化率、平均反应速率图。C组图像中平均速率最低的原因可能是
转化率、平均反应速率图。C组图像中平均速率最低的原因可能是______ ;相同质量的同种催化剂,在载体上的分散度越高,催化作用越强,原因是______ 。______ 反应(填化学方程式)。
Ⅰ.一定条件下,甲烷和水蒸气催化制氢主要有如下两个反应:
①

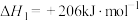
②

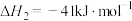
恒定压强为100kPa时,将
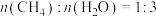 的混合气体投入反应器中,平衡时,各组分的物质的量分数与温度的关系如图所示。
的混合气体投入反应器中,平衡时,各组分的物质的量分数与温度的关系如图所示。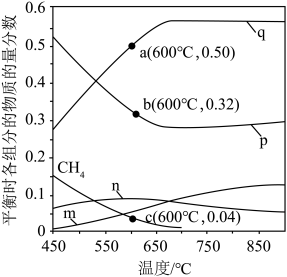
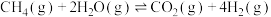

 ,反应在
,反应在(2)600℃时,
 的平衡分压为
的平衡分压为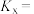
(3)系统中q的含量在700℃左右出现峰值,试从化学平衡的角度解释出现峰值的原因:
Ⅱ.H2S与
 重整,不但可以消除污染,还可以制氢。主要反应如下:
重整,不但可以消除污染,还可以制氢。主要反应如下: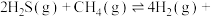
 。在研究反应发生的适宜条件时,Co助剂有稳定催化剂的作用。
。在研究反应发生的适宜条件时,Co助剂有稳定催化剂的作用。(4)图(a)为800℃、
 催化剂条件下投入等量
催化剂条件下投入等量 ,不同投料比分别达到平衡时
,不同投料比分别达到平衡时 转化率、平均反应速率图。C组图像中平均速率最低的原因可能是
转化率、平均反应速率图。C组图像中平均速率最低的原因可能是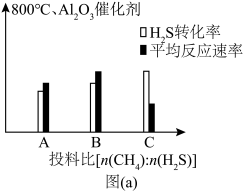
您最近一年使用:0次
7日内更新
|
123次组卷
|
2卷引用:2024届河南省周口市西华县第一高级中学高三下学期信息押题模拟训练理综卷(3)-高中化学
名校
解题方法
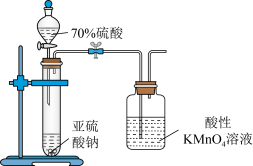
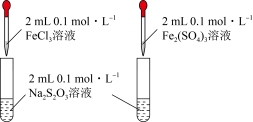
2 . 下列实验装置能达到相应实验目的的是
| 选项 | 实验目的 | 实验装置 |
A | 探究牺牲阳极法保护金属铁 |
|
B | 探究不同价态含硫物质的转化: +6→+4→+6 |
|
C | 探究 、 、 对 对 与 与 反应速率的影响 反应速率的影响 |
|
D | 探究用标准酸性 溶液测定葡萄酒中 溶液测定葡萄酒中 的含量 的含量 |
|
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
7日内更新
|
72次组卷
|
3卷引用:2024届河南省名校联盟高三考前模拟大联考(三模)理综试题-高中化学
3 . 我国科研团队研究 电催化合成氨反应时,发现不同电解质溶液对催化历程的影响如图所示,其中吸附在催化剂表面的物种用*标注。下列说法错误的是
电催化合成氨反应时,发现不同电解质溶液对催化历程的影响如图所示,其中吸附在催化剂表面的物种用*标注。下列说法错误的是
 电催化合成氨反应时,发现不同电解质溶液对催化历程的影响如图所示,其中吸附在催化剂表面的物种用*标注。下列说法错误的是
电催化合成氨反应时,发现不同电解质溶液对催化历程的影响如图所示,其中吸附在催化剂表面的物种用*标注。下列说法错误的是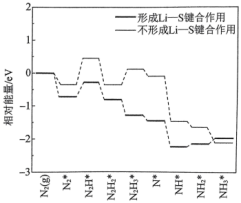
| A.反应放热是合成氨反应自发进行的主要助力 |
B.选用 作电解质比 作电解质比 反应速率快 反应速率快 |
C. 先吸附于催化剂表面再参加合成氨反应 先吸附于催化剂表面再参加合成氨反应 |
| D.形成Li—S键合作用时合成氨反应的△H更大 |
您最近一年使用:0次
23-24高三下·广东佛山·阶段练习
4 . 近日,广州大学韩冬雪、牛利团队报告了一种氧空位浓度可调的物质 ,直接用于温和条件下
,直接用于温和条件下 、
、 的协同光催化反应合成尿素。反应过程中的能量变化及机理如下:
的协同光催化反应合成尿素。反应过程中的能量变化及机理如下:
 ,直接用于温和条件下
,直接用于温和条件下 、
、 的协同光催化反应合成尿素。反应过程中的能量变化及机理如下:
的协同光催化反应合成尿素。反应过程中的能量变化及机理如下: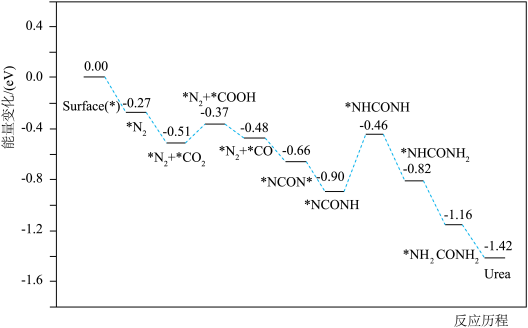
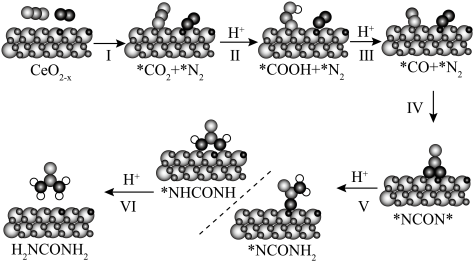
A. 是该尿素合成机理中的催化剂 是该尿素合成机理中的催化剂 |
B. 、 、 在 在 表面上的吸附是吸热反应 表面上的吸附是吸热反应 |
| C.步骤Ⅴ是该反应机理的决速步骤 |
D.该反应机理的氧化电极反应: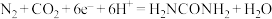 |
您最近一年使用:0次
名校
5 . “肼合成酶”以其中的 配合物为催化中心,可将
配合物为催化中心,可将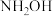 与
与 转化为肼
转化为肼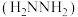 ,其反应历程如下所示。
,其反应历程如下所示。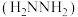 的燃烧热为
的燃烧热为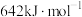 。
。
下列说法正确的是
 配合物为催化中心,可将
配合物为催化中心,可将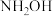 与
与 转化为肼
转化为肼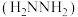 ,其反应历程如下所示。
,其反应历程如下所示。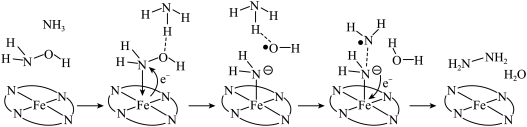
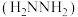 的燃烧热为
的燃烧热为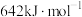 。
。下列说法正确的是
A.反应过程中 元素的化合价发生了变化 元素的化合价发生了变化 |
B.催化中心的 提供孤电子对,N提供空轨道 提供孤电子对,N提供空轨道 |
| C.反应涉及极性键与非极性键的断裂和生成 |
D.肼燃烧热的热化学方程式为: 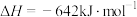 |
您最近一年使用:0次
2024-05-04更新
|
106次组卷
|
2卷引用:河南省郑州市宇华实验学校2023-2024学年高二下学期4月期中考试化学试题
名校
解题方法
6 . CI4分)某化学小组欲测定酸性条件下 溶液与
溶液与 溶液反应的化学反应速率,所用试剂为
溶液反应的化学反应速率,所用试剂为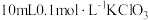 溶液和
溶液和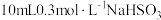 溶液,所得溶液中
溶液,所得溶液中 的浓度
的浓度 随时间变化的曲线如图1和
随时间变化的曲线如图1和 的速率
的速率 随时间的变化关系如图2:
随时间的变化关系如图2:_____ 。
 (已配平)
(已配平)
(2)根据实验数据可知,该反应在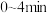 的平均反应速率
的平均反应速率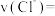
_____ 。
(3)下列说法正确的是_____
A.若纵坐标为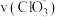 的
的 曲线与图2中的曲线不能重合
曲线与图2中的曲线不能重合
B.图中阴影部分的面积表示 时间内
时间内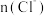 的增大
的增大
C.后期反应速率下降的主要原因是反应物浓度减少
(4)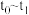 段该反应速率增大,为探究可能的原因,设计如下方案探究影响化学反应速率的因素:
段该反应速率增大,为探究可能的原因,设计如下方案探究影响化学反应速率的因素:
已知: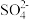 对该反应无影响;
对该反应无影响;
可供选择的试剂有:A. 固体 B.
固体 B. 固体C.
固体C. D.
D.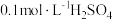 E.
E.
①方案I中所选试剂_____ ,方案Ⅱ中所选试剂_____ 。
②方案Ⅱ烧杯①中加入 水的作用是
水的作用是_____ 。
③除方案I和方案Ⅱ外,请再提出一种可能加快化学反应速率的假设_____ 。
 溶液与
溶液与 溶液反应的化学反应速率,所用试剂为
溶液反应的化学反应速率,所用试剂为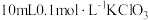 溶液和
溶液和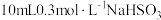 溶液,所得溶液中
溶液,所得溶液中 的浓度
的浓度 随时间变化的曲线如图1和
随时间变化的曲线如图1和 的速率
的速率 随时间的变化关系如图2:
随时间的变化关系如图2: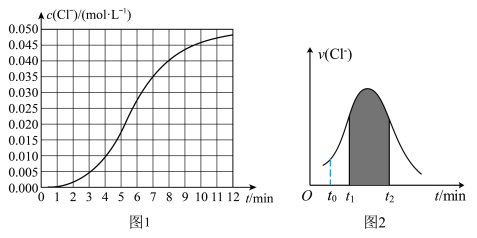
 (已配平)
(已配平)(2)根据实验数据可知,该反应在
 的平均反应速率
的平均反应速率
(3)下列说法正确的是
A.若纵坐标为
 的
的 曲线与图2中的曲线不能重合
曲线与图2中的曲线不能重合B.图中阴影部分的面积表示
 时间内
时间内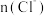 的增大
的增大C.后期反应速率下降的主要原因是反应物浓度减少
(4)
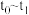 段该反应速率增大,为探究可能的原因,设计如下方案探究影响化学反应速率的因素:
段该反应速率增大,为探究可能的原因,设计如下方案探究影响化学反应速率的因素:已知:
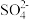 对该反应无影响;
对该反应无影响;可供选择的试剂有:A.
 固体 B.
固体 B. 固体C.
固体C. D.
D.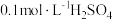 E.
E.
| 方案 | 假设 | 数据处理 | 具体实验操作 |
| I | 反应产物 对反应有催化作用,加快了化学反应速率 对反应有催化作用,加快了化学反应速率 | 取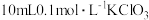 溶液于烧杯中,先加入_____(填字母),再加入 溶液于烧杯中,先加入_____(填字母),再加入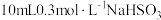 溶液。 溶液。 | 绘制溶液中 浓度 浓度 随时间变化的曲线与图1对比 随时间变化的曲线与图1对比 |
| Ⅱ | 反应中溶液酸性增强,加快了化学反应速率 | 分别向两个烧杯中加入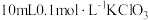 溶液。 溶液。烧杯①:加入  水: 水:烧杯②:加入  _____(填字母)。 _____(填字母)。再分别向两个烧杯中加入 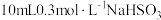 溶液。 溶液。 |
②方案Ⅱ烧杯①中加入
 水的作用是
水的作用是③除方案I和方案Ⅱ外,请再提出一种可能加快化学反应速率的假设
您最近一年使用:0次
名校
7 . 在一定温度下,以 为催化剂,氯苯和
为催化剂,氯苯和 在
在 中发生平行反应,分别生成邻二氯苯和对二氯苯
中发生平行反应,分别生成邻二氯苯和对二氯苯
①两产物浓度之比与反应时间无关。
②反应物起始浓度均为 ,反应30min测得氯苯15%转化为邻二氯苯,25%转化为对二氯苯。下列说法
,反应30min测得氯苯15%转化为邻二氯苯,25%转化为对二氯苯。下列说法不正确 的是
 为催化剂,氯苯和
为催化剂,氯苯和 在
在 中发生平行反应,分别生成邻二氯苯和对二氯苯
中发生平行反应,分别生成邻二氯苯和对二氯苯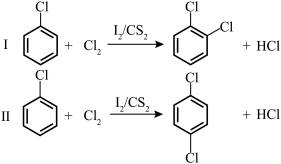
①两产物浓度之比与反应时间无关。
②反应物起始浓度均为
 ,反应30min测得氯苯15%转化为邻二氯苯,25%转化为对二氯苯。下列说法
,反应30min测得氯苯15%转化为邻二氯苯,25%转化为对二氯苯。下列说法| A.反应Ⅰ的活化能大于反应Ⅱ |
| B.保持其他条件不变,改变反应物浓度可以提高产物中邻二氯苯的比例 |
| C.保持其他条件不变,改变催化剂可以提高产物中邻二氯苯的比例 |
| D.保持其他条件不变,适当提高反应温度可以提高产物中邻二氯苯的比例 |
您最近一年使用:0次
2024-04-15更新
|
215次组卷
|
3卷引用:河南省焦作市博爱县第一中学2023-2024学年高三下学期5月月考化学试题
名校
8 . 锂-氧电池(LOB)由于其超高的理论能量密度而被认为是最有前途的储能器件之一、最近,北京大学&清华大学课题组报道了以Pt1Pd为催化剂的LOB,其工作原理如图所示(Pt1Pd为单原子合金催化剂,单原子Pt精确分散在超薄P六方纳米板上)。
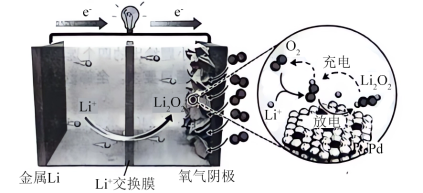
已知:理论能量密度是指在特定条件下,单位体积或表面积内储存的能量大小。
下列叙述正确的是

已知:理论能量密度是指在特定条件下,单位体积或表面积内储存的能量大小。
下列叙述正确的是
| A.放电时“氧气阴极”发生氧化反应 |
| B.LOB理论能量密度高是因为锂是最活泼金属 |
| C.充电时,金属Li电极电势高于另一电极 |
| D.Pt1Pd促进O2/Li2O2氧化还原对的活化,降低反应的活化能 |
您最近一年使用:0次
名校
解题方法
9 . 合成氨原料气高纯氢可以由天然气、水蒸气催化重整制取,所涉及的主要反应如下:
已知:反应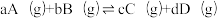 的物质的量分数平衡常数
的物质的量分数平衡常数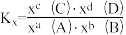 ,其中x(A)、x(B)、x(C)、x(D)为各组分的物质的量分数。
,其中x(A)、x(B)、x(C)、x(D)为各组分的物质的量分数。
请回答下列问题:
(1)298K时,有关物质的相对能量如下表所示。
CH4(g)的相对能量为_____ kJ·mol-l。
(2)反应ⅱ在某催化剂作用下,可能的反应历程如下(*表示吸附在催化剂表面),请写出步骤Ⅱ的方程式。
I.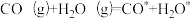
Ⅱ._____ 。
Ⅲ.
Ⅳ.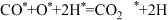
V.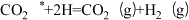
(3)相同条件下,随者反应温度的升高,化学平衡常数Kx1、Kx3的比值(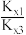 )
)_____ (填“增大”“减小”或“不变”),其原因为_____ 。
(4)T℃时,向2L恒容密闭容器中充入1molCH4和2molH2O(g),发生上述反应i和ⅲ。测得反应达到平衡时,容器中n(CH4)=0.4mol,n(H2)=2mol。
①T℃时,反应中H2O的平衡转化率为_____ 。
②T℃时,反应i的平衡常数Kx1=_____ (列出表达式,无需化简)。
③若将容器的体积压缩为1L,甲烷的平衡转化率_____ (填“增大”“减小”或“不变”,下同),反应ⅲ的逆反应速率_____ 。
④下列图像正确且能表明tmin时反应i达到化学平衡状态的是_____ (填字母)。
A.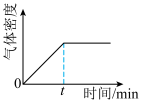 B.
B.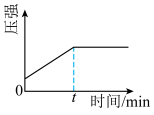 C.
C.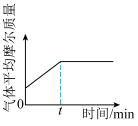 D.
D.
| 相关反应 | △H | 物质的量分数平衡常数 | |
| 反应i | 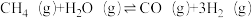 |  | Kx1 |
| 反应ⅱ | 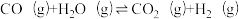 |  | Kx2 |
| 反应iii | 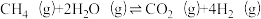 | 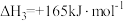 | Kx3 |
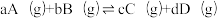 的物质的量分数平衡常数
的物质的量分数平衡常数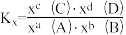 ,其中x(A)、x(B)、x(C)、x(D)为各组分的物质的量分数。
,其中x(A)、x(B)、x(C)、x(D)为各组分的物质的量分数。请回答下列问题:
(1)298K时,有关物质的相对能量如下表所示。
| 物质 | CO(g) | H2O(g) | H2(g) |
| 相对能量/(kJ·mol-1) | -110.5 | -241.8 | 0 |
(2)反应ⅱ在某催化剂作用下,可能的反应历程如下(*表示吸附在催化剂表面),请写出步骤Ⅱ的方程式。
I.
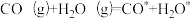
Ⅱ.
Ⅲ.

Ⅳ.
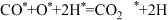
V.
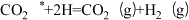
(3)相同条件下,随者反应温度的升高,化学平衡常数Kx1、Kx3的比值(
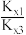 )
)(4)T℃时,向2L恒容密闭容器中充入1molCH4和2molH2O(g),发生上述反应i和ⅲ。测得反应达到平衡时,容器中n(CH4)=0.4mol,n(H2)=2mol。
①T℃时,反应中H2O的平衡转化率为
②T℃时,反应i的平衡常数Kx1=
③若将容器的体积压缩为1L,甲烷的平衡转化率
④下列图像正确且能表明tmin时反应i达到化学平衡状态的是
A.
 B.
B. C.
C. D.
D.
您最近一年使用:0次
名校
解题方法
10 . 甲醇制丙烯的反应为:
 ,已知:速率常数k与反应温度T、活化能
,已知:速率常数k与反应温度T、活化能 之间满足关系:
之间满足关系: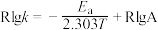 (R和A为常数)。下列说法错误的是
(R和A为常数)。下列说法错误的是

 ,已知:速率常数k与反应温度T、活化能
,已知:速率常数k与反应温度T、活化能 之间满足关系:
之间满足关系: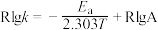 (R和A为常数)。下列说法错误的是
(R和A为常数)。下列说法错误的是
A.加催化剂不能减小 |
| B.升温能改变该反应的速率常数k |
C.已知 、 、 的燃烧热可以计算该反应的 的燃烧热可以计算该反应的 |
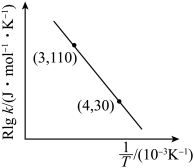
D.若实验得出Rlgk和 的关系如图,可计算该反应的活化能 的关系如图,可计算该反应的活化能 为 为 |
您最近一年使用:0次
2024-01-21更新
|
159次组卷
|
5卷引用:河南省南阳市第一中学校2023-2024学年高二下学期开学考试化学试题
河南省南阳市第一中学校2023-2024学年高二下学期开学考试化学试题 重庆市2024届高三上学期第二次质量检测化学试题重庆市南开中学校2023-2024学年高三上学期10月月考化学试题黑龙江省大庆实验中学实验三部2023-2024学年高三上学期阶段考试(二)化学试题(已下线)专题05 化学反应与能量-【好题汇编】2024年高考化学一模试题分类汇编(新高考七省专用)