解题方法
1 . 甲醇( )作为重要的清洁燃料和合成化学的关键前驱体,在化工行业需求旺盛。以
)作为重要的清洁燃料和合成化学的关键前驱体,在化工行业需求旺盛。以 为催化剂在水溶液中电催化二氧化碳还原为
为催化剂在水溶液中电催化二氧化碳还原为 和
和 的能量变化如图所示:
的能量变化如图所示:
 )作为重要的清洁燃料和合成化学的关键前驱体,在化工行业需求旺盛。以
)作为重要的清洁燃料和合成化学的关键前驱体,在化工行业需求旺盛。以 为催化剂在水溶液中电催化二氧化碳还原为
为催化剂在水溶液中电催化二氧化碳还原为 和
和 的能量变化如图所示:
的能量变化如图所示: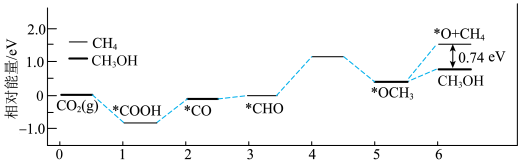
A.生成甲醇反应的决速步为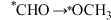 |
| B.两反应只涉及极性键的断裂和生成 |
| C.通过上图分析:甲烷比甲醇稳定 |
D.用 作催化剂可提高甲醇的选择性 作催化剂可提高甲醇的选择性 |
您最近半年使用:0次
解题方法
2 .  分别与
分别与 、
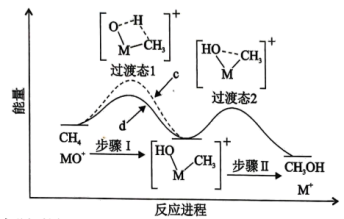
、 反应生成甲醇,体系的能量随反应进程的变化如下图所示(两者历程相似,图中以
反应生成甲醇,体系的能量随反应进程的变化如下图所示(两者历程相似,图中以 示例)。直接参与化学键变化的元素被替换为更重的同位素时,反应速率会变慢。下列说法正确的是
示例)。直接参与化学键变化的元素被替换为更重的同位素时,反应速率会变慢。下列说法正确的是
 分别与
分别与 、
、 反应生成甲醇,体系的能量随反应进程的变化如下图所示(两者历程相似,图中以
反应生成甲醇,体系的能量随反应进程的变化如下图所示(两者历程相似,图中以 示例)。直接参与化学键变化的元素被替换为更重的同位素时,反应速率会变慢。下列说法正确的是
示例)。直接参与化学键变化的元素被替换为更重的同位素时,反应速率会变慢。下列说法正确的是
| A.步骤Ⅰ和Ⅱ涉及极性键和非极性键的变化 |
B. 与 与 反应的能量变化对应图中曲线 反应的能量变化对应图中曲线 |
| C.上述反应达平衡时,升高温度,甲醇的产量升高 |
D.若 与 与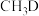 反应,生成的氘代甲醇有2种 反应,生成的氘代甲醇有2种 |
您最近半年使用:0次
名校
3 . 可逆反应aA(g)+bB(s)⇌cC(g)+dD(g),其他条件不变,C的物质的量分数和温度(T)或压强(P)关系如图,其中正确的是
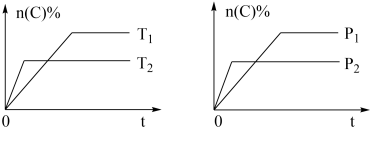

| A.升高温度,平衡向逆反应方向移动 |
| B.使用催化剂,C的物质的量分数增加 |
| C.化学方程式系数a>c+d |
| D.达到平衡后,P1条件V逆反应速率大于P2条件下V正反应速率 |
您最近半年使用:0次
名校
解题方法
4 .  催化还原 NO是重要的烟气脱硝技术,其反应过程与能量关系如图1所示。研究发现,在催化剂上可能发生的反应过程如图2所示。下列说法正确的是
催化还原 NO是重要的烟气脱硝技术,其反应过程与能量关系如图1所示。研究发现,在催化剂上可能发生的反应过程如图2所示。下列说法正确的是
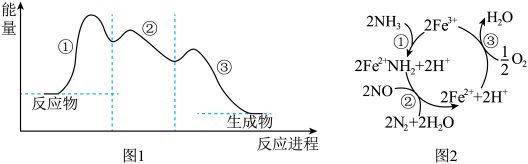
| A.图1三步反应中,第①步反应的活化能最大,为慢反应 |
B.图2中 催化剂 催化剂 |
| C.图2充入过量的O2有利于NO转化为 N2 |
D.图2脱硝的总反应为  |
您最近半年使用:0次
2024-01-22更新
|
67次组卷
|
2卷引用:四川省达州市2023-2024学年高二上学期期末监测化学试题
名校
5 . 某反应过程的能量变化如图所示。下列说法中,不正确的是
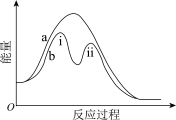
| A.该反应为放热反应 | B.曲线b表示有催化剂参与的反应过程 |
| C.反应i 的∆H>0 | D.反应i比反应ii的速率大 |
您最近半年使用:0次
2024-01-19更新
|
179次组卷
|
4卷引用:四川省什邡中学2023-2024学年高二下学期4月第一次月考化学试题
名校
解题方法
6 . 对反应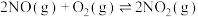 ,
,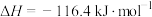 。下列说法正确的是
。下列说法正确的是
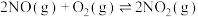 ,
,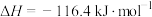 。下列说法正确的是
。下列说法正确的是A.该反应能够自发的原因 |
B.工业上使用合适的催化剂可提高 的生产效率 的生产效率 |
C.升高温度,该反应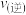 减小, 减小, 增大,平衡向逆反应方向移动 增大,平衡向逆反应方向移动 |
D.2 mol  和1 mol 和1 mol  中所含化学键能总和比2 mol 中所含化学键能总和比2 mol 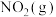 中大116.4 中大116.4  |
您最近半年使用:0次
2024-01-12更新
|
65次组卷
|
3卷引用:四川省内江市威远县威远中学校2023-2024学年高二下学期第一次月考化学试卷
7 . 甲醇是重要的化工原料,可以使用多种方法制备甲醇。
I.利用反应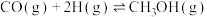
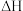 ,若在体积一定的密闭容器中按物质的量之比1:2充入CO和
,若在体积一定的密闭容器中按物质的量之比1:2充入CO和 ,测得平衡混合物中
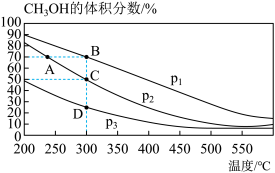
,测得平衡混合物中 的体积分数在不同压强下随温度的变化情况如如图所示。
的体积分数在不同压强下随温度的变化情况如如图所示。
(1)该反应的
______ 0(填“>”“<”或“=”)
(2)达到平衡时,反应速率:A点____ B点(填“>”“<”或“=”)。在C点时,CO的转化率为____ 。
(3)要提高CO的平衡转化率,可以采取的措施是______ (填字母)。
A.加入催化剂 B.增大CO的浓度 C.通入 D.通入惰性气体 E.分离出甲醇
D.通入惰性气体 E.分离出甲醇
(4)关于该反应,下列说法正确的是___________(填字母)。
Ⅱ.利用 与在催化剂的作用下合成甲醇。主反应:
与在催化剂的作用下合成甲醇。主反应: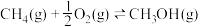 ,在温度为 T℃、压强为
,在温度为 T℃、压强为 条件下,向容器中充入
条件下,向容器中充入 、
、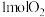 ,充分反应达平衡时
,充分反应达平衡时 的转化率为
的转化率为 。
。
(5)求平衡时 的物质的量为
的物质的量为______ 。
(6)主反应的相对压力平衡常数
___________ ( 表达式写法:在浓度平衡常数表达式中,用相对分压代替浓度。用含p的式子表示)。
表达式写法:在浓度平衡常数表达式中,用相对分压代替浓度。用含p的式子表示)。
I.利用反应
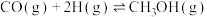
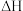 ,若在体积一定的密闭容器中按物质的量之比1:2充入CO和
,若在体积一定的密闭容器中按物质的量之比1:2充入CO和 ,测得平衡混合物中
,测得平衡混合物中 的体积分数在不同压强下随温度的变化情况如如图所示。
的体积分数在不同压强下随温度的变化情况如如图所示。
(1)该反应的

(2)达到平衡时,反应速率:A点
(3)要提高CO的平衡转化率,可以采取的措施是
A.加入催化剂 B.增大CO的浓度 C.通入
 D.通入惰性气体 E.分离出甲醇
D.通入惰性气体 E.分离出甲醇(4)关于该反应,下列说法正确的是___________(填字母)。
| A.该反应在任何温度下都能自发进行 | B.使用催化剂,不能提高CO的平衡转化率 |
| C.升高温度,正反应速率增大,逆反应速率减小 | D.增大压强,该反应的化学平衡常数不变 |
Ⅱ.利用
 与在催化剂的作用下合成甲醇。主反应:
与在催化剂的作用下合成甲醇。主反应: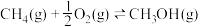 ,在温度为 T℃、压强为
,在温度为 T℃、压强为 条件下,向容器中充入
条件下,向容器中充入 、
、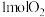 ,充分反应达平衡时
,充分反应达平衡时 的转化率为
的转化率为 。
。(5)求平衡时
 的物质的量为
的物质的量为(6)主反应的相对压力平衡常数

 表达式写法:在浓度平衡常数表达式中,用相对分压代替浓度。用含p的式子表示)。
表达式写法:在浓度平衡常数表达式中,用相对分压代替浓度。用含p的式子表示)。
您最近半年使用:0次
2023-12-23更新
|
52次组卷
|
2卷引用:四川省合江县马街中学校2023-2024学年高二上学期1月期末化学试题
名校
8 . 工业上以铝土矿(主要成分为Al2O3,含少量Fe2O3、FeO、SiO2等杂质)为主要原料制备氧化铝,流程如下。

(1)酸浸:①为加快酸浸速率可以采取的措施有___________ (任写两条)。
②浸渣的主要成分为___________ (填化学式)。
(2)氧化:①用H2O2溶液将Fe2+氧化为Fe3+,反应的离子方程式为___________ 。
②H2O2实际用量比理论上多的原因是___________ (用化学方程式解释)。
(3)沉淀:用Na2CO3溶液调节pH,将Al3+、Fe3+转化为沉淀。溶液终点pH对铝、铁沉淀率的影响如图所示。
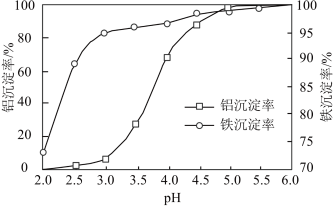
①为获得较高的铝、铁沉淀率,应控制溶液pH最佳为________ (填字母)。
A.4.0左右 B.5.0左右 C.6.0左右
②检验Fe3+沉淀完全的实验方法为________ 。
(4)碱溶:用NaOH溶液溶解沉淀,分离出Fe(OH)3的实验操作为________ (填名称)。
(5)碳分:向“碱溶”后的溶液中通入足量CO2气体,生成Al(OH)3沉淀和NaHCO3,该反应的离子方程式为___________ 。

(1)酸浸:①为加快酸浸速率可以采取的措施有
②浸渣的主要成分为
(2)氧化:①用H2O2溶液将Fe2+氧化为Fe3+,反应的离子方程式为
②H2O2实际用量比理论上多的原因是
(3)沉淀:用Na2CO3溶液调节pH,将Al3+、Fe3+转化为沉淀。溶液终点pH对铝、铁沉淀率的影响如图所示。

①为获得较高的铝、铁沉淀率,应控制溶液pH最佳为
A.4.0左右 B.5.0左右 C.6.0左右
②检验Fe3+沉淀完全的实验方法为
(4)碱溶:用NaOH溶液溶解沉淀,分离出Fe(OH)3的实验操作为
(5)碳分:向“碱溶”后的溶液中通入足量CO2气体,生成Al(OH)3沉淀和NaHCO3,该反应的离子方程式为
您最近半年使用:0次
2023-12-06更新
|
117次组卷
|
2卷引用:四川省内江市威远中学校2023-2024学年高二上学期期中考试化学试题
名校
9 . 下列说法不能用勒夏特列原理解释的是
| A.实验室用排饱和食盐水法收集氯气 | B.振摇后打开可乐瓶盖,观察到大量气泡产生 |
| C.工业合成SO3选用V2O5作催化剂 | D.棕红色NO2加压后颜色先变深后变浅 |
您最近半年使用:0次
2023-11-03更新
|
208次组卷
|
3卷引用:四川省成都市彭州市2023-2024学年高二上学期期中考试化学试题
名校
解题方法
10 . 下列措施与化学反应速率无关的是
| A.炉膛内用煤粉代替煤块 |
| B.食物冷藏在冰箱 |
| C.糖果制作过程中添加着色剂 |
| D.过氧化氢制氧气时,加入氯化铁溶液 |
您最近半年使用:0次
2023-10-27更新
|
36次组卷
|
2卷引用:四川省泸县第一中学2023-2024学年高二上学期12月月考化学试题



