解题方法
1 . 对于 的分解反应,
的分解反应, 、
、 均有一定的催化作用。为比较
均有一定的催化作用。为比较 和
和 对
对 分解的催化效果,某化学研究小组同学分别设计了如图甲、乙所示的实验。下列说法错误的是
分解的催化效果,某化学研究小组同学分别设计了如图甲、乙所示的实验。下列说法错误的是

 的分解反应,
的分解反应, 、
、 均有一定的催化作用。为比较
均有一定的催化作用。为比较 和
和 对
对 分解的催化效果,某化学研究小组同学分别设计了如图甲、乙所示的实验。下列说法错误的是
分解的催化效果,某化学研究小组同学分别设计了如图甲、乙所示的实验。下列说法错误的是
| A.图甲可通过观察气泡产生快慢来比较反应速率的大小 |
| B.用图乙装置测定反应速率,可测定反应产生的气体体积及反应时间 |
| C.为检查图乙所示装置的气密性,可关闭a处旋塞,将注射器活塞拉出一定距离,一段时间后松开活塞,观察活塞是否回到原位 |
D.图甲所示实验中,若左边试管里反应的速率大于右边,则证明 对 对 分解的催化效果比 分解的催化效果比 好 好 |
您最近一年使用:0次
解题方法
2 . 某化学学习小组采用以下方法检验Na2O2中混杂的Na2CO3。下列说法错误的是


| A.Na2O2与水反应过程中有H2O2生成 |
| B.MnO2是催化剂 |
| C.产生白色沉淀,Na2O2样品中含有Na2CO3 |
| D.将Na2O2样品中加入稀盐酸,有气体产生,也可证明含有Na2CO3 |
您最近一年使用:0次
23-24高三上·天津静海·阶段练习
名校
解题方法
3 . 用下列实验装置进行相应实验,能达到实验目的的是
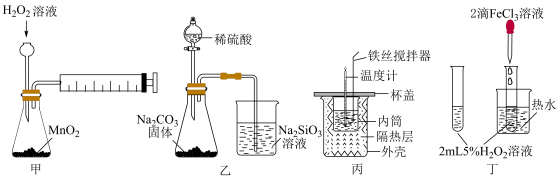

| A.用装置甲定量测定化学反应速率 |
| B.证明非金属性:S>C>Si |
| C.用装置丙准确测定中和反应的反应热 |
D.用装置丁验证 对 对 分解反应有催化作用 分解反应有催化作用 |
您最近一年使用:0次
解题方法
4 . 下列实验的“操作和现象”与“推测或结论”对应关系正确的是
选项 | 操作和现象 | 推测或结论 |
A | 向H2O2溶液中加入几滴FeCl3溶液,溶液中产生气泡 | 发生的离子反应为: |
B | 用铁丝蘸取少量某溶液进行焰色反应,火焰呈黄色 | 该溶液含有钠盐 |
C | 向Al与Fe2O3反应后的固体产物中先加稀硫酸溶解,再加入几滴KSCN溶液,溶液不变红 | 无法证明反应后固体产物中是否含有Fe2O3 |
D | 向无水乙醇中加入浓硫酸,加热至170℃,将产生的气体通入酸性高锰酸钾溶液,红色褪去 | 使溶液褪色的气体是乙烯 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
名校
5 . 下列实验方案不能达到相应实验目的的是
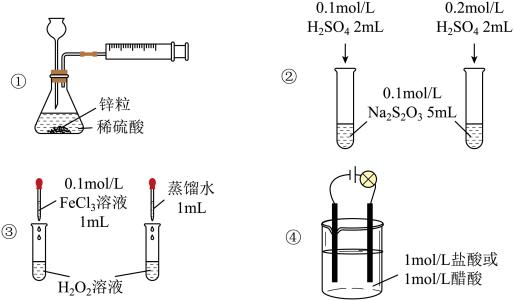

| A.用装置①定量测定化学反应速率 |
| B.用装置②探究H2SO4浓度对化学反应速率的影响 |
| C.用装置③探究催化剂对H2O2分解速率的影响 |
| D.用装置④证明醋酸为弱酸 |
您最近一年使用:0次
名校
解题方法
6 . 下列实验目的能实现的是
| 实验目的 | 操作步骤及现象 | |
| A | 研究浓度对化学平衡的影响 | 2mL 0.001 mol·L-1FeCl3溶液与2mL 0.01 mol·L-1KSCN溶液混合后等分到两支试管,一支加入2mL 0.1 mol·L-1FeCl3溶液,另一支加入2mL H2O,第一支试管中溶液颜色较深 |
| B | 证明MnO2是双氧水分解的催化剂 | 准备两支各装有3%H2O2溶液5mL的试管,一支作对照,向另一支加入1.0g MnO2,发现加入MnO2的试管迅速产生大量气泡,证明MnO2是催化剂 |
| C | 比较AgCl和AgI溶度积的大小 | 向试管中加入2mL 0.1 mol·L-1AgNO3溶液,滴加0.1 mol·L-1NaCl溶液3mL,再滴加0.1 mol·L-1KI溶液,沉淀由白色变黄色 |
| D | 研究浓度对反应速率的影响 | 分别向盛有2 mL 0.1 mol·L-1和2mL 0.2 mol·L-1 KMnO4溶液的两支试管中加入5 mL 0.1 mol·L-1 H2C2O4,第一支试管中溶液先褪色 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2020-06-29更新
|
218次组卷
|
3卷引用:河北省唐山市2020届高三第二次模拟考试理综化学试题
河北省唐山市2020届高三第二次模拟考试理综化学试题(已下线)押山东卷第11题 关于表格实验题的考查-备战2021年高考化学临考题号押题(山东卷)黑龙江省佳木斯市第十二中学2022-2023学年高二上学期期中考试化学试题
名校
7 . 某小组同学设计如下实验,研究亚铁盐与H2O2溶液的反应。
【实验I】试剂:酸化的0.5mol·L-1 FeSO4溶液(pH =0.2),5%H2O2溶液(pH=5)。
(1)上述实验中H2O2溶液与FeSO4溶液反应的离子方程式是________________________ 。
(2)产生气泡的原因是______________________ 。
【实验Ⅱ】试剂:未酸化的0.5mol·L-1FeSO4溶液(pH=3),5% H2O2溶液(pH=5)
(3)将上述混合物分离,得到棕黄色沉淀和红褐色胶体。取部分棕黄色沉淀洗净,加4 mol·L-1盐酸,沉淀溶解得到黄色溶液。初步判断该沉淀中含有Fe2O3,经检验还含有SO42-。检验棕黄色沉淀中SO42-的方法是_______________ 。
(4)对于生成红褐色胶体的原因,提出两种假设:
ⅰ.H2O2溶液氧化Fe2+消耗H+
ii.Fe2+氧化的产物发生了水解
①根据实验Ⅱ记录否定假设ⅰ,理由是____________________ 。
②实验验证假设ⅱ: 取__________ 溶液,加热,溶液变为红褐色,pH下降,证明假设ii成立。
(5)将FeSO4溶液加入H2O2溶液后,产生红褐色胶体,反应的离子方程式是_________________ 。
【实验Ⅲ】若用FeCl2溶液替代FeSO4溶液,其余操作与实验Ⅱ相同,除了产生与Ⅱ相同的现象外,还生成刺激性气味气体,该气体能使湿润的蓝色石蕊试纸变红但不褪色。
(6)产生刺激性气味气体的原因是___________________ 。
(7)由实验I、Ⅱ、Ⅲ可知,亚铁盐与H2O2反应的现象与______________ (至少写两点)有关。
【实验I】试剂:酸化的0.5mol·L-1 FeSO4溶液(pH =0.2),5%H2O2溶液(pH=5)。
| 操作 | 现象 |
| 取2mL上述FeSO4溶液于试管中,加入5滴5%H2O2溶液 | 溶液立即变为棕黄色,稍后,产生气泡。测得反应后溶液pH = 0.9 |
| 向反应后的溶液中加入KSCN溶液 | 溶液变红 |
(2)产生气泡的原因是
【实验Ⅱ】试剂:未酸化的0.5mol·L-1FeSO4溶液(pH=3),5% H2O2溶液(pH=5)
| 操作 | 现象 |
| 取2mL5%H2O2溶液于试管中, 加入5滴上述FeSO4溶液, | 溶液立即变为棕黄色,产生大量气泡,并放热,反应混合物颜色加深且有浑浊。测得反应后溶液pH =1.4 |
(4)对于生成红褐色胶体的原因,提出两种假设:
ⅰ.H2O2溶液氧化Fe2+消耗H+
ii.Fe2+氧化的产物发生了水解
①根据实验Ⅱ记录否定假设ⅰ,理由是
②实验验证假设ⅱ: 取
(5)将FeSO4溶液加入H2O2溶液后,产生红褐色胶体,反应的离子方程式是
【实验Ⅲ】若用FeCl2溶液替代FeSO4溶液,其余操作与实验Ⅱ相同,除了产生与Ⅱ相同的现象外,还生成刺激性气味气体,该气体能使湿润的蓝色石蕊试纸变红但不褪色。
(6)产生刺激性气味气体的原因是
(7)由实验I、Ⅱ、Ⅲ可知,亚铁盐与H2O2反应的现象与
您最近一年使用:0次
2017-06-05更新
|
724次组卷
|
6卷引用:河北省武邑中学2018届高三上学期第三次调研考试化学试题
名校
解题方法
8 . 铱(Ir)的配合物催化氢化 得到甲酸盐的反应机理如图所示,下列说法错误的是
得到甲酸盐的反应机理如图所示,下列说法错误的是
 得到甲酸盐的反应机理如图所示,下列说法错误的是
得到甲酸盐的反应机理如图所示,下列说法错误的是
| A.反应Ⅰ、Ⅱ、Ⅲ均为氧化还原反应 |
| B.反应过程中Ir的成键数目发生了变化 |
C.转化过程总反应的化学方程式为 |
| D.反应涉及极性键和非极性键的断裂与形成 |
您最近一年使用:0次
9 . 二氧化碳和甲烷是两种温室效应气体,将二者进行转化,可得到具有高附加值的化学品或清洁燃料。
(1) 和
和 催化重整制取
催化重整制取 和
和
主反应:①
副反应:②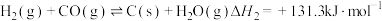
③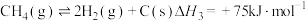
④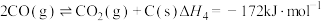
主反应的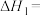
___________ ,该反应在___________ (填“较高温度”或“较低温度”)下可自发进行。
(2) 和
和 反应可制取乙烯,反应的化学方程式为
反应可制取乙烯,反应的化学方程式为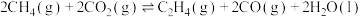 。一定温度下,向某恒容密闭容器中充入
。一定温度下,向某恒容密闭容器中充入 和
和 ,体系的初始压强为
,体系的初始压强为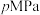 ,若平衡时
,若平衡时 的转化率为
的转化率为 ,不考虑副反应的发生,
,不考虑副反应的发生,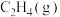 的平衡分压为
的平衡分压为___________ (用 表示,下同),该反应的压强平衡常数
表示,下同),该反应的压强平衡常数
___________ 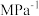 。
。
(3) 过光电化学转化
过光电化学转化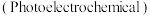 可制得乙二醇,在某催化剂作用下该反应的机理如图所示。图中
可制得乙二醇,在某催化剂作用下该反应的机理如图所示。图中 表示催化剂被光激发出电子之后产生的空穴。
表示催化剂被光激发出电子之后产生的空穴。___________ (填标号)。
A.该反应为自由基型反应
B.生成 的反应为
的反应为
C. 该反应的副产物
该反应的副产物
D.该机理中存在极性键和非极性键的断裂和形成
②以乙二醇为燃料的燃料电池工作时,乙二醇在电池___________ (填“负极”或“正极”)发生反应,若以 溶液为电解液,则该电极的反应式为
溶液为电解液,则该电极的反应式为___________ 。
(4)铜基催化剂电催化还原 制乙醇的两种途径(分别以
制乙醇的两种途径(分别以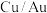 和
和 作催化剂)的相对能量变化如图所示,标“
作催化剂)的相对能量变化如图所示,标“ ”的为吸附在催化剂上的物质。分析可知,以
”的为吸附在催化剂上的物质。分析可知,以___________ 作催化剂的催化效率更高。
(1)
 和
和 催化重整制取
催化重整制取 和
和
主反应:①

副反应:②
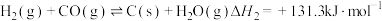
③
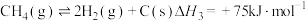
④
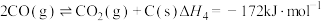
主反应的
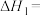
(2)
 和
和 反应可制取乙烯,反应的化学方程式为
反应可制取乙烯,反应的化学方程式为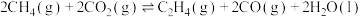 。一定温度下,向某恒容密闭容器中充入
。一定温度下,向某恒容密闭容器中充入 和
和 ,体系的初始压强为
,体系的初始压强为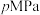 ,若平衡时
,若平衡时 的转化率为
的转化率为 ,不考虑副反应的发生,
,不考虑副反应的发生,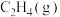 的平衡分压为
的平衡分压为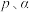 表示,下同),该反应的压强平衡常数
表示,下同),该反应的压强平衡常数
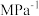 。
。(3)
 过光电化学转化
过光电化学转化 可制得乙二醇,在某催化剂作用下该反应的机理如图所示。图中
可制得乙二醇,在某催化剂作用下该反应的机理如图所示。图中 表示催化剂被光激发出电子之后产生的空穴。
表示催化剂被光激发出电子之后产生的空穴。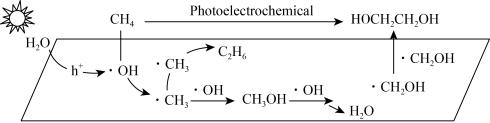
A.该反应为自由基型反应
B.生成
 的反应为
的反应为
C.
 该反应的副产物
该反应的副产物D.该机理中存在极性键和非极性键的断裂和形成
②以乙二醇为燃料的燃料电池工作时,乙二醇在电池
 溶液为电解液,则该电极的反应式为
溶液为电解液,则该电极的反应式为(4)铜基催化剂电催化还原
 制乙醇的两种途径(分别以
制乙醇的两种途径(分别以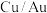 和
和 作催化剂)的相对能量变化如图所示,标“
作催化剂)的相对能量变化如图所示,标“ ”的为吸附在催化剂上的物质。分析可知,以
”的为吸附在催化剂上的物质。分析可知,以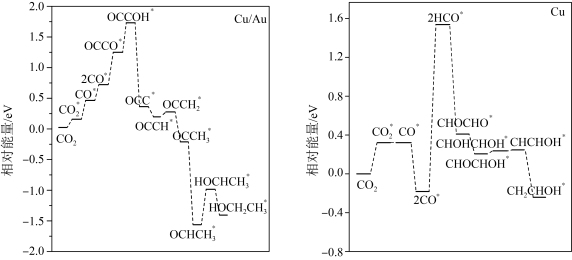
您最近一年使用:0次
名校
10 . 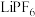 是锂离子电池的一种电解质,
是锂离子电池的一种电解质, ,
, 在水中水解反应历程如图所示。已知
在水中水解反应历程如图所示。已知 代表过渡态,
代表过渡态, 代表产物。
代表产物。
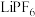 是锂离子电池的一种电解质,
是锂离子电池的一种电解质, ,
, 在水中水解反应历程如图所示。已知
在水中水解反应历程如图所示。已知 代表过渡态,
代表过渡态, 代表产物。
代表产物。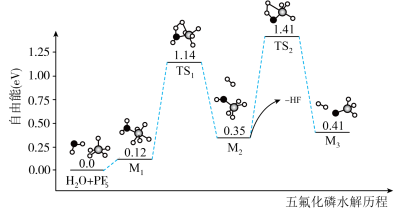
A.总反应的决速步骤为: | B.选用高效催化剂可降低反应的焓变 |
C.升高温度可以增大 的水解程度 的水解程度 | D.PF5水解过程中有极性键的断裂和生成 |
您最近一年使用:0次




