解题方法
1 . 某化学学习小组采用以下方法检验Na2O2中混杂的Na2CO3。下列说法错误的是


| A.Na2O2与水反应过程中有H2O2生成 |
| B.MnO2是催化剂 |
| C.产生白色沉淀,Na2O2样品中含有Na2CO3 |
| D.将Na2O2样品中加入稀盐酸,有气体产生,也可证明含有Na2CO3 |
您最近半年使用:0次
解题方法
2 . 对于 的分解反应,
的分解反应, 、
、 均有一定的催化作用。为比较
均有一定的催化作用。为比较 和
和 对
对 分解的催化效果,某化学研究小组同学分别设计了如图甲、乙所示的实验。下列说法错误的是
分解的催化效果,某化学研究小组同学分别设计了如图甲、乙所示的实验。下列说法错误的是

 的分解反应,
的分解反应, 、
、 均有一定的催化作用。为比较
均有一定的催化作用。为比较 和
和 对
对 分解的催化效果,某化学研究小组同学分别设计了如图甲、乙所示的实验。下列说法错误的是
分解的催化效果,某化学研究小组同学分别设计了如图甲、乙所示的实验。下列说法错误的是
| A.图甲可通过观察气泡产生快慢来比较反应速率的大小 |
| B.用图乙装置测定反应速率,可测定反应产生的气体体积及反应时间 |
| C.为检查图乙所示装置的气密性,可关闭a处旋塞,将注射器活塞拉出一定距离,一段时间后松开活塞,观察活塞是否回到原位 |
D.图甲所示实验中,若左边试管里反应的速率大于右边,则证明 对 对 分解的催化效果比 分解的催化效果比 好 好 |
您最近半年使用:0次
23-24高三上·天津静海·阶段练习
名校
解题方法
3 . 用下列实验装置进行相应实验,能达到实验目的的是
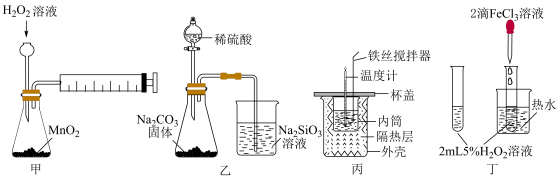

| A.用装置甲定量测定化学反应速率 |
| B.证明非金属性:S>C>Si |
| C.用装置丙准确测定中和反应的反应热 |
D.用装置丁验证 对 对 分解反应有催化作用 分解反应有催化作用 |
您最近半年使用:0次
名校
4 . 下列说法正确的是
| A.在中和热的测定实验中,改变酸碱的用量后所求中和热的数值也随之改变 |
| B.为了证明HClO是弱酸,可用广泛pH试纸测常温下NaClO溶液的pH |
| C.使用合适的催化剂,能增大活化分子百分数,提高原料的平衡转化率 |
D.浓度均为 的氯化铵溶液与氢氧化钠溶液等体积混合,所得溶液中的离子浓度大小关系为 的氯化铵溶液与氢氧化钠溶液等体积混合,所得溶液中的离子浓度大小关系为 |
您最近半年使用:0次
解题方法
5 . 下列实验的“操作和现象”与“推测或结论”对应关系正确的是
选项 | 操作和现象 | 推测或结论 |
A | 向H2O2溶液中加入几滴FeCl3溶液,溶液中产生气泡 | 发生的离子反应为: |
B | 用铁丝蘸取少量某溶液进行焰色反应,火焰呈黄色 | 该溶液含有钠盐 |
C | 向Al与Fe2O3反应后的固体产物中先加稀硫酸溶解,再加入几滴KSCN溶液,溶液不变红 | 无法证明反应后固体产物中是否含有Fe2O3 |
D | 向无水乙醇中加入浓硫酸,加热至170℃,将产生的气体通入酸性高锰酸钾溶液,红色褪去 | 使溶液褪色的气体是乙烯 |
| A.A | B.B | C.C | D.D |
您最近半年使用:0次
名校
6 . 下列实验方案不能达到相应实验目的的是
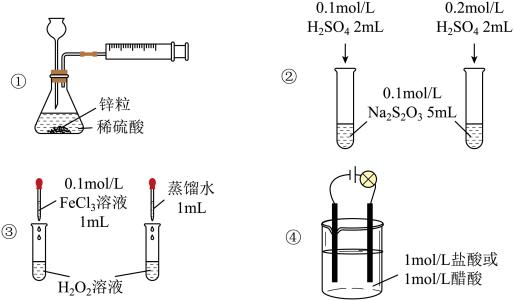

| A.用装置①定量测定化学反应速率 |
| B.用装置②探究H2SO4浓度对化学反应速率的影响 |
| C.用装置③探究催化剂对H2O2分解速率的影响 |
| D.用装置④证明醋酸为弱酸 |
您最近半年使用:0次
19-20高三·山东济南·期中
7 . 下列图示与对应的叙述相符的是
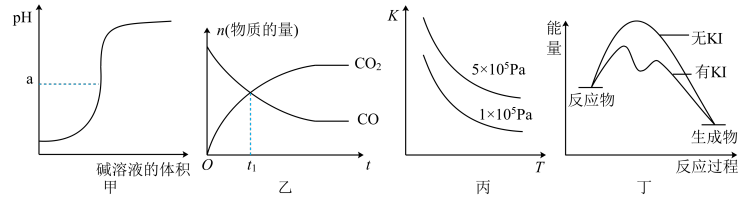

| A.图甲所示,a>7时可表示弱碱滴定强酸的滴定曲线 |
B.图乙所示,2NO(g)+2CO(g) 2CO2(g)+N2(g),t1时刻证明反应达到了平衡状态 2CO2(g)+N2(g),t1时刻证明反应达到了平衡状态 |
C.图丙所示,表示反应 2SO2(g)+O2(g) 2SO3(g);ΔH<0的平衡常数K与温度和压强的关系 2SO3(g);ΔH<0的平衡常数K与温度和压强的关系 |
| D.图丁所示,H2O2分解反应过程中,加入KI可加快反应速率,但不改变焓变 |
您最近半年使用:0次
名校
解题方法
8 . 下列实验目的能实现的是
| 实验目的 | 操作步骤及现象 | |
| A | 研究浓度对化学平衡的影响 | 2mL 0.001 mol·L-1FeCl3溶液与2mL 0.01 mol·L-1KSCN溶液混合后等分到两支试管,一支加入2mL 0.1 mol·L-1FeCl3溶液,另一支加入2mL H2O,第一支试管中溶液颜色较深 |
| B | 证明MnO2是双氧水分解的催化剂 | 准备两支各装有3%H2O2溶液5mL的试管,一支作对照,向另一支加入1.0g MnO2,发现加入MnO2的试管迅速产生大量气泡,证明MnO2是催化剂 |
| C | 比较AgCl和AgI溶度积的大小 | 向试管中加入2mL 0.1 mol·L-1AgNO3溶液,滴加0.1 mol·L-1NaCl溶液3mL,再滴加0.1 mol·L-1KI溶液,沉淀由白色变黄色 |
| D | 研究浓度对反应速率的影响 | 分别向盛有2 mL 0.1 mol·L-1和2mL 0.2 mol·L-1 KMnO4溶液的两支试管中加入5 mL 0.1 mol·L-1 H2C2O4,第一支试管中溶液先褪色 |
| A.A | B.B | C.C | D.D |
您最近半年使用:0次
2020-06-29更新
|
214次组卷
|
3卷引用:河北省唐山市2020届高三第二次模拟考试理综化学试题
河北省唐山市2020届高三第二次模拟考试理综化学试题(已下线)押山东卷第11题 关于表格实验题的考查-备战2021年高考化学临考题号押题(山东卷)黑龙江省佳木斯市第十二中学2022-2023学年高二上学期期中考试化学试题
名校
9 . 某小组同学设计如下实验,研究亚铁盐与H2O2溶液的反应。
【实验I】试剂:酸化的0.5mol·L-1 FeSO4溶液(pH =0.2),5%H2O2溶液(pH=5)。
(1)上述实验中H2O2溶液与FeSO4溶液反应的离子方程式是________________________ 。
(2)产生气泡的原因是______________________ 。
【实验Ⅱ】试剂:未酸化的0.5mol·L-1FeSO4溶液(pH=3),5% H2O2溶液(pH=5)
(3)将上述混合物分离,得到棕黄色沉淀和红褐色胶体。取部分棕黄色沉淀洗净,加4 mol·L-1盐酸,沉淀溶解得到黄色溶液。初步判断该沉淀中含有Fe2O3,经检验还含有SO42-。检验棕黄色沉淀中SO42-的方法是_______________ 。
(4)对于生成红褐色胶体的原因,提出两种假设:
ⅰ.H2O2溶液氧化Fe2+消耗H+
ii.Fe2+氧化的产物发生了水解
①根据实验Ⅱ记录否定假设ⅰ,理由是____________________ 。
②实验验证假设ⅱ: 取__________ 溶液,加热,溶液变为红褐色,pH下降,证明假设ii成立。
(5)将FeSO4溶液加入H2O2溶液后,产生红褐色胶体,反应的离子方程式是_________________ 。
【实验Ⅲ】若用FeCl2溶液替代FeSO4溶液,其余操作与实验Ⅱ相同,除了产生与Ⅱ相同的现象外,还生成刺激性气味气体,该气体能使湿润的蓝色石蕊试纸变红但不褪色。
(6)产生刺激性气味气体的原因是___________________ 。
(7)由实验I、Ⅱ、Ⅲ可知,亚铁盐与H2O2反应的现象与______________ (至少写两点)有关。
【实验I】试剂:酸化的0.5mol·L-1 FeSO4溶液(pH =0.2),5%H2O2溶液(pH=5)。
| 操作 | 现象 |
| 取2mL上述FeSO4溶液于试管中,加入5滴5%H2O2溶液 | 溶液立即变为棕黄色,稍后,产生气泡。测得反应后溶液pH = 0.9 |
| 向反应后的溶液中加入KSCN溶液 | 溶液变红 |
(2)产生气泡的原因是
【实验Ⅱ】试剂:未酸化的0.5mol·L-1FeSO4溶液(pH=3),5% H2O2溶液(pH=5)
| 操作 | 现象 |
| 取2mL5%H2O2溶液于试管中, 加入5滴上述FeSO4溶液, | 溶液立即变为棕黄色,产生大量气泡,并放热,反应混合物颜色加深且有浑浊。测得反应后溶液pH =1.4 |
(4)对于生成红褐色胶体的原因,提出两种假设:
ⅰ.H2O2溶液氧化Fe2+消耗H+
ii.Fe2+氧化的产物发生了水解
①根据实验Ⅱ记录否定假设ⅰ,理由是
②实验验证假设ⅱ: 取
(5)将FeSO4溶液加入H2O2溶液后,产生红褐色胶体,反应的离子方程式是
【实验Ⅲ】若用FeCl2溶液替代FeSO4溶液,其余操作与实验Ⅱ相同,除了产生与Ⅱ相同的现象外,还生成刺激性气味气体,该气体能使湿润的蓝色石蕊试纸变红但不褪色。
(6)产生刺激性气味气体的原因是
(7)由实验I、Ⅱ、Ⅲ可知,亚铁盐与H2O2反应的现象与
您最近半年使用:0次
2017-06-05更新
|
724次组卷
|
6卷引用:河北省武邑中学2018届高三上学期第三次调研考试化学试题
名校
解题方法
10 . 近年来,以清洁的氢气选择性催化还原 引起研究者的青睐,某研究以贵金属Pt为主要催化剂,催化还原
引起研究者的青睐,某研究以贵金属Pt为主要催化剂,催化还原 主要发生在金属(Pt)表面、金属与载体界面(Pt-HY)和载体(HY)表面,反应机理如下:
主要发生在金属(Pt)表面、金属与载体界面(Pt-HY)和载体(HY)表面,反应机理如下:_______ ,NO在空气中容易和氧气发生反应,结合下表数据,请写出NO与 反应的热化学方程式:
反应的热化学方程式:_____ 。
(2)研究表明,当催化剂表面有Pt活性位且有相邻的氧空位时,与Pt活性位直接吸附NO相比,更有利于 的生成。下图是
的生成。下图是 和改良后
和改良后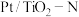 的催化剂的活性比较,请结合题干信息说明改良后的催化剂活性明显高于
的催化剂的活性比较,请结合题干信息说明改良后的催化剂活性明显高于 的原因
的原因_______ 。 的脱除率和反应机理的关系图如下,下列有关说法正确的是_______。(填标号)
的脱除率和反应机理的关系图如下,下列有关说法正确的是_______。(填标号)
(4)理论上 和
和 也可以作为还原剂进行
也可以作为还原剂进行 的脱除,下图为
的脱除,下图为 和
和 在1200℃下、过量空气系数(直接反映为氧气浓度)为0~1.2时NO还原率的变化。随着过量空气系数的增加,
在1200℃下、过量空气系数(直接反映为氧气浓度)为0~1.2时NO还原率的变化。随着过量空气系数的增加, 对NO的脱除率趋势为
对NO的脱除率趋势为______ ;请结合所学及题干信息,推测趋势呈现的原因:_______ 。 、
、 、
、 及CO作为还原剂,在相同条件不同温度下进行
及CO作为还原剂,在相同条件不同温度下进行 的脱除,脱除率如下图:
的脱除,脱除率如下图:______ (填化学式)。
② 在还原NO时,一般在有氧环境下进行,主要存在以下两个竞争反应:
在还原NO时,一般在有氧环境下进行,主要存在以下两个竞争反应:
反应Ⅰ: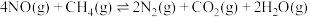
反应Ⅱ:
实验室利用计算机在10L的容器中模拟1350℃时 还原NO,原始投料:
还原NO,原始投料: 的物质的量为10mol,NO的物质的量为5mol,
的物质的量为10mol,NO的物质的量为5mol, 的物质的量为16mol,反应达到平衡时,NO脱除率为64%,
的物质的量为16mol,反应达到平衡时,NO脱除率为64%, 转化率为80%,则此反应条件下反应Ⅱ的平衡常数K:
转化率为80%,则此反应条件下反应Ⅱ的平衡常数K:______ 。
 引起研究者的青睐,某研究以贵金属Pt为主要催化剂,催化还原
引起研究者的青睐,某研究以贵金属Pt为主要催化剂,催化还原 主要发生在金属(Pt)表面、金属与载体界面(Pt-HY)和载体(HY)表面,反应机理如下:
主要发生在金属(Pt)表面、金属与载体界面(Pt-HY)和载体(HY)表面,反应机理如下: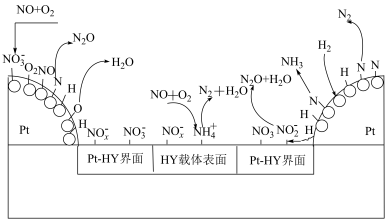
 反应的热化学方程式:
反应的热化学方程式:| 物质 |  |  |  |
| 1mol物质中化学键断裂所需要的能量/kJ | 631 | 498 | 937 |
(2)研究表明,当催化剂表面有Pt活性位且有相邻的氧空位时,与Pt活性位直接吸附NO相比,更有利于
 的生成。下图是
的生成。下图是 和改良后
和改良后 的催化剂的活性比较,请结合题干信息说明改良后的催化剂活性明显高于
的催化剂的活性比较,请结合题干信息说明改良后的催化剂活性明显高于 的原因
的原因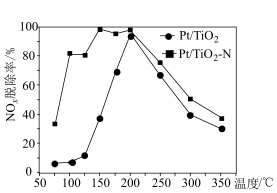
 的脱除率和反应机理的关系图如下,下列有关说法正确的是_______。(填标号)
的脱除率和反应机理的关系图如下,下列有关说法正确的是_______。(填标号)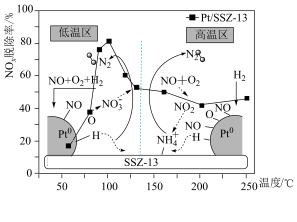
A.在低温区,NO与催化剂表面的吸附O结合为 ,最终转化为 ,最终转化为 |
B.高温区,NO先被还原为 ,再转化为 ,再转化为 ,最终转化为 ,最终转化为 |
C.适当增大 的用量,有利于在催化剂表面形成吸附O,在一定范围内提高 的用量,有利于在催化剂表面形成吸附O,在一定范围内提高 的脱除率 的脱除率 |
D.在恒温恒容密闭容器中,通入惰性气体以增加体系压强,有利于提升 的脱除率 的脱除率 |
(4)理论上
 和
和 也可以作为还原剂进行
也可以作为还原剂进行 的脱除,下图为
的脱除,下图为 和
和 在1200℃下、过量空气系数(直接反映为氧气浓度)为0~1.2时NO还原率的变化。随着过量空气系数的增加,
在1200℃下、过量空气系数(直接反映为氧气浓度)为0~1.2时NO还原率的变化。随着过量空气系数的增加, 对NO的脱除率趋势为
对NO的脱除率趋势为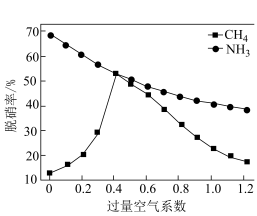
 、
、 、
、 及CO作为还原剂,在相同条件不同温度下进行
及CO作为还原剂,在相同条件不同温度下进行 的脱除,脱除率如下图:
的脱除,脱除率如下图: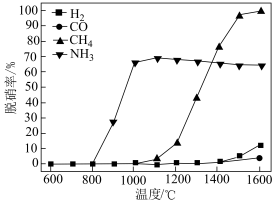
②
 在还原NO时,一般在有氧环境下进行,主要存在以下两个竞争反应:
在还原NO时,一般在有氧环境下进行,主要存在以下两个竞争反应:反应Ⅰ:
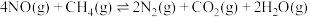
反应Ⅱ:

实验室利用计算机在10L的容器中模拟1350℃时
 还原NO,原始投料:
还原NO,原始投料: 的物质的量为10mol,NO的物质的量为5mol,
的物质的量为10mol,NO的物质的量为5mol, 的物质的量为16mol,反应达到平衡时,NO脱除率为64%,
的物质的量为16mol,反应达到平衡时,NO脱除率为64%, 转化率为80%,则此反应条件下反应Ⅱ的平衡常数K:
转化率为80%,则此反应条件下反应Ⅱ的平衡常数K:
您最近半年使用:0次
2024-05-03更新
|
184次组卷
|
3卷引用:2024届河北省雄安新区雄安部分高中高三下学期一模化学试题
2024届河北省雄安新区雄安部分高中高三下学期一模化学试题河北省石家庄市河北正定中学2023-2024学年高三下学期第一次月考化学试题(已下线)提升练09 化学反应原理综合-【查漏补缺】2024年高考化学复习冲刺过关(新高考专用)




