名校
解题方法
1 . 下列实验能达到实验目的的是


A.用装置甲探究 、 、 对 对 分解速率的影响 分解速率的影响 |
B.用装置乙蒸干 溶液制备无水 溶液制备无水 固体 固体 |
C.用装置丙制备 并能较长时间观察其颜色 并能较长时间观察其颜色 |
| D.用装置丁滴定未知浓度的醋酸溶液 |
您最近一年使用:0次
名校
2 . 利用下列装置进行实验,能达到实验目的的是
| 选项 | A | B | C | D |
| 实验装置 | 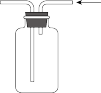 | 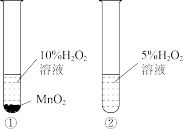 | 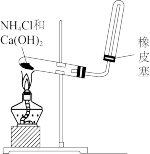 | 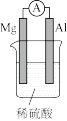 |
| 实验目的 | 收集NO | 探究催化剂对反应速率的影响 | 制备并收集 | 验证Mg比Al活泼 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2022-07-08更新
|
135次组卷
|
2卷引用:陕西省西北工业大学附属中学2022-2023学年高二上学期1月期末考试化学试题
17-18高一下·湖北·期中
名校
解题方法
3 . 为了探究外界条件对过氧化氢分解速率的影响,某化学兴趣小组的同学做了以下实验。请回答下列问题:
(1)实验①的目的是其它条件相同时,探究______ 条件对H2O2分解速率的影响。
(2)实验②未观察到预期的实验现象,为了帮助该组同学达到实验目的,请你用实验中所提供的几种试剂,对上述操作进行的改进是____________________________________ 。
(3)某同学在50mL一定浓度的H2O2溶液中加入适量的二氧化锰,放出气体的体积(标准状况下)与反应时间的关系如图所示,则A、B、C三点所表示的瞬时反应速率最慢的是____ (填字母代号)。

(4)对于H2O2分解反应,Cu2+也有一定的催化作用。为比较Fe3+和Cu2+对H2O2分解的催化效果,该化学兴趣小组的同学分别设计了如图甲、乙所示的实验。请回答相关问题:
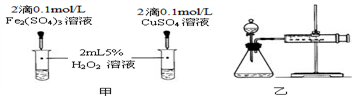
①定性分析:如图甲可通过观察________________________ ,定性比较得出结论;该实验中将FeCl3溶液改为Fe2(SO4)3溶液的原因是______________________ 。
②定量分析:用图乙所示装置做对照试验,实验时均以3min时间为准,其它可能影响实验的因素均已忽略。实验中需要测量的数据是________________ ,所需仪器为_______ 。
(5)通过对上述实验过程的分析,在实验设计时,要考虑_________ 思想方法的应用。
| 编号 | 实验操作 | 实验现象 |
| ① | 分别在试管A、B中加入5mL5%H2O2溶液,各滴入2滴1mol/LFeCl3溶液。待试管中均有适量气泡出现时,将试管A放入盛有5℃左右冷水的烧杯中浸泡;将试管B放入盛有40℃左右热水的烧杯中浸泡。 | 试管A中不再产生气泡; 试管B中产生的气泡量增多。 |
| ② | 另取两支试管分别加入5mL5%H2O2溶液和5mL10%H2O2溶液。 | 两支试管中均未明显见到有气泡产生。 |
(1)实验①的目的是其它条件相同时,探究
(2)实验②未观察到预期的实验现象,为了帮助该组同学达到实验目的,请你用实验中所提供的几种试剂,对上述操作进行的改进是
(3)某同学在50mL一定浓度的H2O2溶液中加入适量的二氧化锰,放出气体的体积(标准状况下)与反应时间的关系如图所示,则A、B、C三点所表示的瞬时反应速率最慢的是

(4)对于H2O2分解反应,Cu2+也有一定的催化作用。为比较Fe3+和Cu2+对H2O2分解的催化效果,该化学兴趣小组的同学分别设计了如图甲、乙所示的实验。请回答相关问题:

①定性分析:如图甲可通过观察
②定量分析:用图乙所示装置做对照试验,实验时均以3min时间为准,其它可能影响实验的因素均已忽略。实验中需要测量的数据是
(5)通过对上述实验过程的分析,在实验设计时,要考虑
您最近一年使用:0次
2018-04-25更新
|
651次组卷
|
4卷引用:《2018-2019学年同步单元双基双测AB卷》第二单元 化学反应速率与化学平衡单元测试A卷
(已下线)《2018-2019学年同步单元双基双测AB卷》第二单元 化学反应速率与化学平衡单元测试A卷河北省邯郸市大名县第一中学2020-2021学年高二上学期10月月考化学(实验班)试题湖北省沙市中学2017-2018学年高一下学期期中考试化学试题江苏省启东中学2017-2018学年高一下学期期中考试化学试题
名校
4 . 利用如图实验装置进行相应实验,能达到实验目的的是
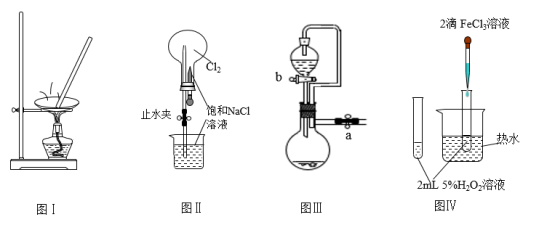

| A.利用图Ⅰ装置蒸发KCl溶液制备无水KCl |
| B.利用图Ⅱ装置进行喷泉实验 |
| C.图Ⅲ装置中,关闭a、打开b,可检查装置的气密性 |
D.利用图Ⅳ装置验证 分解反应有催化作用 分解反应有催化作用 |
您最近一年使用:0次
2021-10-11更新
|
390次组卷
|
5卷引用:四川省宜宾市叙州区第二中学校2023-2024学年高二上学期12月月考化学试题
四川省宜宾市叙州区第二中学校2023-2024学年高二上学期12月月考化学试题福建省莆田市第二中学2022届高三10月月考化学试题福建省泉州市城东中学2021-2022学年高三上学期10月月考化学试题(已下线)提升卷02-【新高考新题型】2022年高考化学选择题标准化练习20卷(山东专用)福建省福州市六校联考2022-2023学年高一下学期期末考试化学试题
名校
5 . 下列设计的实验方案能达到实验目的的是
| A.制备Al(OH)3悬浊液:向1mol·L-1的AlCl3溶液中加过量的6mol·L-1NaOH溶液 |
| B.提纯含有少量乙酸的乙酸乙酯:向含有少量乙酸的乙酸乙酯中加入氢氧化钠溶液,振荡后静置分液,并除去有机相的水 |
| C.检验溶液中是否含有Fe3+:取少量待检验溶液,向其中加入少量新制氯水,再滴加KSCN溶液,观察实验现象 |
| D.探究催化剂对H2O2分解速率的影响:在相同条件下,向一支试管中加入2mL5%H2O2和1mLH2O,向另一支试管中加入2mL5%H2O2和1mLFeCl3溶液,观察并比较实验现象 |
您最近一年使用:0次
2016-12-09更新
|
199次组卷
|
6卷引用:浙江省三校2022-2023学年高二上学期10月联考化学试题
2023·山东·模拟预测
名校
解题方法
6 . 亚硝酰硫酸(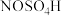 )在重氮化反应中可以代替亚硝酸钠。实验室用如图所示装置(部分夹持仪器略)制备少量亚硝酰硫酸,并测定产品纯度。
)在重氮化反应中可以代替亚硝酸钠。实验室用如图所示装置(部分夹持仪器略)制备少量亚硝酰硫酸,并测定产品纯度。
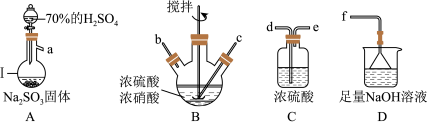
已知:i.亚硝酰硫酸遇水分解为硫酸、硝酸和NO,溶于浓硫酸而不分解;
 .实验室制备亚硝酰硫酸的原理为
.实验室制备亚硝酰硫酸的原理为 ,
,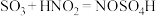 。
。
(1)仪器Ⅰ的名称为___________ ,按照气流从左到右的顺序,上述仪器的连接顺序为___________ (填仪器接口的字母,字母之间用“→”连接,部分仪器可以重复使用),C装置的作用为___________ 。
(2)反应需控制温度在25~40℃,采用的加热措施为___________ ,开始时反应缓慢,但某时刻反应速率明显加快,其原因可能是___________ 。
(3)测定亚硝酰硫酸的纯度:
步骤①:准确称取 产品,在特定条件下配制成
产品,在特定条件下配制成 溶液。
溶液。
步骤②:取 溶液于锥形瓶中,加入
溶液于锥形瓶中,加入 未知浓度
未知浓度 溶液(过量)和
溶液(过量)和 的
的 溶液,摇匀,发生反应
溶液,摇匀,发生反应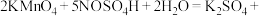
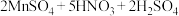
步骤③:向该溶液中滴加 标准溶液进行滴定,消耗
标准溶液进行滴定,消耗 溶液的体积为
溶液的体积为 。
。
步骤④:把亚硝酰硫酸溶液换为蒸馏水(空白实验),重复上述步骤,消耗 溶液的体积为
溶液的体积为 。
。
滴定终点时的现象为___________ ,亚硝酰硫酸的纯度为___________ (精确到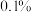 )。
)。
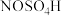 )在重氮化反应中可以代替亚硝酸钠。实验室用如图所示装置(部分夹持仪器略)制备少量亚硝酰硫酸,并测定产品纯度。
)在重氮化反应中可以代替亚硝酸钠。实验室用如图所示装置(部分夹持仪器略)制备少量亚硝酰硫酸,并测定产品纯度。
已知:i.亚硝酰硫酸遇水分解为硫酸、硝酸和NO,溶于浓硫酸而不分解;
 .实验室制备亚硝酰硫酸的原理为
.实验室制备亚硝酰硫酸的原理为 ,
,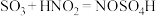 。
。(1)仪器Ⅰ的名称为
(2)反应需控制温度在25~40℃,采用的加热措施为
(3)测定亚硝酰硫酸的纯度:
步骤①:准确称取
 产品,在特定条件下配制成
产品,在特定条件下配制成 溶液。
溶液。步骤②:取
 溶液于锥形瓶中,加入
溶液于锥形瓶中,加入 未知浓度
未知浓度 溶液(过量)和
溶液(过量)和 的
的 溶液,摇匀,发生反应
溶液,摇匀,发生反应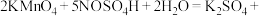
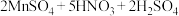
步骤③:向该溶液中滴加
 标准溶液进行滴定,消耗
标准溶液进行滴定,消耗 溶液的体积为
溶液的体积为 。
。步骤④:把亚硝酰硫酸溶液换为蒸馏水(空白实验),重复上述步骤,消耗
 溶液的体积为
溶液的体积为 。
。滴定终点时的现象为
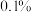 )。
)。
您最近一年使用:0次
2023-05-19更新
|
454次组卷
|
6卷引用:第18练 化学实验综合题 -2023年【暑假分层作业】高二化学(2024届一轮复习通用)
(已下线)第18练 化学实验综合题 -2023年【暑假分层作业】高二化学(2024届一轮复习通用)江西省丰城中学、新建二中2022-2023学年高二下学期期末联考化学试题山东省聊城市百师联盟2023届高三下学期(二轮复习联考)模拟预测(三)化学试题山西省忻州市2023届高三下学期二轮复习联考(三)理综化学试题河南省开封市2022-2023学年高三下学期5月月考理综化学试题(已下线)实验探究题
名校
7 . 乙醇催化氧化制取乙醛(沸点为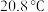 ,能与水互溶)的装置(夹持装置已略)如图所示。下列说法错误的是
,能与水互溶)的装置(夹持装置已略)如图所示。下列说法错误的是
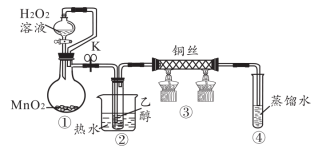
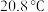 ,能与水互溶)的装置(夹持装置已略)如图所示。下列说法错误的是
,能与水互溶)的装置(夹持装置已略)如图所示。下列说法错误的是
A.装置①制备 过程 过程 作为氧化剂 作为氧化剂 |
| B.装置②利用了乙醇的挥发性 |
| C.装置③的铜丝出现黑红交替现象 |
| D.装置④可以吸收未反应的乙醇和产物乙醛 |
您最近一年使用:0次
解题方法
8 . 过氧乙酸(CH3COOOH)不仅在卫生医疗、食品消毒及漂白剂领域有广泛应用,也应用于环境工程、精细化工等领域。实验室利用醋酸(CH3COOH)与双氧水(H2O2)共热,在固体酸的催化下制备过氧乙酸(CH3COOOH),其装置如下图所示。请回答下列问题:
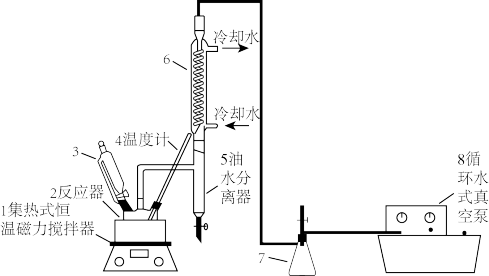
实验步骤:
Ⅰ.先在反应瓶中加入冰醋酸、乙酸丁酯和固体酸催化剂,开通仪器1和8,温度维持为55℃;
Ⅱ.待真空度达到反应要求时,打开仪器3的活塞,逐滴滴入浓度为35%的双氧水,再通入冷却水;
Ⅲ.从仪器5定期放出乙酸丁酯和水的混合物,待反应结束后分离反应器2中的混合物,得到粗产品。
(1)反应器 2中制备过氧乙酸(CH3COOOH)的化学反应方程式为_______ 。
(2)反应中维持冰醋酸过量,目的是提高_______ ;分离反应器 中的混合物得到粗产品,分离的方法是
中的混合物得到粗产品,分离的方法是_______ 。
(3)实验中加入乙酸丁酯的主要作用是_______(选填字母序号)。
(4)待观察到_______ (填现象)时,反应结束。
(5)粗产品中过氧乙酸(CH3COOOH)含量的测定:取一定体积的样品V mL,分成6等份,用过量KI溶液与过氧化物作用,以0.1 mol·L-1的硫代硫酸钠溶液滴定碘(I2+2S2O =2I-+S4O
=2I-+S4O );重复3次,平均消耗量为V1 mL。再以0.02 mol·L-1的酸性高锰酸钾溶液滴定样品,重复3次,平均消耗量为V2 mL。则样品中的过氧乙酸的浓度为
);重复3次,平均消耗量为V1 mL。再以0.02 mol·L-1的酸性高锰酸钾溶液滴定样品,重复3次,平均消耗量为V2 mL。则样品中的过氧乙酸的浓度为_______ mol·L-1。
(6)通过研究发现Fe3+、Cu2+可催化过氧乙酸分解为氧气和乙酸,现需设计实验比较Fe3+、Cu2+对过氧乙酸的催化效率。可供选择的试剂和主要器材有:a. 过氧乙酸溶液、b. 1mol·L-1的FeCl3溶液、c. 0.5 mol·L-1的Fe2(SO4)3溶液、d. 0.5 mol·L-1的CuCl2溶液、e.1 mol·L-1的CuSO4溶液、f.计时器、g.测量气体体积的针筒、i. 带导气管的试管。
你设计的实验方案为_______ 。

实验步骤:
Ⅰ.先在反应瓶中加入冰醋酸、乙酸丁酯和固体酸催化剂,开通仪器1和8,温度维持为55℃;
Ⅱ.待真空度达到反应要求时,打开仪器3的活塞,逐滴滴入浓度为35%的双氧水,再通入冷却水;
Ⅲ.从仪器5定期放出乙酸丁酯和水的混合物,待反应结束后分离反应器2中的混合物,得到粗产品。
(1)反应器 2中制备过氧乙酸(CH3COOOH)的化学反应方程式为
(2)反应中维持冰醋酸过量,目的是提高
 中的混合物得到粗产品,分离的方法是
中的混合物得到粗产品,分离的方法是(3)实验中加入乙酸丁酯的主要作用是_______(选填字母序号)。
| A.作为反应溶剂,提高反应速率 |
| B.与固体酸一同作为催化剂使用,提高反应速率 |
| C.与水形成沸点更低的混合物,利于水的蒸发,提高产率 |
| D.增大油水分离器5的液体量,便于实验观察 |
(5)粗产品中过氧乙酸(CH3COOOH)含量的测定:取一定体积的样品V mL,分成6等份,用过量KI溶液与过氧化物作用,以0.1 mol·L-1的硫代硫酸钠溶液滴定碘(I2+2S2O
 =2I-+S4O
=2I-+S4O );重复3次,平均消耗量为V1 mL。再以0.02 mol·L-1的酸性高锰酸钾溶液滴定样品,重复3次,平均消耗量为V2 mL。则样品中的过氧乙酸的浓度为
);重复3次,平均消耗量为V1 mL。再以0.02 mol·L-1的酸性高锰酸钾溶液滴定样品,重复3次,平均消耗量为V2 mL。则样品中的过氧乙酸的浓度为(6)通过研究发现Fe3+、Cu2+可催化过氧乙酸分解为氧气和乙酸,现需设计实验比较Fe3+、Cu2+对过氧乙酸的催化效率。可供选择的试剂和主要器材有:a. 过氧乙酸溶液、b. 1mol·L-1的FeCl3溶液、c. 0.5 mol·L-1的Fe2(SO4)3溶液、d. 0.5 mol·L-1的CuCl2溶液、e.1 mol·L-1的CuSO4溶液、f.计时器、g.测量气体体积的针筒、i. 带导气管的试管。
你设计的实验方案为
您最近一年使用:0次
2022-06-25更新
|
156次组卷
|
2卷引用:辽宁省部分中学2021-2022学年高二下学期期末检测化学试题
名校
9 . 下列实验操作、实验现象及实验目的均正确的是
| 选项 | 实验操作 | 实验现象 | 实验目的 |
| A | 向2 mL 0.1 mol·L−1AgNO3溶液中先后加入5滴0.1 mol·L−1NaCl溶液和5滴0.1 mol·L−1 KI溶液 | 先出现白色沉淀,后出现黄色沉淀 | 证明Ksp(AgCl) > Ksp(AgI) |
| B | 向两支装有2 mL 5% H2O2溶液的试管中分别滴入0.1 mol·L−1 FeCl3溶液和0.1 mol·L−1 CuCl2溶液各1 mL(Cl−不影响催化效果) | 滴入FeCl3溶液的试管中产生气泡速率更快 | 证明Fe3+对H2O2分解的催化效果好于Cu2+ |
| C | 向加了酚酞的Na2CO3溶液中加适量蒸馏水 | 溶液红色变深 | Na2CO3溶液的水解平衡正向移动 |
| D | 向铁粉与稀硝酸反应后的溶液中滴入铁氰化钾溶液 | 溶液中出现带有特征蓝色的沉淀 | 溶液中含Fe2+,不含Fe3+ |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
23-24高二·全国·假期作业
10 . 某学生为探究锌与稀盐酸反应的速率变化,用排水集气法收集反应放出的氢气。所用稀盐酸浓度有1.00mol·L-1、2.00mol·L-1两种浓度,每次实验稀盐酸的用量为25.00mL,锌有细颗粒与粗颗粒两种规格,用量为6.50g。实验温度为25℃、35℃。(已知Zn2+对该反应速率无影响)
(1)请在实验目的一栏中的空白项处填出对应的实验编号:
(2)实验①记录如下(换算成标况):
①计算在30~40s范围内盐酸的平均反应速率ν(HCl)=___________ (忽略溶液体积变化);
②反应速率最大的时间段(如0~10s)为___________ ,可能原因是___________ ;
③反应速率后段明显下降的主要影响因素是___________ 。
(3)某化学研究小组的同学为比较Fe3+和Cu2+对H2O2分解的催化效果,设计了如图所示的实验。___________ 现象,比较得出Fe3+和Cu2+对H2O2分解的催化效果结论;
②某同学提出将FeCl3改为Fe2(SO4)3更为合理,其理由是___________ 。
(1)请在实验目的一栏中的空白项处填出对应的实验编号:
| 编号 | t/℃ | 锌规格 | 盐酸浓度/mol·L-1 | 实验目的 |
| ① | 25 | 粗颗粒 | 2.00 | I.实验①和②探究盐酸浓度对该反应速率的影响; Ⅱ.实验 Ⅲ.实验 |
| ② | 25 | 粗颗粒 | 1.00 | |
| ③ | 35 | 粗颗粒 | 2.00 | |
| ④ | 25 | 细颗粒 | 2.00 |
(2)实验①记录如下(换算成标况):
| 时间/s | 10 | 20 | 30 | 40 | 50 | 60 | 70 | 80 | 90 | 100 |
| 氢气体积/mL | 16.8 | 39.2 | 67.2 | 224 | 420 | 492.8 | 520.8 | 543.2 | 554.4 | 560 |
②反应速率最大的时间段(如0~10s)为
③反应速率后段明显下降的主要影响因素是
(3)某化学研究小组的同学为比较Fe3+和Cu2+对H2O2分解的催化效果,设计了如图所示的实验。
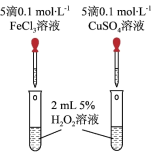
②某同学提出将FeCl3改为Fe2(SO4)3更为合理,其理由是
您最近一年使用:0次



