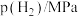2023高三·全国·专题练习
1 . 我国在汽车尾气和燃煤尾气的净化方面取得了一定成效。汽车尾气净化的主要原理为 。在密闭容器中发生该反应时,
。在密闭容器中发生该反应时, 随温度(T)、催化剂的表面积(S)和时间(t)的变化曲线如图所示。
随温度(T)、催化剂的表面积(S)和时间(t)的变化曲线如图所示。

(1) 温度下,
温度下, 内的平均反应速率
内的平均反应速率
___________ 。
(2)当固体催化剂的质量一定时,将催化剂磨成粉末,则反应速率___________ (填“增大”“减小”或“不变”,下同), 转化率
转化率___________ 。
(3)若在绝热、恒容的密闭体系中充入一定量的 和
和 气体进行该反应,下列示意图正确且能说明反应在进行到
气体进行该反应,下列示意图正确且能说明反应在进行到 时刻达到平衡状态的是
时刻达到平衡状态的是___________ (填序号)。
a. b.
b. c.
c. d.
d.
 。在密闭容器中发生该反应时,
。在密闭容器中发生该反应时, 随温度(T)、催化剂的表面积(S)和时间(t)的变化曲线如图所示。
随温度(T)、催化剂的表面积(S)和时间(t)的变化曲线如图所示。
(1)
 温度下,
温度下, 内的平均反应速率
内的平均反应速率
(2)当固体催化剂的质量一定时,将催化剂磨成粉末,则反应速率
 转化率
转化率(3)若在绝热、恒容的密闭体系中充入一定量的
 和
和 气体进行该反应,下列示意图正确且能说明反应在进行到
气体进行该反应,下列示意图正确且能说明反应在进行到 时刻达到平衡状态的是
时刻达到平衡状态的是a.
 b.
b. c.
c. d.
d.
您最近一年使用:0次
2023高三·全国·专题练习
2 . 绿色能源是未来能源发展的方向,积极发展氢能,是实现“碳达峰、碳中和”的重要举措。回答下列问题:
(1)通过生物柴油副产物甘油制取H2正成为绿色能源的一个重要研究方向。生物甘油水蒸气重整制氢的主要反应如下(K1、K2分别为反应I、Ⅱ的化学平衡常数):
I.C3H8O3(g)⇌3CO(g)+4H2(g) ΔH1=+251kJ·mol-1 K1
Ⅱ.CO(g)+H2O(g)⇌CO2(g)+H2(g) ΔH2=-41kJ·mol-1 K2
重整总反应C3H8O3(g)+3H2O(g)⇌3CO2(g)+7H2(g)的ΔH3=_________ ,平衡常数K3=_________ 。(用含K1、K2的计算式表示)
(2)大量研究表明Pt12Ni、Sn12Ni、Cu12Ni三种双金属合金团簇均可用于催化DRM反应(CH4+CO2⇌2CO+2H2),在催化剂表面涉及多个基元反应,其中甲烷逐步脱氢过程的能量变化如图甲所示(吸附在催化剂表面上的物种用*标注,TS1、TS2、TS3、TS4分别表示过渡态1、过渡态2、过渡态3、过渡态4)。
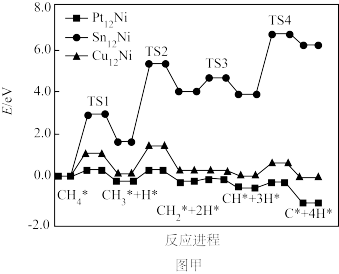
①Pt12Ni、Sn12Ni、Cu12Ni催化甲烷逐步脱氢过程的速率分别为v1、v2、v3,则脱氢过程的速率由小到大的关系为___________ 。
②甲烷逐步脱氢过程中,决定速率快慢的反应步骤是:___________ (用化学方程式表示)。
(3)甲烷干法重整制H2的过程为反应a:CH4+CO2⇌2CO+2H2,同时发生副反应b:CO2+H2⇌CO+H2O,T℃时,在恒压容器中,通入2molCH4和2molCO2发生上述反应,总压强为P0,平衡时甲烷的转化率为40%,H2O的分压为P,则反应a的压强平衡常数Kp=___________ (用含P和P0的计算式表示,已知分压=总压×物质的量分数)。
(4)甲烷裂解制氢的反应为CH4(g)=C(s)+2H2(g) ΔH=+75kJ·mol-1,Ni可作该反应的催化剂,CH4在催化剂孔道表面反应时,若孔道堵塞会导致催化剂失活。其他条件相同时,随时间增加,温度对Ni催化剂催化效果的影响如图乙所示。考虑综合因素,使用催化剂的最佳温度为___________ ;650℃条件下,1000s后,氢气的体积分数快速下降的原因是___________ 。

(1)通过生物柴油副产物甘油制取H2正成为绿色能源的一个重要研究方向。生物甘油水蒸气重整制氢的主要反应如下(K1、K2分别为反应I、Ⅱ的化学平衡常数):
I.C3H8O3(g)⇌3CO(g)+4H2(g) ΔH1=+251kJ·mol-1 K1
Ⅱ.CO(g)+H2O(g)⇌CO2(g)+H2(g) ΔH2=-41kJ·mol-1 K2
重整总反应C3H8O3(g)+3H2O(g)⇌3CO2(g)+7H2(g)的ΔH3=
(2)大量研究表明Pt12Ni、Sn12Ni、Cu12Ni三种双金属合金团簇均可用于催化DRM反应(CH4+CO2⇌2CO+2H2),在催化剂表面涉及多个基元反应,其中甲烷逐步脱氢过程的能量变化如图甲所示(吸附在催化剂表面上的物种用*标注,TS1、TS2、TS3、TS4分别表示过渡态1、过渡态2、过渡态3、过渡态4)。

①Pt12Ni、Sn12Ni、Cu12Ni催化甲烷逐步脱氢过程的速率分别为v1、v2、v3,则脱氢过程的速率由小到大的关系为
②甲烷逐步脱氢过程中,决定速率快慢的反应步骤是:
(3)甲烷干法重整制H2的过程为反应a:CH4+CO2⇌2CO+2H2,同时发生副反应b:CO2+H2⇌CO+H2O,T℃时,在恒压容器中,通入2molCH4和2molCO2发生上述反应,总压强为P0,平衡时甲烷的转化率为40%,H2O的分压为P,则反应a的压强平衡常数Kp=
(4)甲烷裂解制氢的反应为CH4(g)=C(s)+2H2(g) ΔH=+75kJ·mol-1,Ni可作该反应的催化剂,CH4在催化剂孔道表面反应时,若孔道堵塞会导致催化剂失活。其他条件相同时,随时间增加,温度对Ni催化剂催化效果的影响如图乙所示。考虑综合因素,使用催化剂的最佳温度为

您最近一年使用:0次
2023高三·全国·专题练习
3 . 甲苯(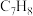 )和二甲苯(
)和二甲苯(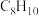 )是重要的化工原料。利用苯(
)是重要的化工原料。利用苯(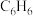 )和甲醇(
)和甲醇( )在催化剂作用下反应得到
)在催化剂作用下反应得到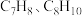 和副产物三甲苯(
和副产物三甲苯(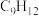 ),发生的主要反应如下:
),发生的主要反应如下:
Ⅰ.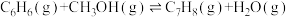
Ⅱ.
Ⅲ.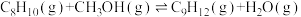
(1)500℃、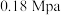 条件下,反应达到平衡时,结果如图所示。
条件下,反应达到平衡时,结果如图所示。

①由图分析,随着投料比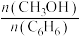 增加,
增加, 的平衡转化率
的平衡转化率___________ 。平衡时 的值
的值___________ (填“增大”、“减小”或“不变”)。
②投料比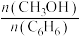 为1.0时,
为1.0时, 的平衡转化率为50%,产物中
的平衡转化率为50%,产物中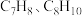 和
和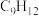 物质的量之比为6:3:1,
物质的量之比为6:3:1, 的平衡转化率为
的平衡转化率为___________ ,反应Ⅰ的平衡常数
___________ 。
(2)我国学者结合实验与计算机模拟结果,研究了反应Ⅰ在固体酸(HB)催化剂表面进行的反应历程如图所示,其中吸附在固体酸(HB)表面的物种用*标注。

①反应Ⅰ的
______ 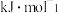 。
。
②吸附 的焓变
的焓变______ 吸附 的焓变(填“>”或“<”)。
的焓变(填“>”或“<”)。
③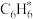 在催化剂表面转化为
在催化剂表面转化为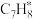 的反应方程式为
的反应方程式为______ 。
④在固体酸(HB)催化作用下,测得反应Ⅰ的速率方程为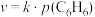 (
(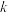 为速率常数)。在刚性容器中发生反应Ⅰ,关于反应Ⅰ的平衡常数(K)和反应速率(υ)的叙述正确的是
为速率常数)。在刚性容器中发生反应Ⅰ,关于反应Ⅰ的平衡常数(K)和反应速率(υ)的叙述正确的是______ (填标号)。
A.升高温度,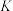 和
和 均增大 B.增大
均增大 B.增大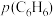 ,
,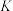 不变,
不变, 增大
增大
C.降低温度,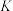 和
和 均增大 D.增大
均增大 D.增大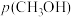 ,
,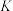 不变,
不变, 增大
增大
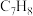 )和二甲苯(
)和二甲苯(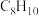 )是重要的化工原料。利用苯(
)是重要的化工原料。利用苯(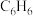 )和甲醇(
)和甲醇( )在催化剂作用下反应得到
)在催化剂作用下反应得到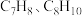 和副产物三甲苯(
和副产物三甲苯(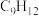 ),发生的主要反应如下:
),发生的主要反应如下:Ⅰ.
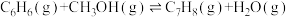
Ⅱ.

Ⅲ.
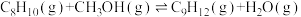
(1)500℃、
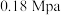 条件下,反应达到平衡时,结果如图所示。
条件下,反应达到平衡时,结果如图所示。
①由图分析,随着投料比
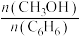 增加,
增加, 的平衡转化率
的平衡转化率 的值
的值②投料比
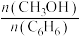 为1.0时,
为1.0时, 的平衡转化率为50%,产物中
的平衡转化率为50%,产物中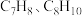 和
和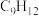 物质的量之比为6:3:1,
物质的量之比为6:3:1, 的平衡转化率为
的平衡转化率为
(2)我国学者结合实验与计算机模拟结果,研究了反应Ⅰ在固体酸(HB)催化剂表面进行的反应历程如图所示,其中吸附在固体酸(HB)表面的物种用*标注。

①反应Ⅰ的

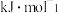 。
。②吸附
 的焓变
的焓变 的焓变(填“>”或“<”)。
的焓变(填“>”或“<”)。③
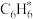 在催化剂表面转化为
在催化剂表面转化为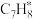 的反应方程式为
的反应方程式为④在固体酸(HB)催化作用下,测得反应Ⅰ的速率方程为
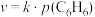 (
(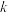 为速率常数)。在刚性容器中发生反应Ⅰ,关于反应Ⅰ的平衡常数(K)和反应速率(υ)的叙述正确的是
为速率常数)。在刚性容器中发生反应Ⅰ,关于反应Ⅰ的平衡常数(K)和反应速率(υ)的叙述正确的是A.升高温度,
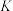 和
和 均增大 B.增大
均增大 B.增大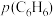 ,
,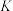 不变,
不变, 增大
增大C.降低温度,
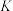 和
和 均增大 D.增大
均增大 D.增大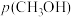 ,
,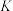 不变,
不变, 增大
增大
您最近一年使用:0次
23-24高三上·湖北武汉·阶段练习
4 . 氨的用途十分广泛,是制造硝酸和氮肥的重要原料。
(1)工业合成氨中,合成塔中每产生2 molNH3,放出92.2kJ热量。

1 mol N-H键断裂吸收的能量约等于___________ kJ
(2)一定条件下,在恒温恒容的密闭容器中充入等物质的量N2和H2发生反应生成NH3,下列状态能说明反应达到平衡的是___________(填标号)。
(3)已知合成氨反应的速率方程为:ν=kcα(N2)cβ(H2)c-1(NH3),在合成氨过程中,需要不断分离出氨,可能的原因为___________ 。
(4)以氨为原料生产尿素的方程式为2NH3(g)+CO2(g) CO(NH2)2(l)+H2O(g)。
CO(NH2)2(l)+H2O(g)。
①为进一步提高NH3的平衡转化率,下列措施能达到目的的是___________ (填标号)。
A.增大CO2的浓度 B.增大压强 C.及时转移生成的尿素 D.使用更高效的催化剂
②尿素的合成分两步进行:
a.2NH3(g)+CO2(g) NH2COONH4(1) ΔH= ‒117 kJ/mol
NH2COONH4(1) ΔH= ‒117 kJ/mol
b.NH2COONH4(1) CO(NH2)2(1)+H2O(g) ΔH= +15 kJ/mol,第一步反应速率快,可判断活化能较大的是
CO(NH2)2(1)+H2O(g) ΔH= +15 kJ/mol,第一步反应速率快,可判断活化能较大的是___________ (填“第一步”或“第二步”)。
③某实验小组为了模拟工业上合成尿素,在恒温恒容的真空密闭容器中充入一定量的CO2和NH3发生反应:2NH3(g)+CO2(g) CO(NH2)2(l)+H2O(g),反应过程中混合气体中NH3的体积分数如下图所示。
CO(NH2)2(l)+H2O(g),反应过程中混合气体中NH3的体积分数如下图所示。
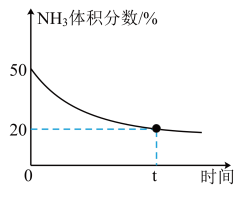
实验测得体系平衡时的压强为10MPa,计算该反应的平衡常数Kp=___________ MPa-2(已知:分压=总压×体积分数)。
(1)工业合成氨中,合成塔中每产生2 molNH3,放出92.2kJ热量。

1 mol N-H键断裂吸收的能量约等于
(2)一定条件下,在恒温恒容的密闭容器中充入等物质的量N2和H2发生反应生成NH3,下列状态能说明反应达到平衡的是___________(填标号)。
| A.容器内压强不变 | B.N2的体积分数不变 |
| C.气体的密度不再改变 | D.V正(N2)=3V逆(H2) |
(4)以氨为原料生产尿素的方程式为2NH3(g)+CO2(g)
 CO(NH2)2(l)+H2O(g)。
CO(NH2)2(l)+H2O(g)。①为进一步提高NH3的平衡转化率,下列措施能达到目的的是
A.增大CO2的浓度 B.增大压强 C.及时转移生成的尿素 D.使用更高效的催化剂
②尿素的合成分两步进行:
a.2NH3(g)+CO2(g)
 NH2COONH4(1) ΔH= ‒117 kJ/mol
NH2COONH4(1) ΔH= ‒117 kJ/molb.NH2COONH4(1)
 CO(NH2)2(1)+H2O(g) ΔH= +15 kJ/mol,第一步反应速率快,可判断活化能较大的是
CO(NH2)2(1)+H2O(g) ΔH= +15 kJ/mol,第一步反应速率快,可判断活化能较大的是③某实验小组为了模拟工业上合成尿素,在恒温恒容的真空密闭容器中充入一定量的CO2和NH3发生反应:2NH3(g)+CO2(g)
 CO(NH2)2(l)+H2O(g),反应过程中混合气体中NH3的体积分数如下图所示。
CO(NH2)2(l)+H2O(g),反应过程中混合气体中NH3的体积分数如下图所示。
实验测得体系平衡时的压强为10MPa,计算该反应的平衡常数Kp=
您最近一年使用:0次
23-24高二上·河南·阶段练习
解题方法
5 . 化石燃料的综合利用既能减少污染,又能提高资源利用率。回答下列问题:
(1)煤气化过程如下:
反应1:
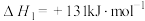
反应2:

反应3: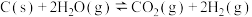
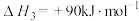
①
___________ 。
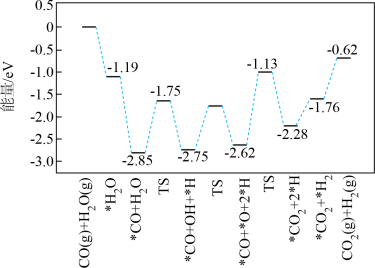
②反应2在催化剂作用下的反应历程如图(TS表示过渡态,*表示吸附态),历程中决速步的方程式为___________ ;使用催化剂,___________ (填“能”或“不能”)改变a的值。
(2)在一定温度下,向某恒容容器中充入2molCO2(g)和2molH2(g),仅发生反应:
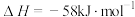 。
。
①下列情况表明反应已达到平衡状态的是___________ (填标号)。
A.CO2的体积分数保持不变 B.混合气体的平均摩尔质量保持不变
C.CO2的转化率保持不变 D.CH3OH与H2O的物质的量之比不再改变
②该反应能在___________ (填“高温”、“低温”或“任何温度”)下自发。
(3)向2L的恒容密闭容器中充入1molCH3OH(g),发生反应: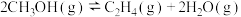
 。其他条件不变时,CH3OH的平衡转化率随着温度(T)的变化如图所示。
。其他条件不变时,CH3OH的平衡转化率随着温度(T)的变化如图所示。

①欲提高CH3OH的平衡转化率且加快反应速率,下列措施可能有效的是___________ (填标号)。
a.降低温度并及时分离出产物
b.加入合适的催化剂并分离出产物
c.再向容器中充入1molCH3OH(g)
d.适当降低温度并加入合适的催化剂
② 时,反应经过20min达到平衡,用C2H4表示该段时间内的平均速率为
时,反应经过20min达到平衡,用C2H4表示该段时间内的平均速率为___________ mol·L-1·min-1,该温度下的平衡常数
___________ (用分数表示);该温度下,改变投料,某时刻容器内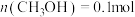 、
、 、
、 ,则此时
,则此时
___________  (填“>”、“<”或“=”)。
(填“>”、“<”或“=”)。
(1)煤气化过程如下:
反应1:

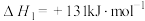
反应2:


反应3:
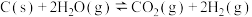
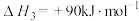
①

②反应2在催化剂作用下的反应历程如图(TS表示过渡态,*表示吸附态),历程中决速步的方程式为

(2)在一定温度下,向某恒容容器中充入2molCO2(g)和2molH2(g),仅发生反应:

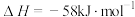 。
。①下列情况表明反应已达到平衡状态的是
A.CO2的体积分数保持不变 B.混合气体的平均摩尔质量保持不变
C.CO2的转化率保持不变 D.CH3OH与H2O的物质的量之比不再改变
②该反应能在
(3)向2L的恒容密闭容器中充入1molCH3OH(g),发生反应:
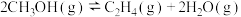
 。其他条件不变时,CH3OH的平衡转化率随着温度(T)的变化如图所示。
。其他条件不变时,CH3OH的平衡转化率随着温度(T)的变化如图所示。
①欲提高CH3OH的平衡转化率且加快反应速率,下列措施可能有效的是
a.降低温度并及时分离出产物
b.加入合适的催化剂并分离出产物
c.再向容器中充入1molCH3OH(g)
d.适当降低温度并加入合适的催化剂
②
 时,反应经过20min达到平衡,用C2H4表示该段时间内的平均速率为
时,反应经过20min达到平衡,用C2H4表示该段时间内的平均速率为
 、
、 、
、 ,则此时
,则此时
 (填“>”、“<”或“=”)。
(填“>”、“<”或“=”)。
您最近一年使用:0次
2023-10-08更新
|
309次组卷
|
4卷引用:原理综合题
23-24高二上·全国·课时练习
解题方法
6 . 完成下列问题
(1)请认真观察下图,回答问题。
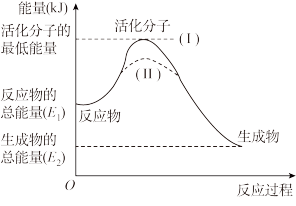
①该反应的ΔH=___________ (用含E1、E2的代数式表示)。若向该反应中加入合适的催化剂,活化能___________ (填“升高”“降低”或“不变”),ΔH___________ (填“升高”“降低”或“不变”)。
②若该图表示2H2O2(l) 2H2O(l)+O2(g) ΔH=-73.5 kJ·mol-1,该反应的活化能为54.3 kJ·mol-1,则其逆反应的活化能为
2H2O(l)+O2(g) ΔH=-73.5 kJ·mol-1,该反应的活化能为54.3 kJ·mol-1,则其逆反应的活化能为___________ kJ·mol-1。
(2)用H2O2、KI和洗洁精可完成“大象牙膏”实验(短时间内产生大量泡沫),某同学依据文献资料对该实验进行探究。
资料1:KI在该反应中的作用:H2O2+I-=H2O+IO-;H2O2+IO-=H2O+O2↑+I-。总反应的化学方程式为___________ 。
资料2:I2也可催化H2O2的分解反应。
实验中发现,H2O2与KI溶液混合后,产生大量气泡,溶液颜色变黄。再加入CCl4,振荡、静置,气泡明显减少。
①加CCl4并振荡、静置后还可观察到___________ ,说明有I2生成。
②气泡明显减少的原因可能是:i.H2O2浓度降低;ii.___________ 。以下对照实验说明i不是主要原因:向H2O2溶液中加入KI溶液,待溶液变黄后,分成两等份于A、B两试管中。A试管中加入CCl4,B试管中不加CCl4,分别振荡、静置。观察到的现象是___________ 。
(1)请认真观察下图,回答问题。

①该反应的ΔH=
②若该图表示2H2O2(l)
 2H2O(l)+O2(g) ΔH=-73.5 kJ·mol-1,该反应的活化能为54.3 kJ·mol-1,则其逆反应的活化能为
2H2O(l)+O2(g) ΔH=-73.5 kJ·mol-1,该反应的活化能为54.3 kJ·mol-1,则其逆反应的活化能为(2)用H2O2、KI和洗洁精可完成“大象牙膏”实验(短时间内产生大量泡沫),某同学依据文献资料对该实验进行探究。
资料1:KI在该反应中的作用:H2O2+I-=H2O+IO-;H2O2+IO-=H2O+O2↑+I-。总反应的化学方程式为
资料2:I2也可催化H2O2的分解反应。
实验中发现,H2O2与KI溶液混合后,产生大量气泡,溶液颜色变黄。再加入CCl4,振荡、静置,气泡明显减少。
①加CCl4并振荡、静置后还可观察到
②气泡明显减少的原因可能是:i.H2O2浓度降低;ii.
您最近一年使用:0次
22-23高二上·陕西宝鸡·期末
解题方法
7 .  是造成大气污染的主要物质,工业上脱硝有多种方法。利用碳还原NO的反应为
是造成大气污染的主要物质,工业上脱硝有多种方法。利用碳还原NO的反应为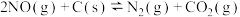 。回答下列问题:
。回答下列问题:
(1)该反应在常温下可以自发进行,则反应的
_____ (填“>”“<”或“=”)0。
(2)在一定温度下,向甲、乙、丙三个恒容密闭容器中加入一定量的NO和足量的焦炭,反应过程中测得各容器中 (mol·L
(mol·L )随时间(s)的变化如下表所示。(已知:三个容器的反应温度分别为
)随时间(s)的变化如下表所示。(已知:三个容器的反应温度分别为 ℃、
℃、 ℃、
℃、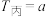 ℃)
℃)
甲容器中,该反应的平衡常数
______ ,丙容器的反应温度a______ (填“>”“<”或“=”)400。
(3)已知:
 。相同条件下,在2L密闭容器内,选用不同的催化剂进行反应,产生
。相同条件下,在2L密闭容器内,选用不同的催化剂进行反应,产生 的量随时间的变化关系如图所示。
的量随时间的变化关系如图所示。
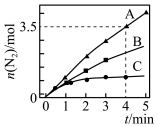
①在催化剂A的作用下0~4min的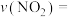
______ 。
②该反应活化能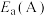 、
、 、
、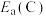 由小到大的顺序是
由小到大的顺序是____________ ,理由是____________ 。
③下列说法不正确的是______ (填字母)。
a.使用催化剂A达平衡时, 值更大
值更大
b.升高温度可使容器内气体颜色加深
c.单位时间内形成N-H键与O-H键的数目相等时,说明反应已经达到平衡
d.若在恒容绝热的密闭容器中反应,当平衡常数不变时,说明反应已经达到平衡
 是造成大气污染的主要物质,工业上脱硝有多种方法。利用碳还原NO的反应为
是造成大气污染的主要物质,工业上脱硝有多种方法。利用碳还原NO的反应为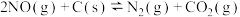 。回答下列问题:
。回答下列问题:(1)该反应在常温下可以自发进行,则反应的

(2)在一定温度下,向甲、乙、丙三个恒容密闭容器中加入一定量的NO和足量的焦炭,反应过程中测得各容器中
 (mol·L
(mol·L )随时间(s)的变化如下表所示。(已知:三个容器的反应温度分别为
)随时间(s)的变化如下表所示。(已知:三个容器的反应温度分别为 ℃、
℃、 ℃、
℃、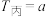 ℃)
℃)| 时间 | 0s | 10s | 20s | 30s | 40s |
| 甲 | 2.00 | 1.50 | 1.10 | 0.80 | 0.80 |
| 乙 | 1.00 | 0.80 | 0.65 | 0.53 | 0.45 |
| 丙 | 2.00 | 1.45 | 1.00 | 1.00 | 1.00 |

(3)已知:

 。相同条件下,在2L密闭容器内,选用不同的催化剂进行反应,产生
。相同条件下,在2L密闭容器内,选用不同的催化剂进行反应,产生 的量随时间的变化关系如图所示。
的量随时间的变化关系如图所示。
①在催化剂A的作用下0~4min的
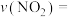
②该反应活化能
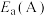 、
、 、
、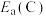 由小到大的顺序是
由小到大的顺序是③下列说法不正确的是
a.使用催化剂A达平衡时,
 值更大
值更大b.升高温度可使容器内气体颜色加深
c.单位时间内形成N-H键与O-H键的数目相等时,说明反应已经达到平衡
d.若在恒容绝热的密闭容器中反应,当平衡常数不变时,说明反应已经达到平衡
您最近一年使用:0次
2023-07-26更新
|
89次组卷
|
3卷引用:原理综合题
2023·浙江·高考真题
8 . 水煤气变换反应是工业上的重要反应,可用于制氢。
水煤气变换反应: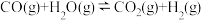
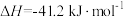
该反应分两步完成:
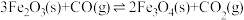
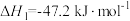
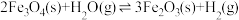
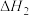
请回答:
(1)
_______  。
。
(2)恒定总压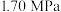 和水碳比[
和水碳比[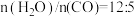 ]投料,在不同条件下达到平衡时
]投料,在不同条件下达到平衡时 和
和 的分压(某成分分压=总压×该成分的物质的量分数)如下表:
的分压(某成分分压=总压×该成分的物质的量分数)如下表:
①在条件1下,水煤气变换反应的平衡常数
___________ 。
②对比条件1,条件2中 产率下降是因为发生了一个不涉及
产率下降是因为发生了一个不涉及 的副反应,写出该反应方程式
的副反应,写出该反应方程式____ 。
(3)下列说法正确的是______。
(4)水煤气变换反应是放热的可逆反应,需在多个催化剂反应层间进行降温操作以“去除”反应过程中的余热(如图1所示),保证反应在最适宜温度附近进行。______ 。
A.按原水碳比通入冷的原料气 B.喷入冷水(蒸气) C.通过热交换器换热
②若采用喷入冷水(蒸气)的方式降温,在图3中作出 平衡转化率随温度变化的曲线
平衡转化率随温度变化的曲线____ 。
(5)在催化剂活性温度范围内,水煤气变换反应的历程包含反应物分子在催化剂表面的吸附(快速)、反应及产物分子脱附等过程。随着温度升高,该反应的反应速率先增大后减小,其速率减小的原因是________ 。
水煤气变换反应:
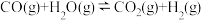
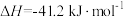
该反应分两步完成:
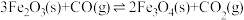
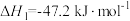
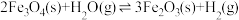
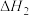
请回答:
(1)

 。
。(2)恒定总压
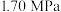 和水碳比[
和水碳比[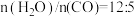 ]投料,在不同条件下达到平衡时
]投料,在不同条件下达到平衡时 和
和 的分压(某成分分压=总压×该成分的物质的量分数)如下表:
的分压(某成分分压=总压×该成分的物质的量分数)如下表:
|
|
| |
条件1 | 0.40 | 0.40 | 0 |
条件2 | 0.42 | 0.36 | 0.02 |

②对比条件1,条件2中
 产率下降是因为发生了一个不涉及
产率下降是因为发生了一个不涉及 的副反应,写出该反应方程式
的副反应,写出该反应方程式(3)下列说法正确的是______。
A.通入反应器的原料气中应避免混入 |
B.恒定水碳比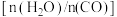 ,增加体系总压可提高 ,增加体系总压可提高 的平衡产率 的平衡产率 |
C.通入过量的水蒸气可防止 被进一步还原为 被进一步还原为 |
| D.通过充入惰性气体增加体系总压,可提高反应速率 |
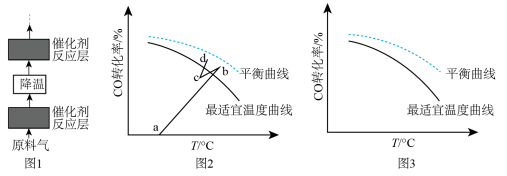
A.按原水碳比通入冷的原料气 B.喷入冷水(蒸气) C.通过热交换器换热
②若采用喷入冷水(蒸气)的方式降温,在图3中作出
 平衡转化率随温度变化的曲线
平衡转化率随温度变化的曲线(5)在催化剂活性温度范围内,水煤气变换反应的历程包含反应物分子在催化剂表面的吸附(快速)、反应及产物分子脱附等过程。随着温度升高,该反应的反应速率先增大后减小,其速率减小的原因是
您最近一年使用:0次
2023-06-21更新
|
8112次组卷
|
7卷引用:2023年高考浙江卷化学真题(6月)变式题(原理综合题)
(已下线)2023年高考浙江卷化学真题(6月)变式题(原理综合题)(已下线)专题17 原理综合题(已下线)专题17 原理综合题(已下线)专题14 化学反应原理综合题-2023年高考化学真题题源解密(新高考专用)2023年高考浙江卷化学真题(6月)浙江省金华市东阳市外国语学校2023-2024学年高二上学期10月月考化学试题2024届黑龙江省齐齐哈尔市高三下学期联合考试模拟预测化学试题
2023·江苏盐城·二模
9 . 研发二氧化碳利用技术、降低空气中二氧化碳含量成为研究热点。
(1)减少碳排放的方法有很多,CO2转化成有机化合物可有效实现碳循环,如下反应:
a.
b.
c.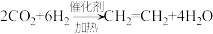
上述反应中原子利用率最高的是_____ (填编号)。
(2) 在固体催化表面加氢合成甲烷过程中发生以下两个反应:
在固体催化表面加氢合成甲烷过程中发生以下两个反应:
主反应: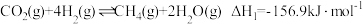
副反应:
已知: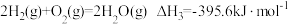 ,
,
则 燃烧的热化学方程式
燃烧的热化学方程式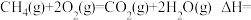
_____ 。
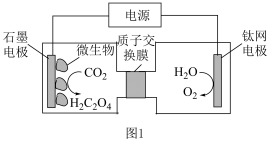
(3)利用电化学方法通过微生物电催化将 有效地转化为
有效地转化为 ,装置如图1所示。阴极区电极反应式为
,装置如图1所示。阴极区电极反应式为_____ ;当体系的温度升高到一定程度,电极反应的速率反而迅速下降,其主要原因是_____ 。
(4)研究脱除烟气中的 是环境保护、促进社会可持续发展的重要课题。有氧条件下,在
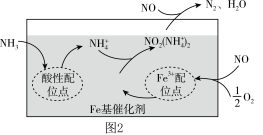
是环境保护、促进社会可持续发展的重要课题。有氧条件下,在 基催化剂表面,
基催化剂表面, 还原
还原 的反应机理如图2所示,该过程可描述为
的反应机理如图2所示,该过程可描述为_____ 。
(5)近年来,低温等离子技术是在高压放电下,O2产生 自由基,
自由基, 自由基将NO氧化为NO2后,再用Na2CO3溶液吸收,达到消除NO的目的。实验室将模拟气(N2、O2、NO)以一定流速通入低温等离子体装置,实验装置如图3所示。
自由基将NO氧化为NO2后,再用Na2CO3溶液吸收,达到消除NO的目的。实验室将模拟气(N2、O2、NO)以一定流速通入低温等离子体装置,实验装置如图3所示。
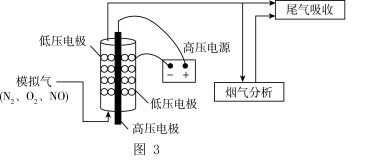
①等离子体技术在低温条件下可提高 的转化率,原因是
的转化率,原因是_____ 。
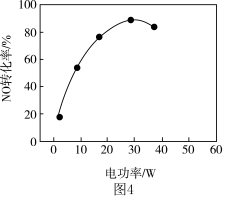
②其他条件相同,等离子体的电功率与 的转化率关系如图4所示,当电功率大于
的转化率关系如图4所示,当电功率大于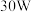 时,
时, 转化率下降的原因可能是
转化率下降的原因可能是_____ 。
(1)减少碳排放的方法有很多,CO2转化成有机化合物可有效实现碳循环,如下反应:
a.

b.

c.
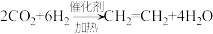
上述反应中原子利用率最高的是
(2)
 在固体催化表面加氢合成甲烷过程中发生以下两个反应:
在固体催化表面加氢合成甲烷过程中发生以下两个反应:主反应:
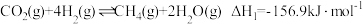
副反应:

已知:
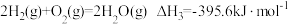 ,
,则
 燃烧的热化学方程式
燃烧的热化学方程式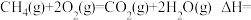
(3)利用电化学方法通过微生物电催化将
 有效地转化为
有效地转化为 ,装置如图1所示。阴极区电极反应式为
,装置如图1所示。阴极区电极反应式为

(4)研究脱除烟气中的
 是环境保护、促进社会可持续发展的重要课题。有氧条件下,在
是环境保护、促进社会可持续发展的重要课题。有氧条件下,在 基催化剂表面,
基催化剂表面, 还原
还原 的反应机理如图2所示,该过程可描述为
的反应机理如图2所示,该过程可描述为(5)近年来,低温等离子技术是在高压放电下,O2产生
 自由基,
自由基, 自由基将NO氧化为NO2后,再用Na2CO3溶液吸收,达到消除NO的目的。实验室将模拟气(N2、O2、NO)以一定流速通入低温等离子体装置,实验装置如图3所示。
自由基将NO氧化为NO2后,再用Na2CO3溶液吸收,达到消除NO的目的。实验室将模拟气(N2、O2、NO)以一定流速通入低温等离子体装置,实验装置如图3所示。

①等离子体技术在低温条件下可提高
 的转化率,原因是
的转化率,原因是②其他条件相同,等离子体的电功率与
 的转化率关系如图4所示,当电功率大于
的转化率关系如图4所示,当电功率大于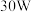 时,
时, 转化率下降的原因可能是
转化率下降的原因可能是
您最近一年使用:0次
2023-06-14更新
|
839次组卷
|
4卷引用:原理综合题
2023高三·全国·专题练习
10 . 丙烯腈(CH2=CHCN)是一种重要的化工原料,工业上可用“丙烯氨氧化法”生产,主要副产物有丙烯醛(CH2=CHCHO)和乙腈(CH3CN)等,回答下列问题:
(1)以丙烯、氨、氧气为原料,在催化剂存在下生成丙烯腈(C3H3N)和副产物丙烯醛(C3H4O)的热化学方程式如下:
①C3H6(g)+NH3(g)+ O2(g)=C3H3N(g)+3H2O(g) ΔH=-515kJ/mol
O2(g)=C3H3N(g)+3H2O(g) ΔH=-515kJ/mol
②C3H6(g)+O2(g)=C3H4O(g)+H2O(g) ΔH=-353kJ/mol
有利于提高丙烯腈平衡产率的反应条件是___________ ;提高丙烯腈反应选择性的关键因素是___________ 。
(2)图(a)为丙烯腈产率与反应温度的关系曲线,最高产率对应的温度为460℃,高于460℃时,丙烯腈产率降低的可能原因是___________(双选,填标号)

(3)丙烯腈和丙烯醛的产率与n(氨)/n(丙烯)的关系如图(b)所示。由图可知,最佳n(氨)/n(丙烯)约为___________ ,理由是___________ 。

(1)以丙烯、氨、氧气为原料,在催化剂存在下生成丙烯腈(C3H3N)和副产物丙烯醛(C3H4O)的热化学方程式如下:
①C3H6(g)+NH3(g)+
 O2(g)=C3H3N(g)+3H2O(g) ΔH=-515kJ/mol
O2(g)=C3H3N(g)+3H2O(g) ΔH=-515kJ/mol②C3H6(g)+O2(g)=C3H4O(g)+H2O(g) ΔH=-353kJ/mol
有利于提高丙烯腈平衡产率的反应条件是
(2)图(a)为丙烯腈产率与反应温度的关系曲线,最高产率对应的温度为460℃,高于460℃时,丙烯腈产率降低的可能原因是___________(双选,填标号)

| A.催化剂活性降低 | B.平衡常数变大 | C.副反应增多 | D.反应活化能增大 |

您最近一年使用:0次