名校
解题方法
1 . 如图,这种具有不同能量的分子百分数和能量的对应关系图,叫做一定温度下分子能量分布曲线图。图中E表示分子平均能量,Ec是活化分子具有的最低能量。下列说法不正确的是
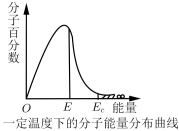

| A.图中Ec与E之差表示活化能 |
| B.升高温度,图中阴影部分面积会增大 |
| C.使用合适的催化剂,E不变,Ec变小 |
| D.能量大于Ec的分子间发生的碰撞一定是有效碰撞 |
您最近一年使用:0次
2020-03-05更新
|
258次组卷
|
3卷引用:湖北省荆州市2020届高三上学期质量检测(一) 化学试题
2 . 下图表示某可逆反应在使用和未使用催化剂时,反应过程和能量的对应关系。下列说法一定正确的是
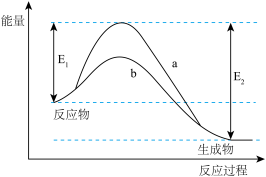

| A.该反应为吸热反应 |
| B.a与b相比,a的反应速率更快 |
| C.a与b相比,反应的平衡常数一定不同 |
| D.反应物吸收的总能量小于生成物释放的总能量 |
您最近一年使用:0次
2019-04-14更新
|
353次组卷
|
3卷引用:【区级联考】上海市黄浦区2019届高三下学期等级考二模试卷化学试题
【区级联考】上海市黄浦区2019届高三下学期等级考二模试卷化学试题(已下线)2011-2012学年河南省许昌部分学校高二上学期期末联考化学试卷2019-2020学年新人教版必修2同步练习题:6.1化学反应与能量变化
名校
3 . 右图表示某可逆反应:N2(g)+3H2(g) 2NH3(g) △H在使用和未使用催化剂时,反应过程和能量的对应关系。下列说法正确的是
2NH3(g) △H在使用和未使用催化剂时,反应过程和能量的对应关系。下列说法正确的是
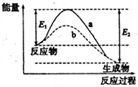
 2NH3(g) △H在使用和未使用催化剂时,反应过程和能量的对应关系。下列说法正确的是
2NH3(g) △H在使用和未使用催化剂时,反应过程和能量的对应关系。下列说法正确的是
| A.反应物的总键能小于生成物的总键能 |
| B.如果对上述反应加压,平衡正向移动,△H减小 |
| C.a与b相比,反应的平衡常数一定不同 |
| D.a与b相比,a的反应速率更快 |
您最近一年使用:0次
2017-12-04更新
|
226次组卷
|
2卷引用:山东省青岛市城阳区2018届高三上学期期中学分认定考试化学试题
4 . 下列实验“操作和现象”与“结论”对应关系正确的是
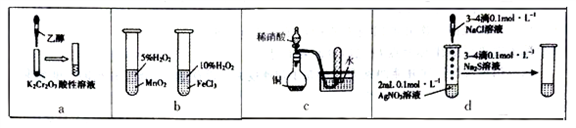

| A.a图,滴加乙醇,试管中橙色溶液变为绿色,乙醇发生取代反应生成乙酸 |
| B.b图,左边试管中产生气泡迅速,说明二氧化锰的催化效果比氯化铁好 |
| C.c图,根据试管中收集到无色气体,能验证铜与稀硝酸的反应产物是NO |
| D.d图,试管中先有白色沉淀,后有黑色沉淀生成,能确定Ksp(AgCl)>Ksp(Ag2S) |
您最近一年使用:0次
10-11高二下·广东广州·期中
5 . 如图表示某可逆反应在使用和未使用催化剂时,反应进程和能量的对应关系。下列说法一定正确的是 ( )
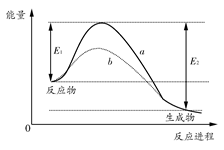

| A.a与b相比,b的活化能更高 |
| B.反应物断键吸收的总能量小于生成物成键释放的总能量 |
| C.a与b相比,反应的平衡常数一定不同 |
| D.a与b相比,a对应的反应速率更快 |
您最近一年使用:0次
2016-12-09更新
|
1405次组卷
|
4卷引用:2014年高考化学苏教版总复习 7-2 化学反应的方向和限度练习卷
(已下线)2014年高考化学苏教版总复习 7-2 化学反应的方向和限度练习卷(已下线)2010-2011学年广东省白云中学高二下学期期中考试化学试卷2015-2016学年河北省望都中学高二上学期第二次月考化学试卷吉林省松原市乾安县第七中学2020-2021学年高二上学期第一次教学质量检测化学试题
6 . 右图衰示可逆反应在使用和未使用催化剂时,反应过程和能量的对应关系。下列说法正确的是


| A.反应物的总能量大于生成物的总能量 | B.反应产生的热效应Q=E1-E2 |
| C.a与b相比,反应的平衡常数一定不同 | D.a与b相比,a的反应速率更快 |
您最近一年使用:0次
名校
7 . 合成气的主要成分为一氧化碳和氢气,在工业上用途十分广泛。最近中国科学家成功研究由合成气制备乙醇的新工艺,具体制备路线如下所示:
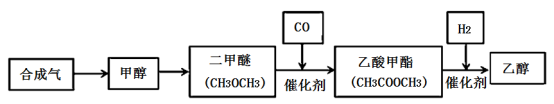
(1)制备甲醇的原理为CO(g)+2H2(g) CH3OH(g),反应过程中物质能量变能化如图所示,生产中为同时提高甲醇的产率和反应速率,可采取措施是
CH3OH(g),反应过程中物质能量变能化如图所示,生产中为同时提高甲醇的产率和反应速率,可采取措施是___________ (写一条即可)。
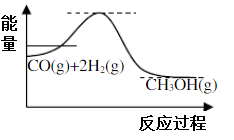
(2)若该反应加入催化剂,请在答题纸图中画出反应过程中物质能量变化曲线___________ 。
(3)制备二甲醚的原理为2CH3OH(g)= CH3OCH3(g)+H2O(g)。写出该反应的化学平衡常数表达式为___________ 。在2 L容器中发生上述反应,5分钟后,测得甲醇减少16 g,则二甲醛的平均生成速率为___________ 。
(4)CH3COOCH3和H2制备乙醇的反应中,还有另一产物生成,该物质在上述转化路线中循环使用,其分子式为___________ 。 若不考虑生产过程中的损失且每步都反应完全,通过以上制备路线消耗8.4 kgCO时,理论上可制取乙醇的质量为___________ 。
(5)设计实验证明乙醇中是否含有CH3COOCH3____________________ (写出实验的操作步骤、现象和结论)

(1)制备甲醇的原理为CO(g)+2H2(g)
 CH3OH(g),反应过程中物质能量变能化如图所示,生产中为同时提高甲醇的产率和反应速率,可采取措施是
CH3OH(g),反应过程中物质能量变能化如图所示,生产中为同时提高甲醇的产率和反应速率,可采取措施是
(2)若该反应加入催化剂,请在答题纸图中画出反应过程中物质能量变化曲线
(3)制备二甲醚的原理为2CH3OH(g)= CH3OCH3(g)+H2O(g)。写出该反应的化学平衡常数表达式为
(4)CH3COOCH3和H2制备乙醇的反应中,还有另一产物生成,该物质在上述转化路线中循环使用,其分子式为
(5)设计实验证明乙醇中是否含有CH3COOCH3
您最近一年使用:0次
名校
解题方法
8 . 二氧化碳作为工业原料的用途十分广泛。某氢气催化还原CO2的转化路径如下,下列说法错误的是
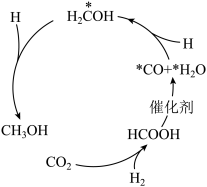

A.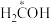 为中间产物 为中间产物 |
| B.HCOOH→*CO+*H2O释放能量 |
C.存在反应CO2+3H2 CH3OH+H2O CH3OH+H2O |
| D.*CO及时从催化剂脱附有利于加快反应速率 |
您最近一年使用:0次
2020-11-24更新
|
300次组卷
|
3卷引用:广东省清远市2021届高三上学期摸底考试(11月) 化学试题
广东省清远市2021届高三上学期摸底考试(11月) 化学试题江西省南昌市南昌县莲塘第一中学2021届高三上学期12月质量检测化学试题(已下线)专题09 反应机理—2022年高考化学二轮复习讲练测(全国版)-测试
名校
解题方法
9 . 碳氢化合物有多种,它们在工业生产、生活中有重要用途。
(1)石油危机日渐严重,甲烷的转化和利用在天然气化工行业有非常重要的作用。甲烷重整技术主要是利用甲烷和其他原料来制备合成气(CO和H2混合气体)。现在常见的重整技术有甲烷-水蒸气重整,其反应为:CH4(g) + H2O(g)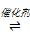 CO(g) + 3H2(g) ΔH>0
CO(g) + 3H2(g) ΔH>0
如图为反应压强为0.3 MPa,投料比n(H2O)/n(CH4)为1,在三种不同催化剂催化作用下,甲烷-水蒸气重整反应中CH4转化率随温度变化的关系。
下列说法正确的是________ 。
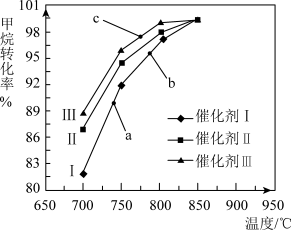
A.在相同条件下,三种催化剂Ⅰ、Ⅱ、Ⅲ的催化效率由高到低的顺序是Ⅰ>Ⅱ>Ⅲ
B.b点CH4的转化率高于a点,原因是b、a两点均未达到平衡状态,b点温度高,反应速率较快,故CH4的转化率较大
C.C点一定未达到平衡状态
D.催化剂只改变反应速率不改变平衡移动,所以在850℃时,不同催化剂(Ⅰ、Ⅱ、Ⅲ)作用下达平衡时CH4的转化率相同
(2) 乙炔(C2H2)在气焊、气割及有机合成中用途非常广泛,甲烷在1500℃左右气相裂解法生产,裂解反应:2CH4(g)=C2H2(g)+3H2(g)的△H= +376.4kJ/mol。
哈斯特研究得出当甲烷分解时,几种气体平衡时分压(Pa)与温度(℃)的关系如图所示。
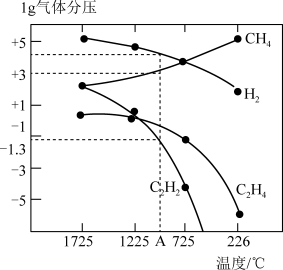
①T1℃时,向1L恒容密闭容器中充入0.3 mol CH4只发生反应2CH4(g) C2H4(g)+2H2(g),达到平衡时,测得c(C2H4)=c(CH4)。该反应的△H
C2H4(g)+2H2(g),达到平衡时,测得c(C2H4)=c(CH4)。该反应的△H____ 0(填“>”或“<”),CH4的平衡转化率为____ %(保留3位有效数字)。上述平衡状态某一时刻,若改变温度至T2℃,CH4以0.01mol/(L·s)的平均速率增多,经ts后再次达到平衡,平衡时,c(CH4)=2c(C2H4),则T1_____ (填“>”或“<”)T2,t=______ s。
②由图可知,甲烷裂解制乙炔有副产物乙烯生成,为提高甲烷制乙炔的转化率,除改变温度外,还可采取的措施有___________ 。
(1)石油危机日渐严重,甲烷的转化和利用在天然气化工行业有非常重要的作用。甲烷重整技术主要是利用甲烷和其他原料来制备合成气(CO和H2混合气体)。现在常见的重整技术有甲烷-水蒸气重整,其反应为:CH4(g) + H2O(g)
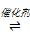 CO(g) + 3H2(g) ΔH>0
CO(g) + 3H2(g) ΔH>0如图为反应压强为0.3 MPa,投料比n(H2O)/n(CH4)为1,在三种不同催化剂催化作用下,甲烷-水蒸气重整反应中CH4转化率随温度变化的关系。
下列说法正确的是

A.在相同条件下,三种催化剂Ⅰ、Ⅱ、Ⅲ的催化效率由高到低的顺序是Ⅰ>Ⅱ>Ⅲ
B.b点CH4的转化率高于a点,原因是b、a两点均未达到平衡状态,b点温度高,反应速率较快,故CH4的转化率较大
C.C点一定未达到平衡状态
D.催化剂只改变反应速率不改变平衡移动,所以在850℃时,不同催化剂(Ⅰ、Ⅱ、Ⅲ)作用下达平衡时CH4的转化率相同
(2) 乙炔(C2H2)在气焊、气割及有机合成中用途非常广泛,甲烷在1500℃左右气相裂解法生产,裂解反应:2CH4(g)=C2H2(g)+3H2(g)的△H= +376.4kJ/mol。
哈斯特研究得出当甲烷分解时,几种气体平衡时分压(Pa)与温度(℃)的关系如图所示。

①T1℃时,向1L恒容密闭容器中充入0.3 mol CH4只发生反应2CH4(g)
 C2H4(g)+2H2(g),达到平衡时,测得c(C2H4)=c(CH4)。该反应的△H
C2H4(g)+2H2(g),达到平衡时,测得c(C2H4)=c(CH4)。该反应的△H②由图可知,甲烷裂解制乙炔有副产物乙烯生成,为提高甲烷制乙炔的转化率,除改变温度外,还可采取的措施有
您最近一年使用:0次
2019-12-02更新
|
133次组卷
|
2卷引用:山西大学附属中学2019-2020学年高二10月月考化学试题
名校
解题方法
10 . 氧气是一种常见的氧化剂,用途广泛。回答下列问题:
(1)用H2O2制取O2时,分解的热化学方程式为: 2H2O2(aq)=2H2O(l) +O2(g) ΔH= a kJ·mol-1
①相同条件下,H2O2分解时,无论是否使用催化剂,均不会改变的是_______ (填标号)。
A 反应速率 B 反应热 C 活化能 D 生成物
②以Fe3+作催化剂时,H2O2的分解反应分两步进行,第一步反应为: H2O2(aq) + 2Fe3+ (aq)=2Fe2+ (aq) +O2(g) +2H+ (aq)ΔH=b kJ·mol-1
第二步反应的热化学方程式为____________ 。
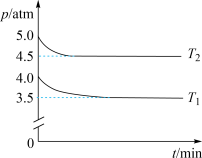
(2)工业上用Cl2生产某些含氯有机物时产生HCl副产物,可用O2将其转化为Cl2,实现循环利用[O2(g) + 4HCl(g) 2Cl2(g) + 2H2O(g)]。将1 molO2和4 molHCl充入某恒容密闭容器中,分别在T1和T2的温度下进行实验,测得容器内总压强(p)与反应时间(t)的变化关系如图所示。
2Cl2(g) + 2H2O(g)]。将1 molO2和4 molHCl充入某恒容密闭容器中,分别在T1和T2的温度下进行实验,测得容器内总压强(p)与反应时间(t)的变化关系如图所示。
①该反应的速率v = k ca(O2)·cb(HCl)(k为速率常数),下列说法正确的是____________ (填标号)。
A 使用催化剂,k不变
B 温度升高,k增大
C 平衡后分离出水蒸气,k变小
D 平衡后再充入1molO2和4molHCl,反应物转化率都增大
②T1________ T2(填“>”或“<”)。该反应的ΔH______ 0(填“>”或“<”),判断的依据是_________ 。
③T2时,HCl的平衡转化率=________ ,反应的Kx=_____ (Kx为以物质的量分数表示的平衡常数)。
(1)用H2O2制取O2时,分解的热化学方程式为: 2H2O2(aq)=2H2O(l) +O2(g) ΔH= a kJ·mol-1
①相同条件下,H2O2分解时,无论是否使用催化剂,均不会改变的是
A 反应速率 B 反应热 C 活化能 D 生成物
②以Fe3+作催化剂时,H2O2的分解反应分两步进行,第一步反应为: H2O2(aq) + 2Fe3+ (aq)=2Fe2+ (aq) +O2(g) +2H+ (aq)ΔH=b kJ·mol-1
第二步反应的热化学方程式为
(2)工业上用Cl2生产某些含氯有机物时产生HCl副产物,可用O2将其转化为Cl2,实现循环利用[O2(g) + 4HCl(g)
 2Cl2(g) + 2H2O(g)]。将1 molO2和4 molHCl充入某恒容密闭容器中,分别在T1和T2的温度下进行实验,测得容器内总压强(p)与反应时间(t)的变化关系如图所示。
2Cl2(g) + 2H2O(g)]。将1 molO2和4 molHCl充入某恒容密闭容器中,分别在T1和T2的温度下进行实验,测得容器内总压强(p)与反应时间(t)的变化关系如图所示。
①该反应的速率v = k ca(O2)·cb(HCl)(k为速率常数),下列说法正确的是
A 使用催化剂,k不变
B 温度升高,k增大
C 平衡后分离出水蒸气,k变小
D 平衡后再充入1molO2和4molHCl,反应物转化率都增大
②T1
③T2时,HCl的平衡转化率=
您最近一年使用:0次



