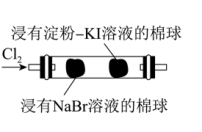
名校
1 . 铁元素的“价—类”二维图如图所示:
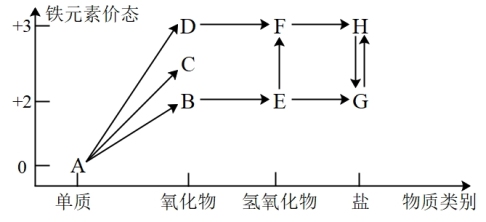
(1)C的化学式是_______ , 反应的化学方程式是
反应的化学方程式是_______ ,反应过程的现象为_______ 。
(2)维生素C可将H转化为G,维生素C具有_______ (填“酸性”、“氧化性”或“还原性”)。
(3)在指定条件下,下列铁及其化合物之间的转化不能实现的是_______ 。
A. B.
B. C.
C.
(4)某小组同学设计如下实验,研究亚铁盐与 溶液的反应。
溶液的反应。
试剂:酸化的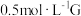 溶液,
溶液, 溶液
溶液
①上述实验中 溶液与G溶液反应的离子方程式是
溶液与G溶液反应的离子方程式是_______ 。
②产生气泡的原因是_______ 。

(1)C的化学式是
 反应的化学方程式是
反应的化学方程式是(2)维生素C可将H转化为G,维生素C具有
(3)在指定条件下,下列铁及其化合物之间的转化不能实现的是
A.
 B.
B.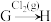 C.
C.
(4)某小组同学设计如下实验,研究亚铁盐与
 溶液的反应。
溶液的反应。试剂:酸化的
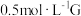 溶液,
溶液, 溶液
溶液| 操作 | 现象 |
取 酸化的G溶液于试管中,加入5滴 酸化的G溶液于试管中,加入5滴 溶液 溶液 | 溶液立即变为棕黄色,稍后,产生气泡。 |
向反应后的溶液中加入 溶液 溶液 | 溶液变红 |
 溶液与G溶液反应的离子方程式是
溶液与G溶液反应的离子方程式是②产生气泡的原因是
您最近一年使用:0次
2022-01-23更新
|
803次组卷
|
8卷引用:河南省宜阳县第一高级中学2022-2023学年高一上学期期末考试化学试题
解题方法
2 . 与下列实验操作和现象所对应的原理解释正确的是
| 实验操作 | 现象 | 原理解释 | |
| A | 向ZnS沉淀上滴加适量0.1mol/LCuSO4溶液,振荡试管 | 沉淀变为黑色 | Ksp(ZnS)sp(CuS) |
| B | 将乙醇与浓硫酸混合加热产生的气体通入酸性KMnO4溶液中 | 溶液紫红色褪去 | 乙醇分子内脱水生成乙烯,乙烯具有还原性 |
| C | 向植物油中加入Na2CO3溶液,加热 | 溶液不再分层 | 碳酸钠溶液呈碱性: +2H2O +2H2O H2CO3+2OHˉ,油脂在碱性条件下水解 H2CO3+2OHˉ,油脂在碱性条件下水解 |
| D | 实验室中加热KClO3和MnO2固体混合物制氧气 | 反应前后MnO2的质量没有发生变化 | MnO2没有参与反应 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
名校
解题方法
3 . 亚氯酸盐(如NaClO2等)可用作漂白剂,在常温避光条件下可保存一年,但在酸性条件下能生成亚氯酸,亚氯酸进而发生分解:5HClO2=4ClO2↑+H++Cl-+2H2O。若在发生分解时加入稀硫酸,发现开始时反应缓慢,然后反应突然加快,并释放出大量ClO2,产生这种现象的原因是( )
| A.酸使亚氯酸的氧化性增强 | B.溶液中的H+起催化作用 |
| C.溶液中的Cl-起催化作用 | D.逸出的ClO2使生成物的浓度降低 |
您最近一年使用:0次
2020-10-11更新
|
505次组卷
|
18卷引用:河南省鹤壁市第一中学2022-2023学年高二上学期期末检测化学试题
河南省鹤壁市第一中学2022-2023学年高二上学期期末检测化学试题第2课时 影响化学反应速率的因素四川省南充高级中学2016-2017学年高一下学期期末考试化学试题辽宁省大连育明高级中学2018届高三人教版选修四9.7同步测试化学试题天津市杨柳青一中2017-2018第一学期高二第一次化学月考【全国百强校】河北省武邑中学2018-2019学年高二上学期第二次月考化学试题高二人教版选修4 第二章 第二节 影响化学反应速率的因素云南省玉溪市通海二中2018-2019学年高一5月份考试化学试题(已下线)2019年6月25日《每日一题》必修2—— 押题2 燃料电池分析2019-2020人教版高中化学必修2第二章《化学反应与能量》测试卷浙江省宁波市北仑中学2019-2020学年高二下学期期中考试化学(选考)试题内蒙古赤峰二中2019-2020学年高一下学期第二次月考(6月)化学试题鲁科版(2019)高二选择性必修第一册第2章 化学反应的方向、限度与速率 第3节 化学反应的速率 课时2 浓度、温度、催化剂对化学反应速率的影响陕西省西安市第一中学2020-2021学年高二上学期期中考试化学试题福建省福州格致中学2021-2022学年高二上学期第一阶段测试化学试题(10月)四川省邻水实验学校2021-2022学年高二上学期第一次月考化学试题云南省腾冲市第一中学2021-2022学年高二下学期3月份考试化学试题第一节 化学反应速率 第2课时 影响化学反应速率的因素 活化能
解题方法
4 . 某化学小组为了研究外界条件对化学反应速率的影响,进行了如下实验。
【实验原理】
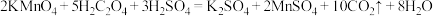
【实验内容及记录】
(1)实验目的是_______ 。
(2)请解释实验②中加入1.0mL蒸馏水的原因:_______ 。
(3)据实验资料记载, 对该反应有催化作用。某小组同学计划设计实验验证
对该反应有催化作用。某小组同学计划设计实验验证 对该反应有催化作用,请填写表格并回答问题。
对该反应有催化作用,请填写表格并回答问题。
若所加固体对反应确有催化作用,应观察到的现象是_______ 。
【实验原理】
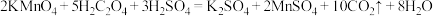
【实验内容及记录】
| 实验编号 | 室温下,试管中所加试剂及其用量/ml | 室温下溶液颜色褪至无色时所需时间/min | |||
 溶液 溶液 |  | 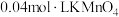 溶液 溶液 | 0.36mol·L稀硫酸 | ||
| ① | 2.0 | 2.0 | 1.0 | 1.0 | 4.1 |
| ② | 3.0 | 1.0 | 1.0 | 1.0 | 3.7 |
(2)请解释实验②中加入1.0mL蒸馏水的原因:
(3)据实验资料记载,
 对该反应有催化作用。某小组同学计划设计实验验证
对该反应有催化作用。某小组同学计划设计实验验证 对该反应有催化作用,请填写表格并回答问题。
对该反应有催化作用,请填写表格并回答问题。| 实验编号 | 室温下,试管中所加试剂及其用量/ml | 向试管中加入少量固体 | 室温下溶液颜色褪至无色时所需时间/min | |||
 溶液 溶液 |  | 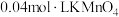 溶液 溶液 | 0.36mol·L稀硫酸 | |||
| ③ | 3.0 | t | ||||
您最近一年使用:0次
名校
解题方法
5 . 某研究性学习小组利用H2C2O4溶液和酸性KMnO4溶液的反应探究“外界条件的改变对化学反应速率的影响”,进行了如下实验:
[实验内容]
请回答:
(1)请写出H2C2O4溶液和酸性KMnO4溶液反应的离子反应方程式_______ 。
(2)实验过程使用了“控制变量法”,则V1=_______ ,V2=_______ ;根据上表中的实验数据,可以得到的结论是_______ 。
(3)该小组同学根据经验绘制了n(Mn2+)随时间变化趋势的示意图,如图甲所示。但乙同学查阅已有的资料发现,该实验过程中n(Mn2+)随时间变化的趋势应如图乙所示。

该小组同学根据如图所示信息提出了新的假设,并继续进行实验探究:
①该小组同学提出的假设是_______ 。
②请你帮助该小组同学完成实验方案。
再向试管中加入的少量固体的化学式为_______ 。
③若该小组同学提出的假设成立,应观察到的现象是_______ 。
[实验内容]
| 实验编号 | 室温下,试管中所加试剂及其用量/mL | 室温下溶液颜色褪至无色所需时间/min | |||
| 2.0mol·L-1H2C2O4溶液 | H2O | 0.2molL-1KMnO4溶液 | 3mol·L-1稀硫酸 | ||
| 1 | 3.0 | 2.0 | 3.0 | V1 | 4.0 |
| 2 | 2.0 | V2 | 3.0 | 2.0 | 5.2 |
| 3 | 1.0 | 4.0 | 3.0 | 2.0 | 6.4 |
(1)请写出H2C2O4溶液和酸性KMnO4溶液反应的离子反应方程式
(2)实验过程使用了“控制变量法”,则V1=
(3)该小组同学根据经验绘制了n(Mn2+)随时间变化趋势的示意图,如图甲所示。但乙同学查阅已有的资料发现,该实验过程中n(Mn2+)随时间变化的趋势应如图乙所示。

该小组同学根据如图所示信息提出了新的假设,并继续进行实验探究:
①该小组同学提出的假设是
②请你帮助该小组同学完成实验方案。
| 实验编号 | 室温下,试管中所加试剂及其用量/mL | 再向试管中加入少量固体 | 室温下溶液颜色褪至无色所需时间/min | |||
| 2.0mol·L-1H2C2O4溶液 | H2O | 0.2mol·L-1KMnO4溶液 | 3mol·L-1稀硫酸 | |||
| 4 | 3.0 | 2.0 | 3.0 | 2.0 | _______ | t |
③若该小组同学提出的假设成立,应观察到的现象是
您最近一年使用:0次
名校
6 . 根据以下实验操作及现象能得出正确结论的是
| 选项 | 实验操作 | 现象 | 结论 |
| A | 向溶有SO2的BaCl2溶液中通入气体X | 有白色沉淀产生 | 气体X一定有强氧化性 |
| B | 向等浓度等体积的H2O2中分别加入等浓度等体积的KMnO4溶液和CuSO4溶液 | 前者产生气泡速率快 | KMnO4的催化效果比CuSO4好 |
| C | 将银粉加到HI溶液中 | 产生无色气体和黄色沉淀 | I-和Ag+形成沉淀,促进Ag和H+反应 |
| D | 用铂电极电解等物质的量浓度的Fe(NO3)3和Cu(NO3)2混合溶液 | 开始时阴极无红色物质析出 | 氧化性:Cu2+<Fe2+ |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2023-10-13更新
|
229次组卷
|
3卷引用:河南省焦作市博爱县第一中学2023-2024学年高一上学期11月期中考试化学试题
名校
解题方法
7 . 化学创造美好生活。下列生产活动与对应化学原理没有关联或关联性错误的是
| 选项 | 生产活动 | 化学原理 |
| A | 社区服务:用84消毒液清洗公共桌椅 | 84消毒液中的 有强氧化性 有强氧化性 |
| B | 实践活动:用酵母菌发酵面粉 | 催化剂可以加快反应速率 |
| C | 自主探究:将铁丝分别放在有水和无水环境中观察较长时间 | 钢铁在有水存在的条件下更容易生锈 |
| D | 家务劳动:厨房纸巾擦拭清理电饼铛 | 厨房纸巾表面积大,吸附油污能力强 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2023-10-26更新
|
546次组卷
|
5卷引用:河南省豫北名校2024届高三毕业班上学期一轮复习联考(二)化学试题
名校
解题方法
8 . 下列实验装置正确且能达到相应实验目的是
| 证明氧化性:Cl2>Br2>I2 | 探究Fe3+、Cu2+对H2O2分解速率的影响 | 检验化合物中是否含钾元素 | 灼烧碎海带 |
|
|
|
|
| A | B | C | D |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2023-04-28更新
|
189次组卷
|
2卷引用:河南省实验中学2022-2023学年高一下学期期中考试化学试题
解题方法
9 . 研究氮氧化物的转化机理对环境保护具有重要意义。请回答下列问题:
(1)N2O是硝酸工业中氨催化氧化的副产物,CO处理N2O的原理为CO+N2O=N2+CO2。
①硝酸工业中氨被氧化成一氧化氮,生成的一氧化氮被反应后残余的氧气继续氧化为二氧化氮,随后将二氧化氮通入水中制取硝酸。写出一氧化氮到硝酸的总化学方程式:____________ 。
②在Fe+作用下,反应CO+N2O=N2+CO2分两步进行,已知第ⅰ步反应为
N2O+Fe+=N2+FeO+,试写出第ⅱ步反应的方程式:____________ 。
(2)处理 NO2的原理之一为2NO2(g)+2C(s) N2(g)+2CO2(g)。一定温度下,在2L恒容密闭容器中充入1molNO2和足量C发生该反应(不考虑2NO2
N2(g)+2CO2(g)。一定温度下,在2L恒容密闭容器中充入1molNO2和足量C发生该反应(不考虑2NO2 N2O4)。
N2O4)。
①实验测得NO2的转化率与时间的关系如图所示:
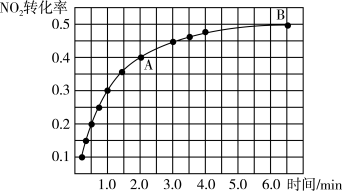
反应达到平衡时CO2的体积分数为____________ ,混合气体的平均摩尔质量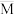 (A)
(A)____________ 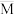 (B) (填“大于”“小于”或“等于”)。
(B) (填“大于”“小于”或“等于”)。
②下列能够判断该反应已达到平衡状态的是____________ (填序号)。
A.CO2的质量分数保持不变
B.容器中CO2与N2的百分含量之比保持不变
C.2v逆(NO2)=v正(N2)
D.混合气体的颜色保持不变
(3)羟基自由基(·OH)也可以用于脱硫脱硝。图表示光催化氧化技术可生成·OH,光照时,价带失去电子产生空穴(h+,具有强氧化性),价带上H2O直接转化为·OH, 在导带获得电子生成H2O2或
在导带获得电子生成H2O2或 ,最终转化为·OH。
,最终转化为·OH。

①价带上H2O遇h+直接转化为·OH的反应式可表示为______ ;
②在净化器中·OH与NO反应的化学方程式可表示为______ 。
(1)N2O是硝酸工业中氨催化氧化的副产物,CO处理N2O的原理为CO+N2O=N2+CO2。
①硝酸工业中氨被氧化成一氧化氮,生成的一氧化氮被反应后残余的氧气继续氧化为二氧化氮,随后将二氧化氮通入水中制取硝酸。写出一氧化氮到硝酸的总化学方程式:
②在Fe+作用下,反应CO+N2O=N2+CO2分两步进行,已知第ⅰ步反应为
N2O+Fe+=N2+FeO+,试写出第ⅱ步反应的方程式:
(2)处理 NO2的原理之一为2NO2(g)+2C(s)
 N2(g)+2CO2(g)。一定温度下,在2L恒容密闭容器中充入1molNO2和足量C发生该反应(不考虑2NO2
N2(g)+2CO2(g)。一定温度下,在2L恒容密闭容器中充入1molNO2和足量C发生该反应(不考虑2NO2 N2O4)。
N2O4)。①实验测得NO2的转化率与时间的关系如图所示:

反应达到平衡时CO2的体积分数为
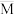 (A)
(A)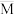 (B) (填“大于”“小于”或“等于”)。
(B) (填“大于”“小于”或“等于”)。②下列能够判断该反应已达到平衡状态的是
A.CO2的质量分数保持不变
B.容器中CO2与N2的百分含量之比保持不变
C.2v逆(NO2)=v正(N2)
D.混合气体的颜色保持不变
(3)羟基自由基(·OH)也可以用于脱硫脱硝。图表示光催化氧化技术可生成·OH,光照时,价带失去电子产生空穴(h+,具有强氧化性),价带上H2O直接转化为·OH,
 在导带获得电子生成H2O2或
在导带获得电子生成H2O2或 ,最终转化为·OH。
,最终转化为·OH。
①价带上H2O遇h+直接转化为·OH的反应式可表示为
②在净化器中·OH与NO反应的化学方程式可表示为
您最近一年使用:0次
2022-11-15更新
|
216次组卷
|
4卷引用:河南省天一大联考2023届高三上学期期中考试化学试题
名校
解题方法
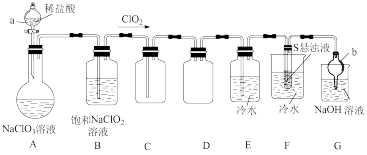
10 . 二氧化氯常用作氧化剂、脱臭剂、保鲜剂、漂白剂等。因其具有对人体及动物无害以及对环境不造成二次污染等特点备受人们青睐。某实验室设计如图装置制取并收集 且探究其性质。
且探究其性质。
已知:
① 是一种易溶于水的黄绿色气体,与冷水几乎不反应,与热水能反应,其熔点
是一种易溶于水的黄绿色气体,与冷水几乎不反应,与热水能反应,其熔点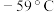 ,沸点
,沸点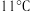 ,受热易分解;
,受热易分解;
②稀盐酸与 反应或
反应或 与
与 溶液反应均可制取
溶液反应均可制取 。
。
回答下列问题:
(1)仪器b的名称是___________ 。
(2)装置A中发生反应: +
+___________ 
 ,滴加稀盐酸时,应缓慢滴加,其主要原因是
,滴加稀盐酸时,应缓慢滴加,其主要原因是___________ 。
(3)根据(2)试分析装置B的作用:___________ (用化学方程式说明)。
(4)装置F中可得到两种强酸的混合溶液,该装置中的现象为___________ ,反应的化学方程式为___________ 。
(5)已知在酸性条件下 可发生反应生成
可发生反应生成 并释放出
并释放出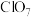 ,向
,向 溶液中滴加盐酸,反应剧烈,若将盐酸换成等
溶液中滴加盐酸,反应剧烈,若将盐酸换成等 的硫酸,开始反应缓慢,稍后一段时间产生气体速率迅速加快,产生气体速率迅速加快的原因是
的硫酸,开始反应缓慢,稍后一段时间产生气体速率迅速加快,产生气体速率迅速加快的原因是___________ 。
 且探究其性质。
且探究其性质。
已知:
①
 是一种易溶于水的黄绿色气体,与冷水几乎不反应,与热水能反应,其熔点
是一种易溶于水的黄绿色气体,与冷水几乎不反应,与热水能反应,其熔点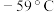 ,沸点
,沸点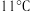 ,受热易分解;
,受热易分解;②稀盐酸与
 反应或
反应或 与
与 溶液反应均可制取
溶液反应均可制取 。
。回答下列问题:
(1)仪器b的名称是
(2)装置A中发生反应:
 +
+
 ,滴加稀盐酸时,应缓慢滴加,其主要原因是
,滴加稀盐酸时,应缓慢滴加,其主要原因是(3)根据(2)试分析装置B的作用:
(4)装置F中可得到两种强酸的混合溶液,该装置中的现象为
(5)已知在酸性条件下
 可发生反应生成
可发生反应生成 并释放出
并释放出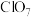 ,向
,向 溶液中滴加盐酸,反应剧烈,若将盐酸换成等
溶液中滴加盐酸,反应剧烈,若将盐酸换成等 的硫酸,开始反应缓慢,稍后一段时间产生气体速率迅速加快,产生气体速率迅速加快的原因是
的硫酸,开始反应缓慢,稍后一段时间产生气体速率迅速加快,产生气体速率迅速加快的原因是
您最近一年使用:0次
2022-09-12更新
|
171次组卷
|
2卷引用:河南省焦作第一中学2023-2024学年高三上学期10月模拟化学测试