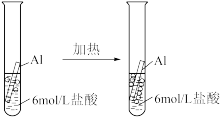
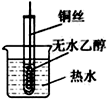
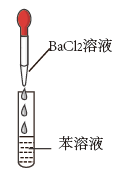
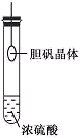
与下列实验操作和现象所对应的原理解释正确的是
| 实验操作 | 现象 | 原理解释 | |
| A | 向ZnS沉淀上滴加适量0.1mol/LCuSO4溶液,振荡试管 | 沉淀变为黑色 | Ksp(ZnS)sp(CuS) |
| B | 将乙醇与浓硫酸混合加热产生的气体通入酸性KMnO4溶液中 | 溶液紫红色褪去 | 乙醇分子内脱水生成乙烯,乙烯具有还原性 |
| C | 向植物油中加入Na2CO3溶液,加热 | 溶液不再分层 | 碳酸钠溶液呈碱性: +2H2O +2H2O H2CO3+2OHˉ,油脂在碱性条件下水解 H2CO3+2OHˉ,油脂在碱性条件下水解 |
| D | 实验室中加热KClO3和MnO2固体混合物制氧气 | 反应前后MnO2的质量没有发生变化 | MnO2没有参与反应 |
| A.A | B.B | C.C | D.D |
更新时间:2023-03-21 14:21:39
|
相似题推荐
单选题
|
适中
(0.65)
名校
【推荐1】已知Fe3+能催化H2O2分解,2H2O2(aq) = 2H2O(l)+O2(g)的反应机理及反应进程中的能量变化如下:
步骤①:2Fe3+(aq)+H2O2(aq)=2Fe2+(aq)+O2(g)+2H+(aq)步骤②:

下列有关H2O2分解反应说法错误的是
步骤①:2Fe3+(aq)+H2O2(aq)=2Fe2+(aq)+O2(g)+2H+(aq)步骤②:


下列有关H2O2分解反应说法错误的是
| A.v(H2O2)=2v(O2) |
| B.该反应的△H<0 |
| C.增大Fe3+的浓度能够加快反应速率 |
| D.若不加Fe3+,正反应的活化能比逆反应大 |
您最近一年使用:0次
单选题
|
适中
(0.65)
【推荐2】在三种不同条件下,分别向容积为2 L的恒容密闭容器中充入2 mol A和 1 mol B,发生反应如下:2A (g) +B(g) 2D(g) ΔH=−Q kJ·mol-1,相关条件和数据见下表。
2D(g) ΔH=−Q kJ·mol-1,相关条件和数据见下表。
下列说法中正确的是
 2D(g) ΔH=−Q kJ·mol-1,相关条件和数据见下表。
2D(g) ΔH=−Q kJ·mol-1,相关条件和数据见下表。| 实验Ⅰ | 实验Ⅱ | 实验Ⅲ | |
| 反应温度/ ℃ | 800 | 800 | 850 |
| 达平衡时间/min | 40 | 10 | 30 |
| c(D)平衡/mol·L-1 | 0.5 | 0.5 | 0.15 |
| 反应的能量变化/kJ | Q1 | Q2 | Q3 |
| A.可用压强或密度是否发生变化判断上述反应是否达平衡状态 |
| B.实验Ⅱ可能隐含的条件是使用催化剂,实验Ⅲ达平衡时v(D)为0.05 mol·L-1·min-1 |
| C.由表中信息可知Q>0,并且有Q3<Q1=Q2=Q |
| D.实验Ⅰ达平衡后,恒温下再向容器中通入2 mol A和1 mol B,新平衡时c(D)大于1.0 mol·L-1 |
您最近一年使用:0次
单选题
|
适中
(0.65)
名校
解题方法
【推荐1】下列有关化学用语表示正确的是
A.HS-水解:HS-+H2O S2-+H3O+ S2-+H3O+ |
B.醋酸溶液中滴加Na2CO3溶液:2H++ =CO2↑+H2O =CO2↑+H2O |
| C.钢铁发生电化学腐蚀的负极反应式:Fe-3e-=Fe3+ |
D.向ZnS沉淀中滴加CuSO4溶液可得到CuS沉淀:ZnS(s)+Cu2+(aq) CuS(s)+Zn2+(aq) CuS(s)+Zn2+(aq) |
您最近一年使用:0次
单选题
|
适中
(0.65)
名校
【推荐2】下列反应的离子方程式正确的是
A.硫酸铝溶液和小苏打溶液反应Al3++3 =3CO2↑+Al(OH)3↓ =3CO2↑+Al(OH)3↓ |
| B.向Ca(ClO)2溶液中通入二氧化硫Ca2++2ClO-+SO2+H2O=CaSO3+2HClO |
| C.硫化亚铁中加入盐酸S2-+2H+=H2S↑ |
| D.钠和冷水反应Na+2H2O=Na++H2↑+2OH- |
您最近一年使用:0次
单选题
|
适中
(0.65)
名校
解题方法
【推荐1】下图所示的实验,能 达到实验目的的是
| A | B | C | D |
 |  |  |  |
| 探究浓度对化学反应速率的影响 | 证明 | 推注射器,气体颜色先变深后变浅,证明平衡正向移动 |  制取无水 制取无水 固体 固体 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
单选题
|
适中
(0.65)
解题方法
【推荐2】下列实验操作、现象与结论对应关系正确的是
| 选项 | 实验操作 | 实验现象 | 结论 |
| A | 向盛有漂白粉溶液的试管中加浓硫酸 | 产生黄绿色气体 | 浓硫酸具有氧化性 |
| B | 向SO2水溶液中滴入几滴BaCl2溶液,振荡 | 出现白色沉淀 | 此沉淀是BaSO4 |
| C | 使装有NO2气体的密闭容器减小体积 | 气体颜色先变深、而后变浅 | 气体颜色变浅原因是:2NO2⇋N2O4 |
| D | 先向2mL 0.1mol/L Na2S溶液中滴入几滴0.1mol/L ZnSO4溶液,再加入几滴0.1mol/L CuSO4溶液 | 开始有白色沉淀生成;后又有黑色沉淀生成 | 溶度积(Ksp):ZnS>CuS |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
单选题
|
适中
(0.65)
【推荐1】已知 是阿伏加德罗常数的值,下列说法正确的的是
是阿伏加德罗常数的值,下列说法正确的的是
 是阿伏加德罗常数的值,下列说法正确的的是
是阿伏加德罗常数的值,下列说法正确的的是A.46g乙醇中插入刚灼烧后的铜丝,液体中碳氢键的数目依然为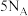 |
B.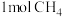 与 与 混合,光照充分反应,生成 混合,光照充分反应,生成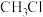 分子数小于 分子数小于 |
C.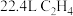 在 在 中充分燃烧,消耗 中充分燃烧,消耗 的分子数为 的分子数为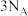 |
D.常温下28g铁粉放入浓硝酸中,充分反应,转移电子数为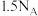 |
您最近一年使用:0次
单选题
|
适中
(0.65)
名校
【推荐2】乙醛常用于有机合成,可由乙醇氧化得到。乙醇催化氧化制取乙醛的反应如下:CH3CH2OH+CuO CH3CHO+Cu+H2O,下列说法正确的是
CH3CHO+Cu+H2O,下列说法正确的是
 CH3CHO+Cu+H2O,下列说法正确的是
CH3CHO+Cu+H2O,下列说法正确的是| A.CuO晶体是共价晶体 |
B.H2O的电子式: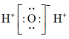 |
| C.CH3CH2OH难溶于水 |
| D.1 mol CH3CHO中所含σ键的数目为6 mol |
您最近一年使用:0次