解题方法
1 . 二甲醚 既是一种有机燃料,又是一种重要的有机化工原料。利用
既是一种有机燃料,又是一种重要的有机化工原料。利用 催化氢化制备二甲醚的反应原理如下:
催化氢化制备二甲醚的反应原理如下:
 .
.

 .
.

 .
.

回答下列问题:
(1)
___________ 。
(2)向初始温度为T℃的某恒容绝热容器中投入2mol 只发生反应
只发生反应 ,平衡时
,平衡时 的转化率为
的转化率为 。
。
①下列叙述能说明反应 已经达到平衡的是
已经达到平衡的是___________ (填选项字母)。
a.混合气体密度不再发生变化
b.容器内压强不再发生变化
c. 的消耗速率等于
的消耗速率等于 的消耗速率
的消耗速率
d. 的体积分数不再发生变化
的体积分数不再发生变化
②相同条件下,若向该容器中加入 和
和 各1mol,平衡时
各1mol,平衡时 的转化率为
的转化率为 。则
。则
___________ 1(填“>”“=”或“<”)。
③在催化剂条件下反应 的反应过程如图甲所示,“*”表示吸附在催化剂上。
的反应过程如图甲所示,“*”表示吸附在催化剂上。
该催化过程的决速步骤为___________ (填“第一步”或“第二步”),判断的理由是___________ 。
(3)向压强恒定为p kPa的某密闭容器中按 投入
投入 和
和 ,发生
,发生 催化氢化制备二甲醚系列反应
催化氢化制备二甲醚系列反应 和
和 。
。 平衡转化率
平衡转化率 随温度的变化情况如图乙。
随温度的变化情况如图乙。
①图中能表示 随温度变化的曲线是
随温度变化的曲线是___________ (填“ ”或“
”或“ ”),原因为
”),原因为___________ 。
② K时,
K时, 的平衡体积分数为10%。则平衡时
的平衡体积分数为10%。则平衡时 的体积分数为
的体积分数为___________ (保留3位有效数字); K时反应
K时反应 的压强平衡常数
的压强平衡常数
___________  (用含p的代数式表示,列出计算式即可)。
(用含p的代数式表示,列出计算式即可)。
 既是一种有机燃料,又是一种重要的有机化工原料。利用
既是一种有机燃料,又是一种重要的有机化工原料。利用 催化氢化制备二甲醚的反应原理如下:
催化氢化制备二甲醚的反应原理如下: .
.

 .
.

 .
.

回答下列问题:
(1)

(2)向初始温度为T℃的某恒容绝热容器中投入2mol
 只发生反应
只发生反应 ,平衡时
,平衡时 的转化率为
的转化率为 。
。①下列叙述能说明反应
 已经达到平衡的是
已经达到平衡的是a.混合气体密度不再发生变化
b.容器内压强不再发生变化
c.
 的消耗速率等于
的消耗速率等于 的消耗速率
的消耗速率d.
 的体积分数不再发生变化
的体积分数不再发生变化②相同条件下,若向该容器中加入
 和
和 各1mol,平衡时
各1mol,平衡时 的转化率为
的转化率为 。则
。则
③在催化剂条件下反应
 的反应过程如图甲所示,“*”表示吸附在催化剂上。
的反应过程如图甲所示,“*”表示吸附在催化剂上。
该催化过程的决速步骤为
(3)向压强恒定为p kPa的某密闭容器中按
 投入
投入 和
和 ,发生
,发生 催化氢化制备二甲醚系列反应
催化氢化制备二甲醚系列反应 和
和 。
。 平衡转化率
平衡转化率 随温度的变化情况如图乙。
随温度的变化情况如图乙。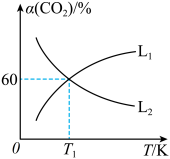
①图中能表示
 随温度变化的曲线是
随温度变化的曲线是 ”或“
”或“ ”),原因为
”),原因为②
 K时,
K时, 的平衡体积分数为10%。则平衡时
的平衡体积分数为10%。则平衡时 的体积分数为
的体积分数为 K时反应
K时反应 的压强平衡常数
的压强平衡常数
 (用含p的代数式表示,列出计算式即可)。
(用含p的代数式表示,列出计算式即可)。
您最近一年使用:0次
7日内更新
|
64次组卷
|
4卷引用:2024届陕西省安康市汉滨区高三下学期联考模拟预测(四)理综试题-高中化学
2024届陕西省安康市汉滨区高三下学期联考模拟预测(四)理综试题-高中化学(已下线)押题卷01(14+4题型)-2024高考化学考点必杀300题(新高考通用)河南省青桐鸣联考2023-2024学年高二下学期3月月考化学试题(已下线)压轴题13?化学反应原理综合题(5大题型+方法总结+压轴题速练)-2024年高考化学压轴题专项训练(新高考通用)
2024高三·全国·专题练习
2 . 工业合成氨常选择反应:N2+3H2 2NH3,设NA为阿伏加德罗常数的值,下列说法正确的是
2NH3,设NA为阿伏加德罗常数的值,下列说法正确的是
 2NH3,设NA为阿伏加德罗常数的值,下列说法正确的是
2NH3,设NA为阿伏加德罗常数的值,下列说法正确的是| A.28 g N2完全反应,转移的电子数为3NA |
| B.混合气中物质的沸点:NH3>N2>H2 |
| C.在一定温度的固定容器中进行反应,通入氦气,能提高氢气的转化率 |
| D.反应物断裂NA个σ键的同时生成物断裂NA个σ键,反应达到平衡状态 |
您最近一年使用:0次
2024高三·全国·专题练习
3 . 下列由实验操作及现象所得结论正确的是
| A.将同浓度同体积的KHSO3溶液与FeCl3溶液混合,充分反应后滴入KSCN溶液,溶液变红色,证明该反应存在一定限度 |
B.室温下测得0.1mol·L-1Na2SO3溶液的pH约为10,0.1mol·L-1NaHSO3溶液的pH约为5,说明HSO 结合H+的能力比SO 结合H+的能力比SO 强 强 |
| C.将饱和NaBr溶液滴入AgCl浊液中,沉淀颜色由白色变为淡黄色,证明Ksp(AgCl)>Ksp(AgBr) |
| D.常温下,用pH试纸分别测定浓度均为0.1mol·L-1的CH3COONa溶液和Na2S溶液,后者pH大,证明酸性:H2S<CH3COOH |
您最近一年使用:0次
2024·宁夏石嘴山·一模
名校
4 . 空间站处理 的一种重要方法是对
的一种重要方法是对 进行收集和再生处理,重新生成可供人体呼吸的氧气。其技术路线可分为以下三步:
进行收集和再生处理,重新生成可供人体呼吸的氧气。其技术路线可分为以下三步:
Ⅰ.固态胺吸收与浓缩
在水蒸气存在下固态胺吸收 反应生成酸式碳酸盐(该反应是放热反应),再解吸出
反应生成酸式碳酸盐(该反应是放热反应),再解吸出 的简单方法是加热。
的简单方法是加热。
Ⅱ. 的加氢甲烷化
的加氢甲烷化
 还原
还原 制
制 的部分反应如下:
的部分反应如下:
i.CO2(g)+H2(g) CO(g)+H2O(g)
CO(g)+H2O(g) 
ii.CO(g)+3H2 CH4(g)+H2O(g)
CH4(g)+H2O(g) 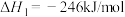
(1)反应CO2(g)+4H2(g) CH4(g)+2H2O(g)的
CH4(g)+2H2O(g)的
___________  。
。
(2)向恒容绝热的密闭容器中充入amolCO与2amolH2,进行反应ii,下列能判断反应已达化学平衡状态的是___________ ;
a.容器中混合气体密度不变 b.混合气体中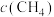 与
与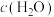 之比不变
之比不变
c.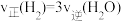 d.容器内温度不变
d.容器内温度不变
Ⅲ.和 合成甲烷也是资源化利用的重要方法。对于上述(1)的反应
合成甲烷也是资源化利用的重要方法。对于上述(1)的反应 ,催化剂的选择是甲烷化技术的核心。在两种不同催化剂条件下反应相同时间,测得转化率和生成
,催化剂的选择是甲烷化技术的核心。在两种不同催化剂条件下反应相同时间,测得转化率和生成 选择性随温度变化的影响如下图所示:
选择性随温度变化的影响如下图所示: 转化率仍在上升,其原因是
转化率仍在上升,其原因是___________ 。
(4)对比上述两种催化剂的催化性能,工业上应选择的催化剂是___________ ,使用的合适温度为___________ 。
(5)控制起始时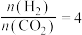 ,P=1atm,恒容条件下,若只发生反应i、ii,平衡时各物质的量分数随温度的变化如图所示:
,P=1atm,恒容条件下,若只发生反应i、ii,平衡时各物质的量分数随温度的变化如图所示:___________ (填增大,减小或者不变)。
②图中代表 的曲线是
的曲线是___________ (填“a”、“b”或“c”);温度低于500℃时,CO的物质的量分数约为0,说明此条件下,反应___________ (填“i”或“ii”)化学平衡常数大,反应完全。
③反应CO2(g)+4H2(g) CH4(g)+2H2O(g)的平衡常数
CH4(g)+2H2O(g)的平衡常数
___________  (用平衡分压代替平衡浓度计算,分压总压物质的量分数)。
(用平衡分压代替平衡浓度计算,分压总压物质的量分数)。
 的一种重要方法是对
的一种重要方法是对 进行收集和再生处理,重新生成可供人体呼吸的氧气。其技术路线可分为以下三步:
进行收集和再生处理,重新生成可供人体呼吸的氧气。其技术路线可分为以下三步:Ⅰ.固态胺吸收与浓缩

在水蒸气存在下固态胺吸收
 反应生成酸式碳酸盐(该反应是放热反应),再解吸出
反应生成酸式碳酸盐(该反应是放热反应),再解吸出 的简单方法是加热。
的简单方法是加热。Ⅱ.
 的加氢甲烷化
的加氢甲烷化 还原
还原 制
制 的部分反应如下:
的部分反应如下:i.CO2(g)+H2(g)
 CO(g)+H2O(g)
CO(g)+H2O(g) 
ii.CO(g)+3H2
 CH4(g)+H2O(g)
CH4(g)+H2O(g) 
(1)反应CO2(g)+4H2(g)
 CH4(g)+2H2O(g)的
CH4(g)+2H2O(g)的
 。
。(2)向恒容绝热的密闭容器中充入amolCO与2amolH2,进行反应ii,下列能判断反应已达化学平衡状态的是
a.容器中混合气体密度不变 b.混合气体中
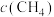 与
与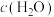 之比不变
之比不变c.
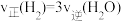 d.容器内温度不变
d.容器内温度不变Ⅲ.和
 合成甲烷也是资源化利用的重要方法。对于上述(1)的反应
合成甲烷也是资源化利用的重要方法。对于上述(1)的反应 ,催化剂的选择是甲烷化技术的核心。在两种不同催化剂条件下反应相同时间,测得转化率和生成
,催化剂的选择是甲烷化技术的核心。在两种不同催化剂条件下反应相同时间,测得转化率和生成 选择性随温度变化的影响如下图所示:
选择性随温度变化的影响如下图所示: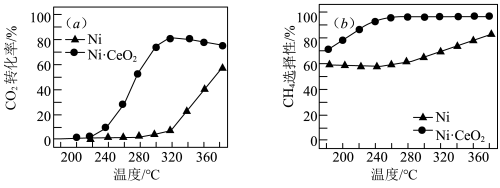
 转化率仍在上升,其原因是
转化率仍在上升,其原因是(4)对比上述两种催化剂的催化性能,工业上应选择的催化剂是
(5)控制起始时
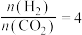 ,P=1atm,恒容条件下,若只发生反应i、ii,平衡时各物质的量分数随温度的变化如图所示:
,P=1atm,恒容条件下,若只发生反应i、ii,平衡时各物质的量分数随温度的变化如图所示: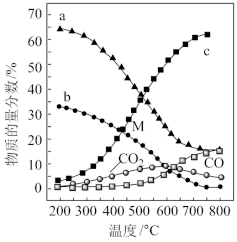
②图中代表
 的曲线是
的曲线是③反应CO2(g)+4H2(g)
 CH4(g)+2H2O(g)的平衡常数
CH4(g)+2H2O(g)的平衡常数
 (用平衡分压代替平衡浓度计算,分压总压物质的量分数)。
(用平衡分压代替平衡浓度计算,分压总压物质的量分数)。
您最近一年使用:0次
2024-05-05更新
|
486次组卷
|
4卷引用:题型11 反应原理综合题(25题)-2024年高考化学常考点必杀300题(新高考通用)
(已下线)题型11 反应原理综合题(25题)-2024年高考化学常考点必杀300题(新高考通用)(已下线)提升练09 化学反应原理综合-【查漏补缺】2024年高考化学复习冲刺过关(新高考专用)宁夏石嘴山市光明中学2024届高三第一次模拟考试理综化学试题湖南省衡阳市衡阳县第一中学2023-2024学年高三下学期4月月考化学试题
名校
解题方法
5 . 工业制硫酸的一步重要反应是SO2的催化氧化。在2L密闭容器中,充入SO2和足量O2,在催化剂、500℃的条件下发生反应。SO2、SO3的物质的量随时间的变化如图。下列说法不正确 的是
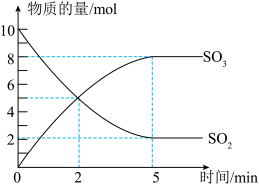
| A.在上述条件下,SO2不可能100%地转化为SO3 |
| B.反应到2min时,正逆反应速率相等 |
| C.反应开始至5min末,以SO2浓度的变化表示该反应的平均反应速率是0.8mol/(L·min) |
| D.使用催化剂是为了加快反应速率,提高生产效率 |
您最近一年使用:0次
2024-05-04更新
|
254次组卷
|
2卷引用:北京市陈经纶中学2023-2024学年高一下学期期中诊断化学试卷
2024高三·全国·专题练习
6 . 以Cl2、SO2和PCl3为原料,制备POCl3和氯化亚砜(SOCl2)的原理为PCl3(g)+Cl2(g)+SO2(g) POCl3(s)+SOCl2(g);ΔH<0,下列说法正确的是
POCl3(s)+SOCl2(g);ΔH<0,下列说法正确的是
 POCl3(s)+SOCl2(g);ΔH<0,下列说法正确的是
POCl3(s)+SOCl2(g);ΔH<0,下列说法正确的是| A.使用催化剂可以同时降低正反应和逆反应的活化能 |
| B.1molCl-Cl键断裂的同时有2molS-Cl键形成,说明反应到达该条件下的平衡状态 |
C.反应平衡常数K= |
| D.上述反应中消耗3.36LCl2,转移电子数为0.3×6.02×1023 |
您最近一年使用:0次
2024高三·全国·专题练习
解题方法
7 . Ⅰ.H2S与CH4重整,不但可以消除污染,还可以制氢。主要反应为 ;ΔH>0。
;ΔH>0。
(1)在恒温恒容条件下,可作为上述反应达到平衡状态的判断依据的是_______。
Ⅱ.在恒压条件下,以n(CH4)∶n(H2S)=1∶2组成的混合气体发生反应: ;ΔH>0,达到平衡状态时,四种组分物质的量分数随温度的变化如下图所示。
;ΔH>0,达到平衡状态时,四种组分物质的量分数随温度的变化如下图所示。_______ 、_______ (填化学式)。
(3)M点对应温度下,H2S的转化率是_______ 。
Ⅲ.在研究反应发生的适宜条件时发现:过多的CH4会导致Al2O3催化剂失活;Co助剂有稳定催化剂的作用。如下图表示800 ℃,Al2O3催化剂条件下投入等量H2S,投料比[n(CH4)∶n(H2S)]分别为1∶1、1∶3、12∶1,达平衡时H2S转化率、平均反应速率。_______ (填“A”“B”或“C”)组图像。三组图像中,C组图像中平均反应速率最低的可能原因是_______ 。
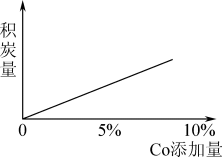
(5)未添加Co助剂时,无积炭,随着Co添加量的变化,积炭量变化如下图所示,Co助剂可能催化原料气发生反应的化学方程式为____ 。
 ;ΔH>0。
;ΔH>0。(1)在恒温恒容条件下,可作为上述反应达到平衡状态的判断依据的是_______。
| A.混合气体密度不变 |
| B.容器内压强不变 |
| C.2v正(H2S)=v逆(CS2) |
| D.CH4与H2的物质的量分数之比保持不变 |
Ⅱ.在恒压条件下,以n(CH4)∶n(H2S)=1∶2组成的混合气体发生反应:
 ;ΔH>0,达到平衡状态时,四种组分物质的量分数随温度的变化如下图所示。
;ΔH>0,达到平衡状态时,四种组分物质的量分数随温度的变化如下图所示。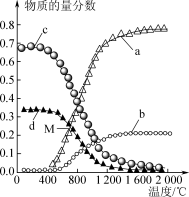
(3)M点对应温度下,H2S的转化率是
Ⅲ.在研究反应发生的适宜条件时发现:过多的CH4会导致Al2O3催化剂失活;Co助剂有稳定催化剂的作用。如下图表示800 ℃,Al2O3催化剂条件下投入等量H2S,投料比[n(CH4)∶n(H2S)]分别为1∶1、1∶3、12∶1,达平衡时H2S转化率、平均反应速率。
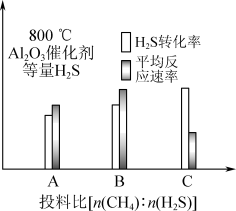
(5)未添加Co助剂时,无积炭,随着Co添加量的变化,积炭量变化如下图所示,Co助剂可能催化原料气发生反应的化学方程式为
您最近一年使用:0次
2024·广东·一模
8 . 工业合成氨是人类科学技术的一项重大突破,选择高效催化剂实现降能提效是目前研究的重点。回答下列问题:
(1)合成氨反应为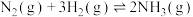
 ,理论上
,理论上___________ (填“高”或“低”,下同)温有利于提高反应速率,___________ 温有利于提高平衡转化率。
(2)合成氨反应在催化作用的化学吸附及初步表面反应历程如下:
①写出 参与化学吸附的反应方程式:
参与化学吸附的反应方程式:___________ 。
②以上历程须克服的最大能垒为___________ eV。
(3)在t℃、压强为0.9MPa的条件下,向一恒压密闭容器中通入氢氮比为3的混合气体,体系中气体的含量与时间变化关系如图所示: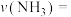
___________  ,该反应的
,该反应的
___________ (用数字表达式表示, 为以分压表示的平衡常数,分压=总压×物质的量分数)。
为以分压表示的平衡常数,分压=总压×物质的量分数)。
②下列叙述能说明该条件下反应达到平衡状态的是___________ (填标号)。
a.氨气的体积分数保持不变 b.容器中氢氮比保持不变
c. 和
和 的平均反应速率之比为1∶2 d.气体密度保持不变
的平均反应速率之比为1∶2 d.气体密度保持不变
③若起始条件相同,在恒容容器中发生反应,则达到平衡时H2的含量符合图中___________ (填“d”“e”“f”或“g”)点。
(1)合成氨反应为
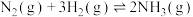
 ,理论上
,理论上(2)合成氨反应在催化作用的化学吸附及初步表面反应历程如下:
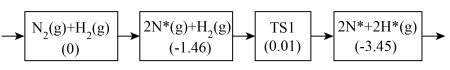
①写出
 参与化学吸附的反应方程式:
参与化学吸附的反应方程式:②以上历程须克服的最大能垒为
(3)在t℃、压强为0.9MPa的条件下,向一恒压密闭容器中通入氢氮比为3的混合气体,体系中气体的含量与时间变化关系如图所示:
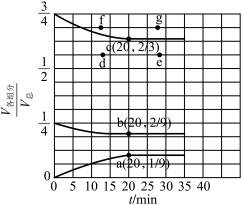
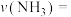
 ,该反应的
,该反应的
 为以分压表示的平衡常数,分压=总压×物质的量分数)。
为以分压表示的平衡常数,分压=总压×物质的量分数)。②下列叙述能说明该条件下反应达到平衡状态的是
a.氨气的体积分数保持不变 b.容器中氢氮比保持不变
c.
 和
和 的平均反应速率之比为1∶2 d.气体密度保持不变
的平均反应速率之比为1∶2 d.气体密度保持不变③若起始条件相同,在恒容容器中发生反应,则达到平衡时H2的含量符合图中
您最近一年使用:0次
名校
解题方法
9 . 根据化学反应速率和化学反应限度的知识回答下列问题:
Ⅰ.某温度时,在2 L容器中发生A、B两种物质间的转化反应,AB物质的量随时间变化的曲线如图所示:___________ 。
(2)反应开始至4 min时,A的平均反应速率为___________ 。
(3)4 min时,反应是否达平衡状态?___________ (填“是”或“否”),8 min时,v正___________ v逆。(填“>”“<”或“=”)
Ⅱ.氢气是合成氨的重要原料,合成氨反应的化学方程式为N2(g)+3H2(g) ⇌2NH3(g),该反应为放热反应,且每生成2 mol NH3,放出92.4 kJ的热量。当合成氨反应达到平衡后,改变某一外界条件(不改变N2、H2和NH3的量),反应速率与时间的关系如图所示。___________ 。
(5)在一定温度下,向一个容积为1 L的容器中通入2 mol氮气和
8 mol氢气及固体催化剂,使之反应。已知平衡时容器内气体的压强为起始时的80%。
①N2的转化率为___________ 。
②反应达到平衡时,放出的热量___________ (填字母,下同)。
A.小于92.4 kJ B.等于92.4 kJ
C.大于92.4 kJ D.可能大于、小于或等于92.4 kJ
(6)若该反应在绝热条件下进行,下列能证明反应已达化学平衡的为___________ 。
A.混合气体的平均相对分子质量
B.体系的温度不变
C.N2、H2、NH3的分子数之比为1:3:2
D.混合气体的密度不变
E.断开3 mol H-H键的同时断开2 mol N-H键
(7)反应达到平衡后,保持其他条件不变,t0时刻升高温度,请在图中画出 改变条件后至达到新平衡时v正、v逆的变化曲线并注明v正、v逆(在答题卡做答)__________
Ⅰ.某温度时,在2 L容器中发生A、B两种物质间的转化反应,AB物质的量随时间变化的曲线如图所示:
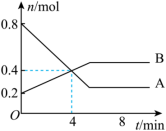
(2)反应开始至4 min时,A的平均反应速率为
(3)4 min时,反应是否达平衡状态?
Ⅱ.氢气是合成氨的重要原料,合成氨反应的化学方程式为N2(g)+3H2(g) ⇌2NH3(g),该反应为放热反应,且每生成2 mol NH3,放出92.4 kJ的热量。当合成氨反应达到平衡后,改变某一外界条件(不改变N2、H2和NH3的量),反应速率与时间的关系如图所示。

(5)在一定温度下,向一个容积为1 L的容器中通入2 mol氮气和
8 mol氢气及固体催化剂,使之反应。已知平衡时容器内气体的压强为起始时的80%。
①N2的转化率为
②反应达到平衡时,放出的热量
A.小于92.4 kJ B.等于92.4 kJ
C.大于92.4 kJ D.可能大于、小于或等于92.4 kJ
(6)若该反应在绝热条件下进行,下列能证明反应已达化学平衡的为
A.混合气体的平均相对分子质量
B.体系的温度不变
C.N2、H2、NH3的分子数之比为1:3:2
D.混合气体的密度不变
E.断开3 mol H-H键的同时断开2 mol N-H键
(7)反应达到平衡后,保持其他条件不变,t0时刻升高温度,请在图中画出 改变条件后至达到新平衡时v正、v逆的变化曲线并注明v正、v逆(在答题卡做答)

您最近一年使用:0次
2024-04-30更新
|
257次组卷
|
2卷引用:名校期中好题汇编-化学反应与能量(非选择题)
名校
解题方法
10 . 将1mol固体A置于体积不变的真空密闭容器中(固体试样体积忽略不计),在恒定温度下使其分解:A(s) 2B(g)+C(g),下列可以判断该反应已达到化学平衡状态的是
2B(g)+C(g),下列可以判断该反应已达到化学平衡状态的是
 2B(g)+C(g),下列可以判断该反应已达到化学平衡状态的是
2B(g)+C(g),下列可以判断该反应已达到化学平衡状态的是| A.物质的浓度:c(B)=2c(C) | B.混合气体 密度保持不变 密度保持不变 |
| C.B的体积分数不变 | D.混合气体的平均摩尔质量保持不变 |
您最近一年使用:0次
2024-04-29更新
|
351次组卷
|
2卷引用:福建省福州九县(区、市)一中(高中)2023-2024学年高一下学期4月期中联考化学试题



