名校
解题方法
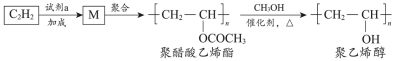
1 . 聚醋酸乙烯酯难溶于水,可用作白乳胶、塑料薄膜和涂料等,用它可得到聚乙烯醇,聚乙烯醇水溶液可用作医用滴眼液。合成路线如下:
已知: (R’、
(R’、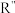 不同的羟基)
不同的羟基)
下列说法不正确 的是

已知:
 (R’、
(R’、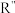 不同的羟基)
不同的羟基)下列说法
| A.试剂a是乙酸 |
| B.通过增加甲醇用量可提高聚乙烯醇的产率 |
| C.由M转化为聚醋酸乙烯酯的过程中发生了缩聚反应 |
| D.由聚醋酸乙烯酯转化为聚乙烯醇过程中还会生成乙酸甲酯 |
您最近一年使用:0次
2 . 我国力争于2030年前完成碳达峰,2060年前实现碳中和。 含量的控制和
含量的控制和 资源利用具有重要的研究价值和现实意义。
资源利用具有重要的研究价值和现实意义。
(1)燃煤烟气中的 捕集可通过如下所示的物质转化实现。
捕集可通过如下所示的物质转化实现。
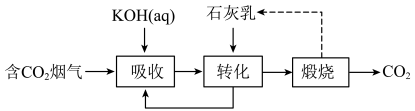
写出
充分 吸收 的化学方程式为
的化学方程式为________________ 。
(2)合成尿素 是利用
是利用 的途径之一。通过两步反应实现,其能量变化示意图所示:
的途径之一。通过两步反应实现,其能量变化示意图所示:
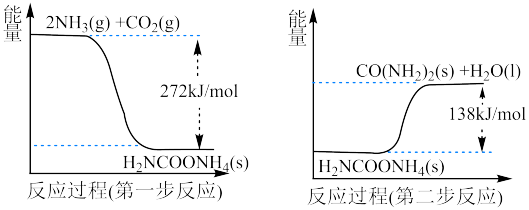
① 与
与 反应生成尿素的热化学方程式为
反应生成尿素的热化学方程式为________________ 。
②工业上合成尿素时,既能加快反应速率,又能提高原料利用率的措施有________ .(填序号)
a.升高温度 b.加入催化剂
c.将尿素及时分离出去 d.增大反应体系的压强
(3)用 充分吸收
充分吸收 后,将溶液进行电解,可实现
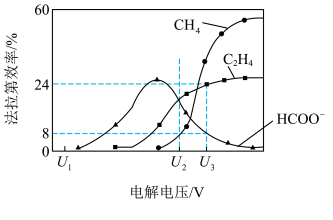
后,将溶液进行电解,可实现 转化为有机物。在相同条件下,恒定通过电解池的电量,电解得到的部分还原产物的
转化为有机物。在相同条件下,恒定通过电解池的电量,电解得到的部分还原产物的法拉第效率 (FE%)随电解电压的变化如图所示。
已知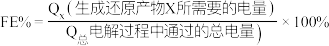
其中,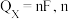 表示电解生成还原产物
表示电解生成还原产物 所转移电子的物质的量,
所转移电子的物质的量, 表示法拉第常数。
表示法拉第常数。
①当电解电压为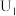 时,电解过程中含碳还原产物的
时,电解过程中含碳还原产物的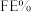 为0,阴极主要还原产物为
为0,阴极主要还原产物为________ (填化学式)。
②当电解电压为 时,阴极生成
时,阴极生成 的电极反应式为
的电极反应式为________________ .
③当电解电压为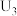 时,电解生成的
时,电解生成的 和
和 的物质的量之比为
的物质的量之比为________ .
 含量的控制和
含量的控制和 资源利用具有重要的研究价值和现实意义。
资源利用具有重要的研究价值和现实意义。(1)燃煤烟气中的
 捕集可通过如下所示的物质转化实现。
捕集可通过如下所示的物质转化实现。
写出

 的化学方程式为
的化学方程式为(2)合成尿素
 是利用
是利用 的途径之一。通过两步反应实现,其能量变化示意图所示:
的途径之一。通过两步反应实现,其能量变化示意图所示:
①
 与
与 反应生成尿素的热化学方程式为
反应生成尿素的热化学方程式为②工业上合成尿素时,既能加快反应速率,又能提高原料利用率的措施有
a.升高温度 b.加入催化剂
c.将尿素及时分离出去 d.增大反应体系的压强
(3)用
 充分吸收
充分吸收 后,将溶液进行电解,可实现
后,将溶液进行电解,可实现 转化为有机物。在相同条件下,恒定通过电解池的电量,电解得到的部分还原产物的
转化为有机物。在相同条件下,恒定通过电解池的电量,电解得到的部分还原产物的
已知
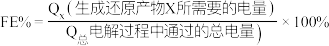
其中,
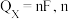 表示电解生成还原产物
表示电解生成还原产物 所转移电子的物质的量,
所转移电子的物质的量, 表示法拉第常数。
表示法拉第常数。①当电解电压为
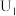 时,电解过程中含碳还原产物的
时,电解过程中含碳还原产物的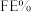 为0,阴极主要还原产物为
为0,阴极主要还原产物为②当电解电压为
 时,阴极生成
时,阴极生成 的电极反应式为
的电极反应式为③当电解电压为
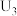 时,电解生成的
时,电解生成的 和
和 的物质的量之比为
的物质的量之比为
您最近一年使用:0次
名校
3 . 以CO2为原料合成甲醇可以减少CO2的排放,实现碳的循环利用。一种Cu/ZnO 催化剂对该反应有良好的催化效果。
I.催化剂的合成
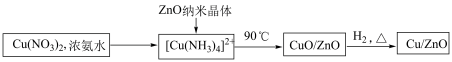
(1)氨水与Cu(NO3)2的反应___________ (填“属于”或“不属于”)氧化还原反应。
(2)补全上述过程中生成CuO 的离子方程式:___________
[Cu(NH3)4]2++H2O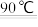 CuO↓+
CuO↓+
Ⅱ.催化剂的性能测试
一定条件下使 CO₂、H₂混合气体通过反应器,检测反应器出口气体的成分及其含量,计算CO2的转化率和CH₃OH的选择性以评价催化剂的性能。
已知:i. 反应器内发生的反应有:
ii. CH₃OH选择性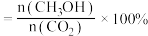
CO2(g)+3H2(g) CH3OH(g)+H2O(g) ΔH=-49.5kJ/mol
CH3OH(g)+H2O(g) ΔH=-49.5kJ/mol
CO2(g)+H2(g) CO(g)+H2O(g) ΔH=+41.2kJ/mol
CO(g)+H2O(g) ΔH=+41.2kJ/mol
(3)220℃时,测得反应器出口气体中全部含碳物质的物质的量之比n(CH3OH):n(CO2):n(CO)=1:7.20:0.11,则该温度下CO2转化率=___________ ×100%(列出计算式)。
(4)其他条件相同时,反应温度对CO2的转化率和 CH3OH的选择性的影响如下图所示:

①由图1可知实验中反应均未达到化学平衡状态的依据是___________
②温度高于260℃时,CO2平衡转化率变化的原因是___________
③温度相同时,CH3OH选择性的实验值略高于其平衡值(见图2),从化学反应速率的角度解释原因:___________ 。
I.催化剂的合成

(1)氨水与Cu(NO3)2的反应
(2)补全上述过程中生成CuO 的离子方程式:
[Cu(NH3)4]2++H2O
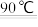 CuO↓+
CuO↓+Ⅱ.催化剂的性能测试
一定条件下使 CO₂、H₂混合气体通过反应器,检测反应器出口气体的成分及其含量,计算CO2的转化率和CH₃OH的选择性以评价催化剂的性能。
已知:i. 反应器内发生的反应有:
ii. CH₃OH选择性
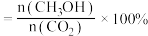
CO2(g)+3H2(g)
 CH3OH(g)+H2O(g) ΔH=-49.5kJ/mol
CH3OH(g)+H2O(g) ΔH=-49.5kJ/molCO2(g)+H2(g)
 CO(g)+H2O(g) ΔH=+41.2kJ/mol
CO(g)+H2O(g) ΔH=+41.2kJ/mol(3)220℃时,测得反应器出口气体中全部含碳物质的物质的量之比n(CH3OH):n(CO2):n(CO)=1:7.20:0.11,则该温度下CO2转化率=
(4)其他条件相同时,反应温度对CO2的转化率和 CH3OH的选择性的影响如下图所示:

①由图1可知实验中反应均未达到化学平衡状态的依据是
②温度高于260℃时,CO2平衡转化率变化的原因是
③温度相同时,CH3OH选择性的实验值略高于其平衡值(见图2),从化学反应速率的角度解释原因:
您最近一年使用:0次
2023-10-24更新
|
240次组卷
|
2卷引用:北京市清华大学附属中学2023-2024学年高三上学期10月统练(四)化学试题
名校
解题方法
4 . H2O2是一种重要的化学品,其合成方法不断发展。
(1)早期制备方法:
①I为分解反应,产物除 BaO、O2外,还有一种红棕色气体。该反应的化学方程式是_______ 。
②II为可逆反应,促进该反应正向进行的措施是_______ 。
③III中生成H2O2,反应的化学方程式是_______ 。
④减压能够降低蒸馏温度,从H2O2的化学性质角度说明V中采用减压蒸馏的原因:_______ 。
(2)电化学制备方法
已知反应2H2O2=2H2O+O2↑能自发进行,反向不能自发进行,通过电解可以实现由H2O和O2为原料制备H2O2,下图为制备装置示意图。

①a极的电极反应式是_______ 。
②下列说法正确的是_______ 。
A.该装置可以实现电能转化为化学能
B.电极b连接电源负极
C.该方法相较于早期剂备方法具有原料廉价,对环境友好等优点
(1)早期制备方法:

①I为分解反应,产物除 BaO、O2外,还有一种红棕色气体。该反应的化学方程式是
②II为可逆反应,促进该反应正向进行的措施是
③III中生成H2O2,反应的化学方程式是
④减压能够降低蒸馏温度,从H2O2的化学性质角度说明V中采用减压蒸馏的原因:
(2)电化学制备方法
已知反应2H2O2=2H2O+O2↑能自发进行,反向不能自发进行,通过电解可以实现由H2O和O2为原料制备H2O2,下图为制备装置示意图。

①a极的电极反应式是
②下列说法正确的是
A.该装置可以实现电能转化为化学能
B.电极b连接电源负极
C.该方法相较于早期剂备方法具有原料廉价,对环境友好等优点
您最近一年使用:0次
2021-03-18更新
|
143次组卷
|
3卷引用:北京市第四十三中学2021届高三上学期1月月考化学试题
名校
解题方法
5 . 将CO2转化成C2H4可以变废为宝、改善环境。以CO2、C2H6为原料合成C2H4涉及的主要反应如下:
Ⅰ.CO2(g) + C2H6(g) C2H4(g)+H2O(g)+CO(g) ∆H = +177 kJ·mol-1(主反应)
C2H4(g)+H2O(g)+CO(g) ∆H = +177 kJ·mol-1(主反应)
Ⅱ.C2H6(g) CH4(g)+H2(g)+C(s) ∆H = +9kJ·mol-1 (副反应)
CH4(g)+H2(g)+C(s) ∆H = +9kJ·mol-1 (副反应)
(1)反应I的反应历程可分为如下两步:
i.C2H6(g) C2H4(g)+H2(g) ∆H1 = +136 kJ·mol-1(反应速率较快)
C2H4(g)+H2(g) ∆H1 = +136 kJ·mol-1(反应速率较快)
ii.H2(g)+CO2(g) H2O(g)+CO(g) ∆H2 (反应速率较慢)
H2O(g)+CO(g) ∆H2 (反应速率较慢)
①∆H2 =______ kJ·mol-1
②相比于提高c(C2H6),提高c(CO2) 对反应I速率影响更大,原因是______ 。
(2)0.1 MPa时向密闭容器中充入CO2和C2H6,温度对催化剂K-Fe-Mn/Si-2 性能的影响如图所示:
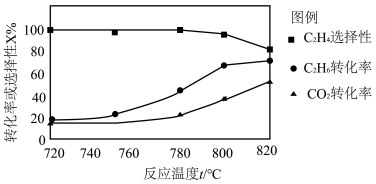
① 工业生产中反应I选择800℃,原因是______ 。
② 800℃时,不同的CO2和C2H6体积比对反应影响的实验数据如下表:
a. 随 增大, CO2转化率将
增大, CO2转化率将______ (填“增大”或“减小”)。
b. 解释 对产物中C2H4的质量分数影响的原因:
对产物中C2H4的质量分数影响的原因:______ 。
(3)我国科学家使用电化学的方法(装置如图)

用C2H6 和CO2合成了C2H4。
①N是电源的______ 极。
②阳极电极反应式是______ 。
Ⅰ.CO2(g) + C2H6(g)
 C2H4(g)+H2O(g)+CO(g) ∆H = +177 kJ·mol-1(主反应)
C2H4(g)+H2O(g)+CO(g) ∆H = +177 kJ·mol-1(主反应)Ⅱ.C2H6(g)
 CH4(g)+H2(g)+C(s) ∆H = +9kJ·mol-1 (副反应)
CH4(g)+H2(g)+C(s) ∆H = +9kJ·mol-1 (副反应)(1)反应I的反应历程可分为如下两步:
i.C2H6(g)
 C2H4(g)+H2(g) ∆H1 = +136 kJ·mol-1(反应速率较快)
C2H4(g)+H2(g) ∆H1 = +136 kJ·mol-1(反应速率较快)ii.H2(g)+CO2(g)
 H2O(g)+CO(g) ∆H2 (反应速率较慢)
H2O(g)+CO(g) ∆H2 (反应速率较慢)①∆H2 =
②相比于提高c(C2H6),提高c(CO2) 对反应I速率影响更大,原因是
(2)0.1 MPa时向密闭容器中充入CO2和C2H6,温度对催化剂K-Fe-Mn/Si-2 性能的影响如图所示:

① 工业生产中反应I选择800℃,原因是
② 800℃时,不同的CO2和C2H6体积比对反应影响的实验数据如下表:
 | 平衡时有机产物的质量分数 | |
| CH4 | C2H4 | |
| 15.0/15.0 | 7.7 | 92.3 |
| 20.0/10.0 | 6.4 | 93.6 |
| 24.0 /6.0 | 4.5 | 95.5 |
 增大, CO2转化率将
增大, CO2转化率将b. 解释
 对产物中C2H4的质量分数影响的原因:
对产物中C2H4的质量分数影响的原因:(3)我国科学家使用电化学的方法(装置如图)

用C2H6 和CO2合成了C2H4。
①N是电源的
②阳极电极反应式是
您最近一年使用:0次
2020-11-09更新
|
274次组卷
|
4卷引用:北京市东直门中学2023-2024学年高三上学期综合(三)阶段性考试化学试题
名校
解题方法
6 . 氨是合成硝酸、铵盐和氮肥的基本原料,回答下列问题:
(1)NH3的电子式______ 。
(2)氯化铵水溶液显酸性,其原因为______ (用离子方程式表示),0.1mol/L的氨水中加入少量的NH4Cl固体,溶液的pH______ (填“升高”或“降低”);若加入少量的明矾固体后,请尝试从平衡移动的角度解释溶液中NH4+浓度的变化原因______ 。
(3)硝酸铵加热分解可得到N2O(g)和H2O(g),250℃时,硝酸铵在密闭容器中分解达到平衡,该温度下反应的平衡常数表达式为______ ;若有1mol硝酸铵完全分解,转移的电子数为______ mol。
(4)3H2(g)+N2(g)⇌2NH3(g)△H=-92kJ/mol,若反应放出9.2kJ 热量,则参加反应的氢气分子数目为______ 。
(1)NH3的电子式
(2)氯化铵水溶液显酸性,其原因为
(3)硝酸铵加热分解可得到N2O(g)和H2O(g),250℃时,硝酸铵在密闭容器中分解达到平衡,该温度下反应的平衡常数表达式为
(4)3H2(g)+N2(g)⇌2NH3(g)△H=-92kJ/mol,若反应放出9.2kJ 热量,则参加反应的氢气分子数目为
您最近一年使用:0次
2020-04-27更新
|
110次组卷
|
3卷引用:北京市顺义牛栏山第一中学2020届高三下学期模拟考试化学试题
名校
7 . 工业上用CO和H2合成CH3OH:CO(g)+2H2(g) CH3OH(g)。反应的平衡常数如下表:
CH3OH(g)。反应的平衡常数如下表:
下列说法正确的是
 CH3OH(g)。反应的平衡常数如下表:
CH3OH(g)。反应的平衡常数如下表:| 温度/℃ | 0 | 100 | 200 | 300 | 400 |
| 平衡常数 | 667 | 13 | 1.9x10-2 | 2.4×10-4 | 1×10-5 |
下列说法正确的是
| A.该反应的△H>0 |
| B.加压、增大H2浓度和加入催化剂都能提高CO的转化率 |
| C.工业上采用5×103 kPa和250℃的条件,其原因是原料气的转化率高 |
| D.t℃时,向2L密闭容器中投入0.2 mol CO和0.4 mol H2,平衡时CO转化率为50%,则该温度时反应的平衡常数的数值为100 |
您最近一年使用:0次
2018-12-15更新
|
419次组卷
|
4卷引用:北京市北京师范大学附属中学2022-2023 学年高三上学期月考2化学试题
北京市北京师范大学附属中学2022-2023 学年高三上学期月考2化学试题【全国百强校】北京市北京四中2019届高三上学期期中考试化学试题(已下线)北京市第四中学2021-2022学年高三上学期期中考试化学试题甘肃省民乐县第一中学2021-2022学年上学期高三第二次诊断(12月)考试化学试题



