名校
1 . 二甲醚( )作为一种重要的化工原料和环保产品,在化工和医药行业中被广泛用作甲基化剂、气雾剂、制冷剂和各种有机合成原料。回答下列问题:
)作为一种重要的化工原料和环保产品,在化工和医药行业中被广泛用作甲基化剂、气雾剂、制冷剂和各种有机合成原料。回答下列问题:
(1)合成气(CO、 )一步合成二甲醚的反应为:
)一步合成二甲醚的反应为:

已知:
①根据上述数据计算
______  。
。
②在容器为恒温恒压 时,充入2molCO和4mol
时,充入2molCO和4mol ,达到平衡时
,达到平衡时 的转化率为50%,该反应的平衡常数
的转化率为50%,该反应的平衡常数
______ 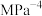 (用平衡分压代替平衡浓度,分压=总压×物质的量分数)。
(用平衡分压代替平衡浓度,分压=总压×物质的量分数)。
(2)有研究者在催化剂(含Cu—Zn—Al—O和 )、压强为5.0MPa的条件下,由
)、压强为5.0MPa的条件下,由 和CO直接制备二甲醚,结果如图1所示。260℃或270℃时,
和CO直接制备二甲醚,结果如图1所示。260℃或270℃时, 产率与CO转化率相差较大,合理的解释是
产率与CO转化率相差较大,合理的解释是______ 。图中最高产率对应的温度为290℃,低于290℃时,二甲醚的产率______ (填“是”或“不是”)对应温度下的平衡产率,判断理由是______ 。
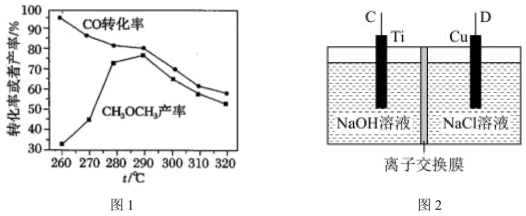
(3)若用二甲醚- 燃料电池作为电源,利用电解法制备纳米
燃料电池作为电源,利用电解法制备纳米 ,其装置如图2所示。装置中D电极应连接二甲醚燃料电池中通
,其装置如图2所示。装置中D电极应连接二甲醚燃料电池中通______ (“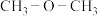 ”或“
”或“ ”)的一极,该电解池中离子交换膜为
”)的一极,该电解池中离子交换膜为______ 离子交换膜(填“阴”或阳)。该电解池的阳极反应式为______ 。
 )作为一种重要的化工原料和环保产品,在化工和医药行业中被广泛用作甲基化剂、气雾剂、制冷剂和各种有机合成原料。回答下列问题:
)作为一种重要的化工原料和环保产品,在化工和医药行业中被广泛用作甲基化剂、气雾剂、制冷剂和各种有机合成原料。回答下列问题:(1)合成气(CO、
 )一步合成二甲醚的反应为:
)一步合成二甲醚的反应为:

已知:
化学键 | H—H | H—O | C—H | C—O | C=O |
键能( | 436 | 463 | 413 | 343 | 1076 |

 。
。②在容器为恒温恒压
 时,充入2molCO和4mol
时,充入2molCO和4mol ,达到平衡时
,达到平衡时 的转化率为50%,该反应的平衡常数
的转化率为50%,该反应的平衡常数
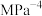 (用平衡分压代替平衡浓度,分压=总压×物质的量分数)。
(用平衡分压代替平衡浓度,分压=总压×物质的量分数)。(2)有研究者在催化剂(含Cu—Zn—Al—O和
 )、压强为5.0MPa的条件下,由
)、压强为5.0MPa的条件下,由 和CO直接制备二甲醚,结果如图1所示。260℃或270℃时,
和CO直接制备二甲醚,结果如图1所示。260℃或270℃时, 产率与CO转化率相差较大,合理的解释是
产率与CO转化率相差较大,合理的解释是
(3)若用二甲醚-
 燃料电池作为电源,利用电解法制备纳米
燃料电池作为电源,利用电解法制备纳米 ,其装置如图2所示。装置中D电极应连接二甲醚燃料电池中通
,其装置如图2所示。装置中D电极应连接二甲醚燃料电池中通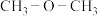 ”或“
”或“ ”)的一极,该电解池中离子交换膜为
”)的一极,该电解池中离子交换膜为
您最近一年使用:0次
名校
2 . 氨在国民经济中占有重要地位。
(1)合成氨工业中,合成塔中每产生2 mol NH3,放出92.2kJ热量。
①工业合成氨的热化学方程式是___________ 。
②若起始时向容器内放入2 mol N2和6 mol H2,达平衡时放出的热量为Q,则Q(填“>”“<”或“=”)___________ 184.4kJ。
③已知:

1 mol N-H键断裂吸收的能量等于___________ kJ。
④理论上,为了增大平衡时H2的转化率,可采取的措施是___________ (填序号)。
a. 增大压强 b. 使用合适的催化剂
c. 升高温度 d. 及时分离出产物中的NH3
(2)原料气H2可通过反应CH4(g)+H2O(g) CO(g)+3H2(g)获取,已知该反应中,当初始混合气中的
CO(g)+3H2(g)获取,已知该反应中,当初始混合气中的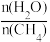 恒定时,温度、压强对平衡混合气中CH4含量的影响如下图所示:
恒定时,温度、压强对平衡混合气中CH4含量的影响如下图所示:
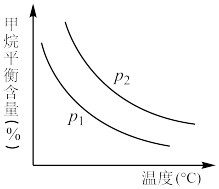
上图中两条曲线表示的压强的关系是:p1___________ p2(填“>”“=”或“<”)。
(3)原料气H2还可通过反应CO(g)+H2O(g) CO2(g)+H2(g)获取。
CO2(g)+H2(g)获取。
①T℃时,向容积固定为5L的容器中充入1 mol水蒸气和1 mol CO,反应达平衡后,测得CO的浓度为0.08mol•L-1,则该温度下反应的平衡常数K为___________ 。
②保持温度仍为T℃,改变水蒸气和CO的初始物质的量之比,充入容器进行反应,下列描述能够说明体系处于平衡状态的是___________ (填序号)。
a. 混合气体的平均相对分子质量不随时间改变
b. 混合气体的密度不随时间改变
c. 单位时间内生成a mol CO2的同时消耗a mol H2
d. 混合气中n(CO):n(H2O):n(CO2):n(H2)=1:16:6:6
(4)工业上以NH3和CO2为原料合成尿素[CO(NH2)2],反应的化学方程式为2NH3(g)+CO2(g) CO(NH2)2(1)+H2O(1),该反应的平衡常数和温度关系如下:
CO(NH2)2(1)+H2O(1),该反应的平衡常数和温度关系如下:
①焓变△H(填“>”“<”或“=”)___________ 0。
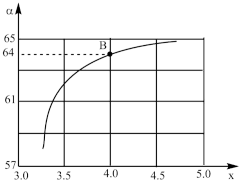
②在一定温度和压强下,若原料气中的NH3和CO2的物质的量之比(氨碳比) =x,下图是氨碳比(x)与CO2平衡转化率(
=x,下图是氨碳比(x)与CO2平衡转化率( :%)的关系。下图中的B点处,NH3的平衡转化率为
:%)的关系。下图中的B点处,NH3的平衡转化率为___________ 。
(1)合成氨工业中,合成塔中每产生2 mol NH3,放出92.2kJ热量。
①工业合成氨的热化学方程式是
②若起始时向容器内放入2 mol N2和6 mol H2,达平衡时放出的热量为Q,则Q(填“>”“<”或“=”)
③已知:

1 mol N-H键断裂吸收的能量等于
④理论上,为了增大平衡时H2的转化率,可采取的措施是
a. 增大压强 b. 使用合适的催化剂
c. 升高温度 d. 及时分离出产物中的NH3
(2)原料气H2可通过反应CH4(g)+H2O(g)
 CO(g)+3H2(g)获取,已知该反应中,当初始混合气中的
CO(g)+3H2(g)获取,已知该反应中,当初始混合气中的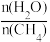 恒定时,温度、压强对平衡混合气中CH4含量的影响如下图所示:
恒定时,温度、压强对平衡混合气中CH4含量的影响如下图所示:
上图中两条曲线表示的压强的关系是:p1
(3)原料气H2还可通过反应CO(g)+H2O(g)
 CO2(g)+H2(g)获取。
CO2(g)+H2(g)获取。①T℃时,向容积固定为5L的容器中充入1 mol水蒸气和1 mol CO,反应达平衡后,测得CO的浓度为0.08mol•L-1,则该温度下反应的平衡常数K为
②保持温度仍为T℃,改变水蒸气和CO的初始物质的量之比,充入容器进行反应,下列描述能够说明体系处于平衡状态的是
a. 混合气体的平均相对分子质量不随时间改变
b. 混合气体的密度不随时间改变
c. 单位时间内生成a mol CO2的同时消耗a mol H2
d. 混合气中n(CO):n(H2O):n(CO2):n(H2)=1:16:6:6
(4)工业上以NH3和CO2为原料合成尿素[CO(NH2)2],反应的化学方程式为2NH3(g)+CO2(g)
 CO(NH2)2(1)+H2O(1),该反应的平衡常数和温度关系如下:
CO(NH2)2(1)+H2O(1),该反应的平衡常数和温度关系如下:| T/℃ | 165 | 175 | 185 | 195 |
| K | 111.9 | 74.1 | 50.6 | 34.8 |
②在一定温度和压强下,若原料气中的NH3和CO2的物质的量之比(氨碳比)
 =x,下图是氨碳比(x)与CO2平衡转化率(
=x,下图是氨碳比(x)与CO2平衡转化率( :%)的关系。下图中的B点处,NH3的平衡转化率为
:%)的关系。下图中的B点处,NH3的平衡转化率为
您最近一年使用:0次
2022-01-02更新
|
270次组卷
|
3卷引用:吉林省四平市第一高级中学2023-2024学年高二上学期第二次月考化学试卷
3 . CO2是主要的温室气体,以CO2和H2为原料制造更高价值的化学产品是用来缓解温室效应的研究方向,回答下列问题:
(1)工业上常用CO2和H2为原料合成甲醇(CH3OH),过程中发生如下两个反应:
反应I:CO2(g)+3H2(g) CH3OH(g)+H2O(g) △H1=—51kJ·mol-1
CH3OH(g)+H2O(g) △H1=—51kJ·mol-1
反应II:CO2(g)+H2(g) CO(g)+H2O(g) △H2=+41.17kJ·mol-1
CO(g)+H2O(g) △H2=+41.17kJ·mol-1
①已知:键能指断开1mol气态键所吸收的能量或形成1mol气态键所释放的能量。几种化学键的键能如下表所示:
则a=___________ kJ·mol-1;
②若反应II逆反应活化能Ea(逆)为124kJ·mol-1,则该反应的Ea(正)活化能为___________ kJ· mol-1。
(2)向2L容器中充入1molCO2和2molH2,若只发生反应I,测得反应在不同压强、不同温度下,平衡混合物中CH3OH体积分数如图1所示,测得反应时逆反应速率与容器中c(CH3OH)关系如图II所示:
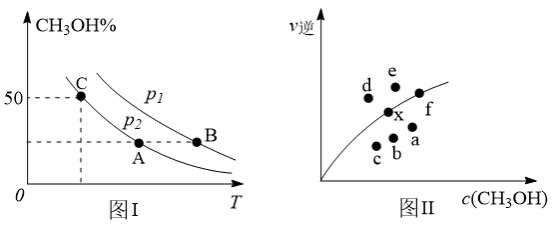
①图I中A、B、C三点对应的平衡常数K(A)、K(B)、K(C)由大到小的顺序排列为___________ ,图I中C点CO2的转化率为___________ 。
②图II中当x点平衡体系升高至某一温度时,反应可重新达平衡状态,新平衡点可能是___________ 。
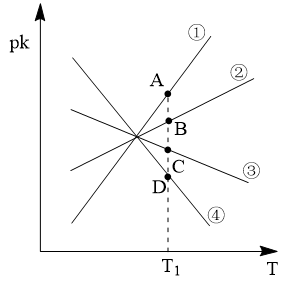
(3)若反应IIICO(g)+H2O(g) CO2(g)+H2(g)的正、逆反应速率分别可表示为v正=k正c(CO)·c(H2O)、v逆=k逆c(CO2)·c(H2),k正、k逆分别为正、逆反应速率常数,c为物质的量浓度。则下图(pk=-lgk:T表示温度)所示①、②、③、④四条斜线中,能表示以pk正随T变化关系的是斜线
CO2(g)+H2(g)的正、逆反应速率分别可表示为v正=k正c(CO)·c(H2O)、v逆=k逆c(CO2)·c(H2),k正、k逆分别为正、逆反应速率常数,c为物质的量浓度。则下图(pk=-lgk:T表示温度)所示①、②、③、④四条斜线中,能表示以pk正随T变化关系的是斜线___________ ,能表示pk逆随T变化关系的是斜线___________ ,图中A、B、C、D点的纵坐标分别为a+3、a+1、a-1、a-3,则温度T1时化学平衡常数K=___________ mol-1·L。
(1)工业上常用CO2和H2为原料合成甲醇(CH3OH),过程中发生如下两个反应:
反应I:CO2(g)+3H2(g)
 CH3OH(g)+H2O(g) △H1=—51kJ·mol-1
CH3OH(g)+H2O(g) △H1=—51kJ·mol-1反应II:CO2(g)+H2(g)
 CO(g)+H2O(g) △H2=+41.17kJ·mol-1
CO(g)+H2O(g) △H2=+41.17kJ·mol-1①已知:键能指断开1mol气态键所吸收的能量或形成1mol气态键所释放的能量。几种化学键的键能如下表所示:
| 化学键 | C-H | C-O | H-O(H2O中) | H-O(CH3OH中) | H-H | C=O |
| 键能/kJ· mol-1 | 406 | 351 | 462.5 | 465 | 436 | a |
②若反应II逆反应活化能Ea(逆)为124kJ·mol-1,则该反应的Ea(正)活化能为
(2)向2L容器中充入1molCO2和2molH2,若只发生反应I,测得反应在不同压强、不同温度下,平衡混合物中CH3OH体积分数如图1所示,测得反应时逆反应速率与容器中c(CH3OH)关系如图II所示:

①图I中A、B、C三点对应的平衡常数K(A)、K(B)、K(C)由大到小的顺序排列为
②图II中当x点平衡体系升高至某一温度时,反应可重新达平衡状态,新平衡点可能是
(3)若反应IIICO(g)+H2O(g)
 CO2(g)+H2(g)的正、逆反应速率分别可表示为v正=k正c(CO)·c(H2O)、v逆=k逆c(CO2)·c(H2),k正、k逆分别为正、逆反应速率常数,c为物质的量浓度。则下图(pk=-lgk:T表示温度)所示①、②、③、④四条斜线中,能表示以pk正随T变化关系的是斜线
CO2(g)+H2(g)的正、逆反应速率分别可表示为v正=k正c(CO)·c(H2O)、v逆=k逆c(CO2)·c(H2),k正、k逆分别为正、逆反应速率常数,c为物质的量浓度。则下图(pk=-lgk:T表示温度)所示①、②、③、④四条斜线中,能表示以pk正随T变化关系的是斜线
您最近一年使用:0次
2020-12-30更新
|
649次组卷
|
5卷引用:吉林省松原市实验高级中学2021届高三5月月考化学试题
吉林省松原市实验高级中学2021届高三5月月考化学试题山东省2021届高三12月大联考化学试题福建省福州市第三中学2021届高三下学期第八次质量检测化学试题(已下线)练习6 化学平衡(一)-2020-2021学年【补习教材·寒假作业】高二化学(人教版)(已下线)大题07 化学反应原理综合题(二)-【考前抓大题】备战2021年高考化学(全国通用)
名校
解题方法
4 . 冬季是雾霾天气高发的季节,其中汽车尾气和燃煤尾气是造成雾霾的原因之一。
(1)汽车尾气净化的主要原理为2NO(g)+2CO(g) 2CO2(g)+N2(g)
2CO2(g)+N2(g)
①在一定条件下,在一个容积固定为 2L的密闭容器中充入 0.8molNO和1.20mol CO,开始反应至 3min时测得 CO 的转化率为20%,则用 N2表示的平均反应速率为 v(N2)=_______ 。
②对于气相反应,用某组分(B)的平衡压强 (pB)代替物质的量浓度(cB)也可以表示平衡常数(记作Kp),则该反应平衡常数的表达式Kp=_______ 。
③在某一绝热,恒容的密闭容器中充入一定量的NO、CO 发生上述反应,测得正反应的速率随时间变化的曲线如图所示(已知 t2~t1=t3~t2)。则下列说法不正确的是_______ 。(填编号)
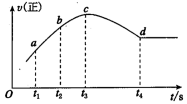
A.反应在 c 点未达到平衡状态 B.反应速率 a 点小于 b 点
C.反应物浓度 a 点大于 b 点 D.NO 的转化率 t1~t2=t2~t3
(2)使用甲醇汽油能减少汽车尾气对环境的污染,某化工厂用水煤气为原料合成甲醇,恒温条件下,在 体积可变的密闭容器中发生反应:CO(g)+2H2(g) CH3OH(g),到达平衡时,测得 CO、H2、 CH3OH 分别为 1mol 、1mol 、1mol,容器的体积为 3L,现往容器中继续通入 3molCO ,此时v(正)
CH3OH(g),到达平衡时,测得 CO、H2、 CH3OH 分别为 1mol 、1mol 、1mol,容器的体积为 3L,现往容器中继续通入 3molCO ,此时v(正)_______ v(逆)(填‘‘>”、“<’’或“=”)。
(3)二甲醚也是清洁能源,用合成气在催化剂存在下制备二甲醚的反应原理为:2CO(g)+4H2(g) CH3OCH3(g)+H2O(g)
CH3OCH3(g)+H2O(g)
已知一定条件下,该反应中CO的平衡转化率随温度、投料比 的变化曲线如图:
的变化曲线如图:

①a、b、c 按从大到小的顺序排序为_______ 。
②某温度下,将 2.0molCO(g)和 4.0mol H2(g)充入容积为 2L的密闭容器中,反应到达平衡时,改变压强和温度,平衡体系中CH3OCH3(g)的物质的量分数变化情况如图所示,关于温度和压强的 关系判断正确的是_______ ;
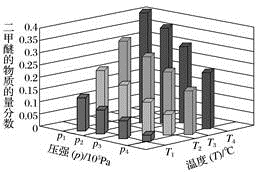
A.p3>p2,T3>T2 B.p2>p3,T1>T3 C.p3>p4,T4>T2 D.p1>p4,T2>T3
③在恒容密闭容器里按体积比为1∶2 充入一氧化碳和氢气,一定条件下反应达到平衡状态。当改变反应 的某一个条件后,下列变化能说明平衡一定向逆反应方向移动的是_______ 。
A.正反应速率先增大后减小 B.逆反应速率先增大后减小
C.化学平衡常数 K 值增大 D.反应物的体积百分含量增大
E.混合气体的密度减小 F.氢气的转化率减小
(1)汽车尾气净化的主要原理为2NO(g)+2CO(g)
 2CO2(g)+N2(g)
2CO2(g)+N2(g)①在一定条件下,在一个容积固定为 2L的密闭容器中充入 0.8molNO和1.20mol CO,开始反应至 3min时测得 CO 的转化率为20%,则用 N2表示的平均反应速率为 v(N2)=
②对于气相反应,用某组分(B)的平衡压强 (pB)代替物质的量浓度(cB)也可以表示平衡常数(记作Kp),则该反应平衡常数的表达式Kp=
③在某一绝热,恒容的密闭容器中充入一定量的NO、CO 发生上述反应,测得正反应的速率随时间变化的曲线如图所示(已知 t2~t1=t3~t2)。则下列说法不正确的是

A.反应在 c 点未达到平衡状态 B.反应速率 a 点小于 b 点
C.反应物浓度 a 点大于 b 点 D.NO 的转化率 t1~t2=t2~t3
(2)使用甲醇汽油能减少汽车尾气对环境的污染,某化工厂用水煤气为原料合成甲醇,恒温条件下,在 体积可变的密闭容器中发生反应:CO(g)+2H2(g)
 CH3OH(g),到达平衡时,测得 CO、H2、 CH3OH 分别为 1mol 、1mol 、1mol,容器的体积为 3L,现往容器中继续通入 3molCO ,此时v(正)
CH3OH(g),到达平衡时,测得 CO、H2、 CH3OH 分别为 1mol 、1mol 、1mol,容器的体积为 3L,现往容器中继续通入 3molCO ,此时v(正)(3)二甲醚也是清洁能源,用合成气在催化剂存在下制备二甲醚的反应原理为:2CO(g)+4H2(g)
 CH3OCH3(g)+H2O(g)
CH3OCH3(g)+H2O(g)已知一定条件下,该反应中CO的平衡转化率随温度、投料比
 的变化曲线如图:
的变化曲线如图:
①a、b、c 按从大到小的顺序排序为
②某温度下,将 2.0molCO(g)和 4.0mol H2(g)充入容积为 2L的密闭容器中,反应到达平衡时,改变压强和温度,平衡体系中CH3OCH3(g)的物质的量分数变化情况如图所示,关于温度和压强的 关系判断正确的是

A.p3>p2,T3>T2 B.p2>p3,T1>T3 C.p3>p4,T4>T2 D.p1>p4,T2>T3
③在恒容密闭容器里按体积比为1∶2 充入一氧化碳和氢气,一定条件下反应达到平衡状态。当改变反应 的某一个条件后,下列变化能说明平衡一定向逆反应方向移动的是
A.正反应速率先增大后减小 B.逆反应速率先增大后减小
C.化学平衡常数 K 值增大 D.反应物的体积百分含量增大
E.混合气体的密度减小 F.氢气的转化率减小
您最近一年使用:0次
2021-03-08更新
|
415次组卷
|
2卷引用:吉林省长春市十一高中2021-2022学年高二上学期第一学程考试化学试题
解题方法
5 . 一碳化学的研究对象是分子中只含一个碳原子的化合物,如一氧化碳、二氧化碳、甲烷、甲醇等。在以石油、天然气为基本原料的化学工业里,甲烷是一碳化学的起点。在以煤炭为基本原料的化学工业里,一氧化碳是一碳化学的出发点。一碳化学研究是从这两种原料出发,生产其他化工原料和产品的方法。请回答下列问题:
(1)已知:氧气中O=O键的键能为497 kJ·mol-1,二氧化碳中C=O键的键能为745 kJ·mol-1。
①2CO(g) +O2(g)=2CO2(g) ΔH1=-566 kJ·mol-1
②H2O(g) +CO(g)=H2(g) +CO2(g) ΔH2
③2CH3OH(g)+3O2(g)=2CO2(g)+4H2O(g) ΔH3=-1320 kJ·mol-1
④CO(g)+2H2(g) CH3OH(g) ΔH4=-107 kJ·mol-1
CH3OH(g) ΔH4=-107 kJ·mol-1
则使1molCO(g)完全分解成原子所需要的能量至少为___________ kJ,ΔH2=___________ kJ·mol-1。
(2)一定条件下,将n(CO):n(H2)=1:2的混合气体充入恒温恒容的密闭容器中,发生反应CO(g)+2H2(g) CH3OH(g)。
CH3OH(g)。
①则下列叙述能说明反应达到化学平衡状态的是___________ (填标号)。
A.混合气体的密度不再随时间的变化而变化
B.混合气体的平均摩尔质量不再随时间的变化而变化
C.CO、H2的物质的量浓度之比为1:2,且不再随时间的变化而变化
D.若将容器改为绝热恒容容器,体系温度不随时间变化而变化
②下列措施既能提高H2的转化率又能加快反应速率的是___________ (填标号)。
A.升高温度 B.使用高效催化剂 C.再通入一定量的CO
(3)通常合成甲醇的主要反应为CO(g)+2H2(g) CH3OH(g), 在容积为1 L的恒容密闭容器中通入1 mol CO和2 mol H2,平衡时测得混合气体中CH3OH的物质的量分数[φ(CH3OH)]与温度(T)、压强(p)之间的关系如图所示。
CH3OH(g), 在容积为1 L的恒容密闭容器中通入1 mol CO和2 mol H2,平衡时测得混合气体中CH3OH的物质的量分数[φ(CH3OH)]与温度(T)、压强(p)之间的关系如图所示。
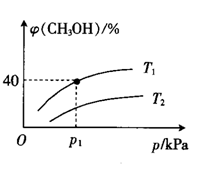
①温度为Tl和T2时对应的平衡常数分别为K1、K2,则K1___________ (填“>”、“<”或“=”)K2;温度为T1、压强为p1 kPa时,CH3OH的平衡产率为___________ (保留四位有效数字),该反应的平衡常数K=___________ 。
②若在温度为T1、压强为p1 kPa的条件下向上述容器中加入1 mol CO、2 mol H2、1 mol CH3OH,则反应开始时v正(CO)___________ (填“>”、“<”、 “=”或“无法确定”)v逆(CO)。
(4)工业上常用氨水吸收含碳燃料燃烧中产生的温室气体CO2,其产物之一是NH4HCO3.已知常温下碳酸的电离常数Ka1=4.4 ×10-7、Ka2=4.7 ×10-11,NH3·H2O的电离常数Kb=1.8 × 10-5,则所得的NH4HCO3溶液中c(NH )
)___________ (填“>”、“<”或“=”)c(HCO )。
)。
(1)已知:氧气中O=O键的键能为497 kJ·mol-1,二氧化碳中C=O键的键能为745 kJ·mol-1。
①2CO(g) +O2(g)=2CO2(g) ΔH1=-566 kJ·mol-1
②H2O(g) +CO(g)=H2(g) +CO2(g) ΔH2
③2CH3OH(g)+3O2(g)=2CO2(g)+4H2O(g) ΔH3=-1320 kJ·mol-1
④CO(g)+2H2(g)
 CH3OH(g) ΔH4=-107 kJ·mol-1
CH3OH(g) ΔH4=-107 kJ·mol-1则使1molCO(g)完全分解成原子所需要的能量至少为
(2)一定条件下,将n(CO):n(H2)=1:2的混合气体充入恒温恒容的密闭容器中,发生反应CO(g)+2H2(g)
 CH3OH(g)。
CH3OH(g)。①则下列叙述能说明反应达到化学平衡状态的是
A.混合气体的密度不再随时间的变化而变化
B.混合气体的平均摩尔质量不再随时间的变化而变化
C.CO、H2的物质的量浓度之比为1:2,且不再随时间的变化而变化
D.若将容器改为绝热恒容容器,体系温度不随时间变化而变化
②下列措施既能提高H2的转化率又能加快反应速率的是
A.升高温度 B.使用高效催化剂 C.再通入一定量的CO
(3)通常合成甲醇的主要反应为CO(g)+2H2(g)
 CH3OH(g), 在容积为1 L的恒容密闭容器中通入1 mol CO和2 mol H2,平衡时测得混合气体中CH3OH的物质的量分数[φ(CH3OH)]与温度(T)、压强(p)之间的关系如图所示。
CH3OH(g), 在容积为1 L的恒容密闭容器中通入1 mol CO和2 mol H2,平衡时测得混合气体中CH3OH的物质的量分数[φ(CH3OH)]与温度(T)、压强(p)之间的关系如图所示。
①温度为Tl和T2时对应的平衡常数分别为K1、K2,则K1
②若在温度为T1、压强为p1 kPa的条件下向上述容器中加入1 mol CO、2 mol H2、1 mol CH3OH,则反应开始时v正(CO)
(4)工业上常用氨水吸收含碳燃料燃烧中产生的温室气体CO2,其产物之一是NH4HCO3.已知常温下碳酸的电离常数Ka1=4.4 ×10-7、Ka2=4.7 ×10-11,NH3·H2O的电离常数Kb=1.8 × 10-5,则所得的NH4HCO3溶液中c(NH
 )
) )。
)。
您最近一年使用:0次
6 . CO2 和CH4是常见的化合物,同时也是常用的化工原料。
Ⅰ.以CO2与NH3为原料可以合成尿素[CO(NH2)2]。合成尿素的反应为2NH3(g) + CO2(g) CO(NH2)2(s) + H2O(g)。
CO(NH2)2(s) + H2O(g)。
(1)在不同温度及不同y值下合成尿素,达到平衡时,氨气转化率变化情况如图所示。
①该反应的ΔH_____ 0(填“>” 或、“<” ),该反应自发进行的条件是_______________ (填“低温”“高温”或“任意温度”) 若y表示反应开始时的氨碳比[ ],则y1
],则y1________ y2。(填“>”、“<”或“=”);
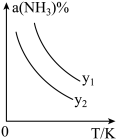
(2)t℃时,若向容积固定的密闭容器中加入一定量的 NH3和CO2合成尿素,下列叙述能说明此反应达到平衡状态的是________ (填字母)。
a.混合气体的平均相对分子质量保持不变
b.CO2和NH3的体积分数保持不变
c.CO2和NH3的转化率相等
d.混合气体的密度保持不变
e.1molCO2生成的同时有 2molN—H键断裂
II.工业上用CH4与水蒸气在一定条件下制取H2,:CH4(g) + H2O(g) CO(g) + 3H2(g) ΔH = + 203 kJ•mol-1
CO(g) + 3H2(g) ΔH = + 203 kJ•mol-1
①该反应逆反应速率表达式为:v逆=k•c(CO) •c3(H2),k 为速率常数,在某温度下测得实验数据如表:
由上述数据可得该温度下,该反应的逆反应速率常数k为____ L3•mol-3•min-1。
②某温度下,在体积为3 L的密闭容器中通入物质的量均为3 mol的CH4和水蒸气,发生上述反应,5分钟时达到平衡,此时H2的体积分数为60%,则在5分钟内用CH4浓度变化表示的平均反应速率v(CH4)=________ ;该温度下该反应的平衡常数K=________ 。平衡后再向容器中加入1 mol CH4和1 mol CO,平衡_______ 移动(填“正反应方向”或“逆反应方向”或“不”)。
III.在常温下,将0.02mol CO2通入200mL 0.15mol/L的NaOH溶液中,充分反应后下列关系式中正确的是_____________________
A.c(Na+)>c(HCO3-)> c(CO32-)>c(OH-)>c(H+)
B.3c (Na+)=2[c(CO32-)+ c(HCO3-)+ c(H2CO3)]
C.c (Na+)+c(H+)=c(HCO3-)+ c(CO32-)+c(OH-)
D.c(HCO3-)+ 3c(H2CO3)+2c(H+)= c(CO32-)+2c(OH-)
Ⅰ.以CO2与NH3为原料可以合成尿素[CO(NH2)2]。合成尿素的反应为2NH3(g) + CO2(g)
 CO(NH2)2(s) + H2O(g)。
CO(NH2)2(s) + H2O(g)。(1)在不同温度及不同y值下合成尿素,达到平衡时,氨气转化率变化情况如图所示。
①该反应的ΔH
 ],则y1
],则y1
(2)t℃时,若向容积固定的密闭容器中加入一定量的 NH3和CO2合成尿素,下列叙述能说明此反应达到平衡状态的是
a.混合气体的平均相对分子质量保持不变
b.CO2和NH3的体积分数保持不变
c.CO2和NH3的转化率相等
d.混合气体的密度保持不变
e.1molCO2生成的同时有 2molN—H键断裂
II.工业上用CH4与水蒸气在一定条件下制取H2,:CH4(g) + H2O(g)
 CO(g) + 3H2(g) ΔH = + 203 kJ•mol-1
CO(g) + 3H2(g) ΔH = + 203 kJ•mol-1①该反应逆反应速率表达式为:v逆=k•c(CO) •c3(H2),k 为速率常数,在某温度下测得实验数据如表:
| CO浓度(mol•L-1) | H2浓度(mol•L-1) | 逆反应速率(mol•L-1•min-1) |
| 0.05 | c1 | 4.8 |
| c2 | c1 | 19.2 |
| c2 | 0.1 | 8.1 |
由上述数据可得该温度下,该反应的逆反应速率常数k为
②某温度下,在体积为3 L的密闭容器中通入物质的量均为3 mol的CH4和水蒸气,发生上述反应,5分钟时达到平衡,此时H2的体积分数为60%,则在5分钟内用CH4浓度变化表示的平均反应速率v(CH4)=
III.在常温下,将0.02mol CO2通入200mL 0.15mol/L的NaOH溶液中,充分反应后下列关系式中正确的是
A.c(Na+)>c(HCO3-)> c(CO32-)>c(OH-)>c(H+)
B.3c (Na+)=2[c(CO32-)+ c(HCO3-)+ c(H2CO3)]
C.c (Na+)+c(H+)=c(HCO3-)+ c(CO32-)+c(OH-)
D.c(HCO3-)+ 3c(H2CO3)+2c(H+)= c(CO32-)+2c(OH-)
您最近一年使用:0次
2020-01-03更新
|
128次组卷
|
2卷引用:吉林省通钢一中、集安一中、梅河口五中等联谊校2020届高三第五次月考化学试题
7 . 二氧化碳催化加氢合成乙烯是综合利用CO2的热点研究领域。回答下列问题:
(1)CO2催化加氢生成乙烯和水的反应中,产物的物质的量之比n(C2H4)∶n(H2O)=__________ 。当反应达到平衡时,若增大压强,则n(C2H4)___________ (填“变大”“变小”或“不变”)。
(2)理论计算表明,原料初始组成n(CO2)∶n(H2)=1∶3,在体系压强为0.1MPa,反应达到平衡时,四种组分的物质的量分数x随温度T的变化如图所示。
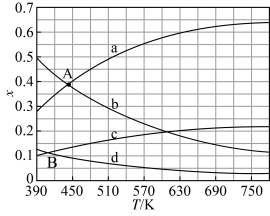
图中,表示C2H4、CO2变化的曲线分别是______ 、______ 。CO2催化加氢合成C2H4反应的ΔH______ 0(填“大于”或“小于”)。
(3)根据图中点A(440K,0.39),计算该温度时反应的平衡常数Kp=_________ (MPa)−3(列出计算式。以分压表示,分压=总压×物质的量分数)。
(4)二氧化碳催化加氢合成乙烯反应往往伴随副反应,生成C3H6、C3H8、C4H8等低碳烃。一定温度和压强条件下,为了提高反应速率和乙烯选择性,应当___________________ 。
(1)CO2催化加氢生成乙烯和水的反应中,产物的物质的量之比n(C2H4)∶n(H2O)=
(2)理论计算表明,原料初始组成n(CO2)∶n(H2)=1∶3,在体系压强为0.1MPa,反应达到平衡时,四种组分的物质的量分数x随温度T的变化如图所示。

图中,表示C2H4、CO2变化的曲线分别是
(3)根据图中点A(440K,0.39),计算该温度时反应的平衡常数Kp=
(4)二氧化碳催化加氢合成乙烯反应往往伴随副反应,生成C3H6、C3H8、C4H8等低碳烃。一定温度和压强条件下,为了提高反应速率和乙烯选择性,应当
您最近一年使用:0次
2020-07-09更新
|
16357次组卷
|
23卷引用:吉林省白山市抚松县第一中学2021-2022学年高二上学期第一次月考化学试题
吉林省白山市抚松县第一中学2021-2022学年高二上学期第一次月考化学试题吉林省洮南市第一中学2022-2023学年高二上学期第一次(10月)月考化学试题江西省高安中学2020-2021学年高一上学期第一次月考(A)化学试题2020年全国统一考试化学试题(新课标Ⅲ)(已下线)专题09 反应速率、化学平衡-2020年高考真题和模拟题化学分项汇编(已下线)专题14 化学反应原理综合-2020年高考真题和模拟题化学分项汇编(已下线)专题15 化学反应原理大题不丢分-2021年高考化学必做热点专题(已下线)专题06 化学反应速率和化学平衡——备战2021年高考化学纠错笔记(已下线)押全国卷理综第28题 化学反应原理-备战2021年高考化学临考题号押题选择性必修1 专题2 素养检测2020年全国卷Ⅲ化学真题变式题(已下线)专题12 化学反应原理综合题—2022年高考化学二轮复习讲练测(全国版)-练习(已下线)回归教材重难点09 化学反应原理综合-【查漏补缺】2022年高考化学三轮冲刺过关(全国通用)(已下线)押全国卷理综第28题 化学反应原理-备战2022年高考化学临考题号押题(课标全国卷)(已下线)专题15化学反应原理综合-三年(2020~2022)高考真题汇编(全国卷)(已下线)专题15化学反应原理综合-五年(2018~2022)高考真题汇编(全国卷)(已下线)第20讲 化学平衡常数及转化率的计算(练)-2023年高考化学一轮复习讲练测(新教材新高考)陕西省富平县蓝光中学2021-2022学年高三上学期期末教学检测化学试题(已下线)专题十二化学反应速率与平衡(已下线)专题09 化学反应速率与化学平衡(测)-2023年高考化学二轮复习讲练测(新高考专用)(已下线)第七章 化学反应速率与化学平衡 第45讲 实际工业生产中图像问题分类突破(已下线)专题05 反应原理专题-【大题精做】冲刺2023年高考化学大题突破+限时集训(新高考专用)(已下线)专题17 原理综合题
名校
解题方法
8 . CH4、CO2和碳酸都是碳的重要化合物,实现碳及其化合物的相互转化,对开发新能源和降低碳排放意义重大。
(1)已知:①CH4(g)+H2O(g) CO(g)+3H2(g) △H1=+206.1kJ·mol-1
CO(g)+3H2(g) △H1=+206.1kJ·mol-1
②2H2(g)+CO(g) CH3OH(l) △H2=-128.3kJ·mol-1
CH3OH(l) △H2=-128.3kJ·mol-1
③2H2(g)+O2(g)=2H2O(g) △H3=-483.6kJ·mol-1
写出由甲烷和氧气合成液态甲醇的热化学方程式:_____________________ 。
(2)若利用反应①来制备氢气。为了探究温度、压强对反应①的影响,设计以下三组对比实验(温度为400℃或500℃,压强为101kPa或404kPa)。
Ⅰ、实验1、实验2和实验3比较,反应开始时正反应速率最快的是_________ ;平衡时CH4的转化率最小的是_________ 。
Ⅱ、实验2和实验3相比,其平衡常数关系:K2______ K3(填“>”、“<”或“=”)。
(3)科学家提出由CO2制取碳(C)的太阳能工艺如图1所示.

①“重整系统”发生的反应中n(FeO)∶n(CO2)=6∶1,则FexOy的化学式为______ ;
②“热分解系统”中每分解l mol FexOy,同时生成标准状况下气体体积为_______ 。
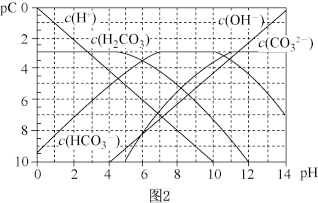
(4)pC类似pH,是指极稀溶液中的溶质浓度的常用负对数值。如某溶液中溶质的浓度为1×10-2mol·L-1,则该溶液中溶质的pC=-lg(1×10-2)=2。上图2为25℃时H2CO3溶液的pC-pH图。请回答下列问题:
①在0<pH<4时,H2CO3溶液中主要存在的离子是___________ ;
②在8<pH<10时,溶液中HCO 的pC值不随着pH增大而减小的原因是
的pC值不随着pH增大而减小的原因是____ ;
③求H2CO3一级电离平衡常数的数值Ka1=_______________ 。
(1)已知:①CH4(g)+H2O(g)
 CO(g)+3H2(g) △H1=+206.1kJ·mol-1
CO(g)+3H2(g) △H1=+206.1kJ·mol-1②2H2(g)+CO(g)
 CH3OH(l) △H2=-128.3kJ·mol-1
CH3OH(l) △H2=-128.3kJ·mol-1③2H2(g)+O2(g)=2H2O(g) △H3=-483.6kJ·mol-1
写出由甲烷和氧气合成液态甲醇的热化学方程式:
(2)若利用反应①来制备氢气。为了探究温度、压强对反应①的影响,设计以下三组对比实验(温度为400℃或500℃,压强为101kPa或404kPa)。
| 实验序号 | 温度/℃ | 压强/kPa | CH4初始浓度/ mol·L-1 | H2O初始浓度/ mol·L-1 |
| 1 | 400 | 101 | 3.0 | 7.0 |
| 2 | T | 101 | 3.0 | 7.0 |
| 3 | 400 | P | 3.0 | 7.0 |
Ⅱ、实验2和实验3相比,其平衡常数关系:K2
(3)科学家提出由CO2制取碳(C)的太阳能工艺如图1所示.


①“重整系统”发生的反应中n(FeO)∶n(CO2)=6∶1,则FexOy的化学式为
②“热分解系统”中每分解l mol FexOy,同时生成标准状况下气体体积为
(4)pC类似pH,是指极稀溶液中的溶质浓度的常用负对数值。如某溶液中溶质的浓度为1×10-2mol·L-1,则该溶液中溶质的pC=-lg(1×10-2)=2。上图2为25℃时H2CO3溶液的pC-pH图。请回答下列问题:
①在0<pH<4时,H2CO3溶液中主要存在的离子是
②在8<pH<10时,溶液中HCO
 的pC值不随着pH增大而减小的原因是
的pC值不随着pH增大而减小的原因是③求H2CO3一级电离平衡常数的数值Ka1=
您最近一年使用:0次
2018-03-30更新
|
993次组卷
|
3卷引用:吉林省吉林市普通中学2018届高三高中毕业班第三次调研测试理综化学试题



