1 . 尿素是一种适用于各种土壤和植物的有机态氮肥,是首个由无机物人工合成的有机物。以CO2等为原料合成尿素能回收利用二氧化碳,实现碳的固定。按要求回答下列问题。
(1)1828年,德国化学家维勒使用无机物质氰酸银(AgCNO)与NH4Cl在一定条件下反应制得CO(NH2)2,该反应的化学方程式是___________ 。
(2)工业上以CO2和NH3为原料在一定温度和压强下合成尿素,反应分两步:
i.CO2(g)+2NH3(g)=H2NCOONH4(g) △H1=-272kJ/mol;
ii.H2NCOONH4(g)=CO(NH2)2(s)+H2O(l) △H2=+138kJ/mol;
①反应CO2(g)+2NH3(g)=CO(NH2)2(s)+H2O(l) △H3=_______ kJ/mol,该反应自发进行的条件是___________ (填“低温”、“高温”、“任何温度”)。
②在恒容密闭容器中发生反应:CO2(g)+2NH3(g)=CO(NH2)2(s)+H2O(l),测得CO的平衡转化率与起始投料比[η= ,n分别为1:1、2:1、3:1]和温度关系如图所示((不考虑水的蒸气压)。
,n分别为1:1、2:1、3:1]和温度关系如图所示((不考虑水的蒸气压)。

曲线a代表的投料比为___________ ;若T1℃下,从反应开始至达到M点历时5min,测得M点对应的总压强为140kPa,则0~5min内,NH3分压的平均变化率为___________ kPamin-1,M点对应条件下的分压平衡常数为___________ (kPa)-3(列出计算式即可)。
(3)尿素除了用作化肥外还有多种应用。一种用于发动机SCR系统的电解尿素混合装置如图所示,X、Y为石墨电极,隔膜仅阻止气体通过。根据信息判断电极Y为___________ 极,X电极的电极反应式为___________ 。

(1)1828年,德国化学家维勒使用无机物质氰酸银(AgCNO)与NH4Cl在一定条件下反应制得CO(NH2)2,该反应的化学方程式是
(2)工业上以CO2和NH3为原料在一定温度和压强下合成尿素,反应分两步:
i.CO2(g)+2NH3(g)=H2NCOONH4(g) △H1=-272kJ/mol;
ii.H2NCOONH4(g)=CO(NH2)2(s)+H2O(l) △H2=+138kJ/mol;
①反应CO2(g)+2NH3(g)=CO(NH2)2(s)+H2O(l) △H3=
②在恒容密闭容器中发生反应:CO2(g)+2NH3(g)=CO(NH2)2(s)+H2O(l),测得CO的平衡转化率与起始投料比[η=
 ,n分别为1:1、2:1、3:1]和温度关系如图所示((不考虑水的蒸气压)。
,n分别为1:1、2:1、3:1]和温度关系如图所示((不考虑水的蒸气压)。
曲线a代表的投料比为
(3)尿素除了用作化肥外还有多种应用。一种用于发动机SCR系统的电解尿素混合装置如图所示,X、Y为石墨电极,隔膜仅阻止气体通过。根据信息判断电极Y为

您最近一年使用:0次
2 . 许多国家以天然气为原料制备氢气,用于氨的合成。回答下列问题:
(1)已知:①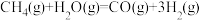
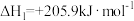
②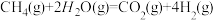
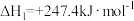
③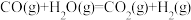

反应②的平衡常数表达式为___________ ,反应③的ΔH3=___________ kJ·mol-1。
(2)T℃时,在2L密闭容器中加入甲烷和过量水蒸气,起始量和反应5min后反应混合物的量如表所示:
起始5min内,反应的平均速率 v(H2)=___________ mol/( L·min)
(3)不同条件对反应②的影响如图所示。图1中的水碳比为2,图2中的温度为800℃。(注:水碳比为水和甲烷的物质的量比)
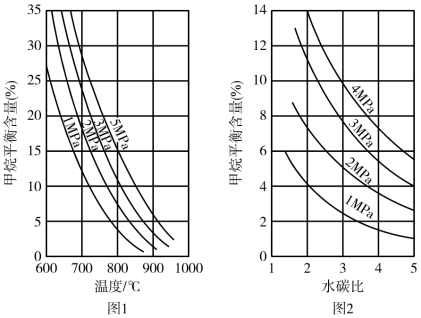
从图1中看出,800℃、5MPa时甲烷平衡转化率为___________ 。分析图1和图2,写出有利于甲烷转化的措施___________ (写3点)
(4)工业中甲烷转化过程通常适当加压,加压的作用是___________(填标号)。
(1)已知:①
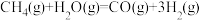
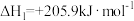
②
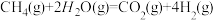
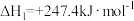
③
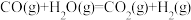

反应②的平衡常数表达式为
(2)T℃时,在2L密闭容器中加入甲烷和过量水蒸气,起始量和反应5min后反应混合物的量如表所示:
| 反应时间 | CH4/mol | H2O/mol | CO2/mol | H2/mol |
| 起始 | 1.0 | 3.0 | 0 | 0 |
| 5min时 | 0.8 | a | b | c |
起始5min内,反应的平均速率 v(H2)=
(3)不同条件对反应②的影响如图所示。图1中的水碳比为2,图2中的温度为800℃。(注:水碳比为水和甲烷的物质的量比)

从图1中看出,800℃、5MPa时甲烷平衡转化率为
(4)工业中甲烷转化过程通常适当加压,加压的作用是___________(填标号)。
| A.增加反应物浓度 | B.加快反应速率 |
| C.有利于平衡右移 | D.提高平衡转化率 |
您最近一年使用:0次
3 . 以天然气为原料制备的 叫“蓝氢”,其制备原理为
叫“蓝氢”,其制备原理为 △H,回收和利用
△H,回收和利用 有利于“双碳”达标。
有利于“双碳”达标。
已知:
①
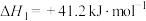
②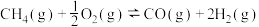

③

请回答下列问题。
(1)已知 (g)的燃烧热为890.3
(g)的燃烧热为890.3 。写出表示甲烷燃烧热的热化学方程式
。写出表示甲烷燃烧热的热化学方程式_______ 。
(2)利用 合成烷烃能有效减少
合成烷烃能有效减少 排放。Ni-
排放。Ni- 催化
催化 加
加 生成
生成 ,反应历程如图1(吸附催化剂表面的物种用*表示)。含碳产物中
,反应历程如图1(吸附催化剂表面的物种用*表示)。含碳产物中 的物质的量百分率和
的物质的量百分率和 的转化率与温度关系如图2。
的转化率与温度关系如图2。

①如果某条件下,含碳产物中 的体积分数为80%,则总反应的化学方程式为
的体积分数为80%,则总反应的化学方程式为_______ 。
②温度高于260 C,升高温度,
C,升高温度, 的产率
的产率_______ (填“增大”“减小”或“不变”),原因是_______ 。
③ 甲烷化的过程中,保持
甲烷化的过程中,保持 和
和 的体积比为1:4,反应气的总流量控制在50
的体积比为1:4,反应气的总流量控制在50 ,320℃时
,320℃时 反应速率为
反应速率为_______  。
。
(3)在密闭容器中充入1mol (g)和1mol
(g)和1mol  (g),仅发生
(g),仅发生
反应a.
 ;
;
反应b. ,达到平衡时生成0.1mol
,达到平衡时生成0.1mol  和0.6mol CO,则体系中
和0.6mol CO,则体系中_______ (填“吸收”或“放出”)热量为_______ kJ。
 叫“蓝氢”,其制备原理为
叫“蓝氢”,其制备原理为 △H,回收和利用
△H,回收和利用 有利于“双碳”达标。
有利于“双碳”达标。已知:
①

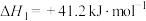
②
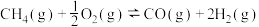

③


请回答下列问题。
(1)已知
 (g)的燃烧热为890.3
(g)的燃烧热为890.3 。写出表示甲烷燃烧热的热化学方程式
。写出表示甲烷燃烧热的热化学方程式(2)利用
 合成烷烃能有效减少
合成烷烃能有效减少 排放。Ni-
排放。Ni- 催化
催化 加
加 生成
生成 ,反应历程如图1(吸附催化剂表面的物种用*表示)。含碳产物中
,反应历程如图1(吸附催化剂表面的物种用*表示)。含碳产物中 的物质的量百分率和
的物质的量百分率和 的转化率与温度关系如图2。
的转化率与温度关系如图2。
①如果某条件下,含碳产物中
 的体积分数为80%,则总反应的化学方程式为
的体积分数为80%,则总反应的化学方程式为②温度高于260
 C,升高温度,
C,升高温度, 的产率
的产率③
 甲烷化的过程中,保持
甲烷化的过程中,保持 和
和 的体积比为1:4,反应气的总流量控制在50
的体积比为1:4,反应气的总流量控制在50 ,320℃时
,320℃时 反应速率为
反应速率为 。
。(3)在密闭容器中充入1mol
 (g)和1mol
(g)和1mol  (g),仅发生
(g),仅发生反应a.

 ;
;反应b.
 ,达到平衡时生成0.1mol
,达到平衡时生成0.1mol  和0.6mol CO,则体系中
和0.6mol CO,则体系中
您最近一年使用:0次
2022-11-05更新
|
108次组卷
|
2卷引用:湖南省河南省湘豫名校联考2022- 2023学年高二上学期阶段考试(一)化学试题
4 . 丙烯是工业上合成精细化学品的原料,随着天然气和页岩气的可用性不断提高,制取丙烯的技术受到人们越来越多的关注。
(1)主反应I :C3H8(g) C3 H6(g)+H2(g) △H1
C3 H6(g)+H2(g) △H1
副反应Ⅱ :C3H8(g) C2H4(g)+CH4(g) △H2
C2H4(g)+CH4(g) △H2
已知H2、丙烷(C3H8 )和丙烯(C3 H6)的燃烧热(△H)分别是-285.8 kJ·mol-1、-2220 kJ·mol-1和-2051 kJ·mol-1,则△H=_______ kJ·mol-1.主反应I在_______ (填“高温”、“低温”或“任意温度”)时能自发进行。
(2)一定温度下,向总压恒定为p kPa的容器中充入一定量C3H8气体,在催化作用下,发生上述反应制备C3 H6。
①下列情况表明反应达到平衡状态的是_______ (填标号)。
A.气体密度不再改变
B.体系压强不再改变
C.混合气体的平均摩尔质量不再改变
D.单位时间内消耗C3H8的物质的量与生成C3 H6的物质的量相等
②从平衡移动的角度判断,达到平衡后通入N2的作用是_______ 。
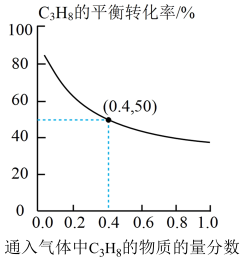
(3)在温度为T时,向起始压强为120 kPa的恒压容器中通入4 mol C3H8和6 mol N2发生反应,经10 min反应达到平衡,C3H8的平衡转化率与通入气体中C3H8的物质的量分数的关系如图所示。该条件下,C3H8的选择性为80%,则0~ 10 min内生成C3 H6的平均速率为_______ kPa·min-1;反应I的平衡常数 Kp=_______ kPa(以分压表示,分压=总压X物质的量分数,保留一位小数)。
(4)向恒温刚性密闭容器中通入一定体积比的C3H8、O2、N2的混合气体,已知某反应条件下只发生如下反应(k、k'为速率常数):
反应I :2C3H8(g) +O2(g)=2C3 H6(g) +2H2O(g) k
反应Ⅳ :2C3 H6(g) + 9O2 (g)=6CO2(g)+ 6H2O(g) k'
实验测得丙烯的净生成速率方程为v(C3 H6)=kp(C3H8)-k'p(C3H6),可推测丙烯的浓度随时间的变化趋势为_______ ,其理由是_______
(1)主反应I :C3H8(g)
 C3 H6(g)+H2(g) △H1
C3 H6(g)+H2(g) △H1副反应Ⅱ :C3H8(g)
 C2H4(g)+CH4(g) △H2
C2H4(g)+CH4(g) △H2已知H2、丙烷(C3H8 )和丙烯(C3 H6)的燃烧热(△H)分别是-285.8 kJ·mol-1、-2220 kJ·mol-1和-2051 kJ·mol-1,则△H=
(2)一定温度下,向总压恒定为p kPa的容器中充入一定量C3H8气体,在催化作用下,发生上述反应制备C3 H6。
①下列情况表明反应达到平衡状态的是
A.气体密度不再改变
B.体系压强不再改变
C.混合气体的平均摩尔质量不再改变
D.单位时间内消耗C3H8的物质的量与生成C3 H6的物质的量相等
②从平衡移动的角度判断,达到平衡后通入N2的作用是
(3)在温度为T时,向起始压强为120 kPa的恒压容器中通入4 mol C3H8和6 mol N2发生反应,经10 min反应达到平衡,C3H8的平衡转化率与通入气体中C3H8的物质的量分数的关系如图所示。该条件下,C3H8的选择性为80%,则0~ 10 min内生成C3 H6的平均速率为

(4)向恒温刚性密闭容器中通入一定体积比的C3H8、O2、N2的混合气体,已知某反应条件下只发生如下反应(k、k'为速率常数):
反应I :2C3H8(g) +O2(g)=2C3 H6(g) +2H2O(g) k
反应Ⅳ :2C3 H6(g) + 9O2 (g)=6CO2(g)+ 6H2O(g) k'
实验测得丙烯的净生成速率方程为v(C3 H6)=kp(C3H8)-k'p(C3H6),可推测丙烯的浓度随时间的变化趋势为
您最近一年使用:0次
解题方法
5 . 随着科技的进步,合理利用资源、保护环境成为当今社会关注的焦点。甲胺铅碘(CH3NH3PbI3)用作全固态钙钛矿敏化太阳能电池的敏化剂,可由CH3NH2、PbI2及HI为原料合成,回答下列问题:
(1)制取甲胺的反应为CH3OH(g)+NH3(g) CH3NH2(g)+H2O(g) ΔH。已知该反应中相关化学键的键能数据如下:
CH3NH2(g)+H2O(g) ΔH。已知该反应中相关化学键的键能数据如下:
则该反应的ΔH=_______ 。
(2)上述反应中所需的甲醇工业上利用水煤气合成,反应为CO(g)+2H2(g) CH3OH(g) ΔH<0。在一定条件下,将1 mol CO和2 mol H2通入密闭容器中进行反应,当改变某一外界条件(温度或压强)时,CH3OH的体积分数φ(CH3OH)变化趋势如图所示:
CH3OH(g) ΔH<0。在一定条件下,将1 mol CO和2 mol H2通入密闭容器中进行反应,当改变某一外界条件(温度或压强)时,CH3OH的体积分数φ(CH3OH)变化趋势如图所示:
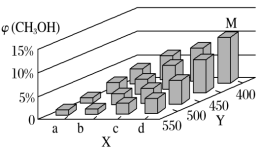
①平衡时,M点CH3OH的体积分数为10%,则CO的转化率为________ 。
②X轴上a点的数值比b点________ (填“大”或“小”)。某同学认为上图中Y轴表示温度,你认为他判断的理由是_____________________ 。
(3)实验室可由四氧化三铅和氢碘酸反应制备难溶的PbI2,则每生成3 mol PbI2的反应中,转移电子的物质的量为__________ 。
(4)常温下,PbI2饱和溶液(呈黄色)中c(Pb2+)=1.0×10-3mol·L-1,则Ksp(PbI2)=_________ ;已知Ksp(PbCl2)=1.6×10-5,则转化反应PbCl2(s)+2I-(aq)  PbI2(s)+2Cl-(aq)的平衡常数K=
PbI2(s)+2Cl-(aq)的平衡常数K=_________ 。
(5)分解HI曲线和液相法制备HI反应曲线分别如图1和图2所示:
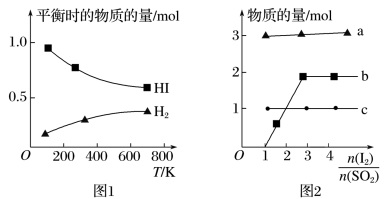
①反应H2(g)+I2(g) =2HI(g) 的ΔH__________ (填大于或小于)0。
②将二氧化硫通入碘水中会发生反应:SO2+I2+2H2O=3H++HSO4-+2I-,I2+I- I3-,图2中曲线a、b分别代表的微粒是
I3-,图2中曲线a、b分别代表的微粒是________ 、_________ (填微粒符号);由图2 知要提高碘的还原率,除控制温度外,还可以采取的措施是___________________________________ 。
(1)制取甲胺的反应为CH3OH(g)+NH3(g)
 CH3NH2(g)+H2O(g) ΔH。已知该反应中相关化学键的键能数据如下:
CH3NH2(g)+H2O(g) ΔH。已知该反应中相关化学键的键能数据如下:| 共价键 | C-O | H-O | N-H | C-N |
| 键能/kJ·mol-1 | 351 | 463 | 393 | 293 |
则该反应的ΔH=
(2)上述反应中所需的甲醇工业上利用水煤气合成,反应为CO(g)+2H2(g)
 CH3OH(g) ΔH<0。在一定条件下,将1 mol CO和2 mol H2通入密闭容器中进行反应,当改变某一外界条件(温度或压强)时,CH3OH的体积分数φ(CH3OH)变化趋势如图所示:
CH3OH(g) ΔH<0。在一定条件下,将1 mol CO和2 mol H2通入密闭容器中进行反应,当改变某一外界条件(温度或压强)时,CH3OH的体积分数φ(CH3OH)变化趋势如图所示:
①平衡时,M点CH3OH的体积分数为10%,则CO的转化率为
②X轴上a点的数值比b点
(3)实验室可由四氧化三铅和氢碘酸反应制备难溶的PbI2,则每生成3 mol PbI2的反应中,转移电子的物质的量为
(4)常温下,PbI2饱和溶液(呈黄色)中c(Pb2+)=1.0×10-3mol·L-1,则Ksp(PbI2)=
 PbI2(s)+2Cl-(aq)的平衡常数K=
PbI2(s)+2Cl-(aq)的平衡常数K=(5)分解HI曲线和液相法制备HI反应曲线分别如图1和图2所示:

①反应H2(g)+I2(g) =2HI(g) 的ΔH
②将二氧化硫通入碘水中会发生反应:SO2+I2+2H2O=3H++HSO4-+2I-,I2+I-
 I3-,图2中曲线a、b分别代表的微粒是
I3-,图2中曲线a、b分别代表的微粒是
您最近一年使用:0次



