1 . 化学反应的调控与平衡移动原理在工业生产中有着广泛的应用。
I.在硫酸工业中,发生反应 ,在不同条件下SO2的平衡转化率数据(已知
,在不同条件下SO2的平衡转化率数据(已知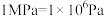 ,约10个标准大气压)如表所示:
,约10个标准大气压)如表所示:
注:表内转化率数值后括号内字母,如“A”,为反应条件编号。
(1)SO2的大量排放会导致酸雨,酸雨的pH<___________ (填数值);为了碧水蓝天工程,必须有效控制污染物的排放,同时提高SO2的转化率,依据勒夏特列原理,理论上选择表中反应条件___________ (填编号)为最佳。
Ⅱ.工业合成氨的原料气[N2、H2,混有少量CO(能使合成氨的催化剂中毒)、NH3]进入合成塔前要经过铜氨液处理。
反应①(制取氢气):
反应②(铜氨液处理原料气):
(2)分析原料气需要经过铜氨液处理的原因:___________ ,处理了原料气后的废液经过适当___________ (填“升温”或“降温”)可使铜氨液再生。
(3)反应①的平衡常数为K①,反应②的平衡常数为K②;在一定压强下的恒容密闭容器中,-lgK①、-lgK②随温度变化的曲线如图。

T℃时,反应 的平衡常数K=
的平衡常数K=___________ 。
(4)在673K时,合成氨各步反应的能量变化如图所示 (标“*”的粒子表示吸附态):

图中生成NH2*的过程中的决速步骤的活化能为___________ kJ·mol-1;已知净速方程式为 ,k1、k2点分别为正反应和逆反应的速率常数,p(N2)、p(H2)、p(NH3)代表各气体组分的分压(分压=总压×物质的量分数)。在恒温恒压条件下,向某密闭容器中通入1molN2(g)和3molH2(g)合成氨气,起始p0=16MPa,当反应达到平衡时,NH3(g)的质量分数为40%,设a=0.5,则p(N2)=
,k1、k2点分别为正反应和逆反应的速率常数,p(N2)、p(H2)、p(NH3)代表各气体组分的分压(分压=总压×物质的量分数)。在恒温恒压条件下,向某密闭容器中通入1molN2(g)和3molH2(g)合成氨气,起始p0=16MPa,当反应达到平衡时,NH3(g)的质量分数为40%,设a=0.5,则p(N2)=___________ MPa,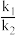
___________ 。
I.在硫酸工业中,发生反应
 ,在不同条件下SO2的平衡转化率数据(已知
,在不同条件下SO2的平衡转化率数据(已知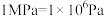 ,约10个标准大气压)如表所示:
,约10个标准大气压)如表所示: | 0.1 | 0.5 | 1 | 5 | 10 |
| 450 | 97.5(A) | 98.9(B) | 99.2(C) | 99.6(D) | 99.7(E) |
| 550 | 85.6(F) | 92.9(G) | 94.9(H) | 97.7 | 98.3(J) |
(1)SO2的大量排放会导致酸雨,酸雨的pH<
Ⅱ.工业合成氨的原料气[N2、H2,混有少量CO(能使合成氨的催化剂中毒)、NH3]进入合成塔前要经过铜氨液处理。
反应①(制取氢气):

反应②(铜氨液处理原料气):

(2)分析原料气需要经过铜氨液处理的原因:
(3)反应①的平衡常数为K①,反应②的平衡常数为K②;在一定压强下的恒容密闭容器中,-lgK①、-lgK②随温度变化的曲线如图。

T℃时,反应
 的平衡常数K=
的平衡常数K=(4)在673K时,合成氨各步反应的能量变化如图所示 (标“*”的粒子表示吸附态):

图中生成NH2*的过程中的决速步骤的活化能为
 ,k1、k2点分别为正反应和逆反应的速率常数,p(N2)、p(H2)、p(NH3)代表各气体组分的分压(分压=总压×物质的量分数)。在恒温恒压条件下,向某密闭容器中通入1molN2(g)和3molH2(g)合成氨气,起始p0=16MPa,当反应达到平衡时,NH3(g)的质量分数为40%,设a=0.5,则p(N2)=
,k1、k2点分别为正反应和逆反应的速率常数,p(N2)、p(H2)、p(NH3)代表各气体组分的分压(分压=总压×物质的量分数)。在恒温恒压条件下,向某密闭容器中通入1molN2(g)和3molH2(g)合成氨气,起始p0=16MPa,当反应达到平衡时,NH3(g)的质量分数为40%,设a=0.5,则p(N2)=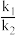
您最近一年使用:0次
2023-09-19更新
|
163次组卷
|
4卷引用:广东省东莞市部分名校高三上(9月联考)-化学试题
2 . I.研究氮和碳的化合物对工业生产和防治污染有重要意义,回答下列问题:
(1)化学键键能数据如下:
合成氨反应 N2(g)+
N2(g)+ H2(g)
H2(g) NH3(g)的活化能Ea1=254 kJ·mol-1,由此计算氨分解反应NH3(g)
NH3(g)的活化能Ea1=254 kJ·mol-1,由此计算氨分解反应NH3(g) 
 N2(g)+
N2(g)+ H2(g)的活化能Ea2=
H2(g)的活化能Ea2=___________ kJ·mol-1。
(2)利用NH3的还原性可以消除氮氧化物的污染,其中除去NO的主要反应如下:4NH3(g)+6NO(g) 5N2(g)+6H2O(g) △H<0。某研究小组将2 mol NH3、3 mol NO和一定量的O2充入2 L密闭容器中,在Ag2O催化剂表面发生上述反应,NO的转化率随温度变化的情况如图所示:
5N2(g)+6H2O(g) △H<0。某研究小组将2 mol NH3、3 mol NO和一定量的O2充入2 L密闭容器中,在Ag2O催化剂表面发生上述反应,NO的转化率随温度变化的情况如图所示:
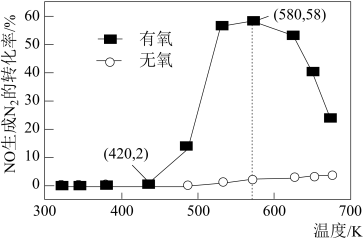
①温度从420K升高到580K用时4min,则此时段内NO的平均反应速率v(NO)=___________ ;
②在有氧条件下,温度580K之后NO生成N2的转化率降低的原因可能是___________ 。
II.目前有一种新的循环利用方案处理航天员呼吸产生的CO2,是用Bosch反应CO2(g)+2H2(g) C(s)+2H2O(g) △H<0,再电解水实现O2的循环利用。
C(s)+2H2O(g) △H<0,再电解水实现O2的循环利用。
(3)若要此反应自发进行___________ (填“高温”或“低温”)更有利。
(4)350℃时,向体积为2 L的恒容密闭容器中通入8 mol H2和4 mol CO2发生以上反应,若反应起始和平衡时温度相同(均为350℃),测得反应过程中压强随时间的变化如表所示:
①350℃时Bosch反应的Kp=___________ (Kp为用气体的分压表示的平衡常数,分压=气体的体积分数×体系总压)。
②Bosch反应的速率方程:v正=k正·c(CO2)·c2(H2),v逆=k逆·c2(H2O)(k是速率常数,只与温度有关)。20min时,
___________  (填“>”“<”或“=”)。
(填“>”“<”或“=”)。
(5)工业上常用氨水吸收二氧化硫,通过计算判断常温下(NH4)2SO3溶液的酸碱性并说明判断依据:___________ 。(已知:NH3·H2O的K=1.8×10-5;H2SO3的Ka1=1.3×10-2,Ka2=6.3×10-8)
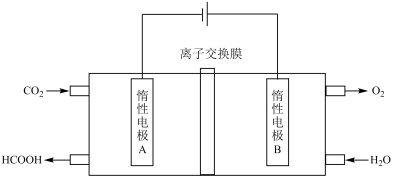
(6)通过电化学方法可有效实现以CO2和水为原料合成甲酸,其原理示意图图所示,则A极的电极反应式为___________ 。
(1)化学键键能数据如下:
| 化学键 | H-H | N≡N | N-H |
| E/(kJ/mol) | 436 | 946 | 391 |
 N2(g)+
N2(g)+ H2(g)
H2(g) NH3(g)的活化能Ea1=254 kJ·mol-1,由此计算氨分解反应NH3(g)
NH3(g)的活化能Ea1=254 kJ·mol-1,由此计算氨分解反应NH3(g) 
 N2(g)+
N2(g)+ H2(g)的活化能Ea2=
H2(g)的活化能Ea2=(2)利用NH3的还原性可以消除氮氧化物的污染,其中除去NO的主要反应如下:4NH3(g)+6NO(g)
 5N2(g)+6H2O(g) △H<0。某研究小组将2 mol NH3、3 mol NO和一定量的O2充入2 L密闭容器中,在Ag2O催化剂表面发生上述反应,NO的转化率随温度变化的情况如图所示:
5N2(g)+6H2O(g) △H<0。某研究小组将2 mol NH3、3 mol NO和一定量的O2充入2 L密闭容器中,在Ag2O催化剂表面发生上述反应,NO的转化率随温度变化的情况如图所示:
①温度从420K升高到580K用时4min,则此时段内NO的平均反应速率v(NO)=
②在有氧条件下,温度580K之后NO生成N2的转化率降低的原因可能是
II.目前有一种新的循环利用方案处理航天员呼吸产生的CO2,是用Bosch反应CO2(g)+2H2(g)
 C(s)+2H2O(g) △H<0,再电解水实现O2的循环利用。
C(s)+2H2O(g) △H<0,再电解水实现O2的循环利用。(3)若要此反应自发进行
(4)350℃时,向体积为2 L的恒容密闭容器中通入8 mol H2和4 mol CO2发生以上反应,若反应起始和平衡时温度相同(均为350℃),测得反应过程中压强随时间的变化如表所示:
| 时间/min | 0 | 10 | 20 | 30 | 40 | 50 | 60 |
| 压强 | 6.00P0 | 5.60 P0 | 5.30 P0 | 5.15 P0 | 5.06 P0 | 5.00 P0 | 5.00 P0 |
②Bosch反应的速率方程:v正=k正·c(CO2)·c2(H2),v逆=k逆·c2(H2O)(k是速率常数,只与温度有关)。20min时,

 (填“>”“<”或“=”)。
(填“>”“<”或“=”)。(5)工业上常用氨水吸收二氧化硫,通过计算判断常温下(NH4)2SO3溶液的酸碱性并说明判断依据:
(6)通过电化学方法可有效实现以CO2和水为原料合成甲酸,其原理示意图图所示,则A极的电极反应式为

您最近一年使用:0次
名校
3 . 丙烯是石油化工的基本原料之一,在精细化学品合成、环保、医学科学和基础研究等领域应用广泛。回答下列问题:
(1)丙烷脱氢制丙烯过程的主反应为:
反应①:
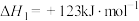 。
。
副反应有:
反应②:
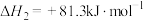
反应③: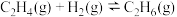
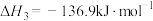
反应④: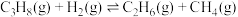

则
___________  。
。
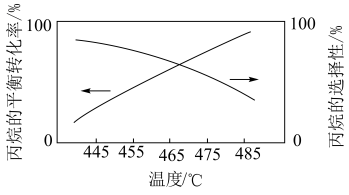
(2)已知:在纤维状BPO4/SiO2催化剂作用下,丙烷在一定温度下会发生(1)中反应①和反应②。丙烷的平衡转化率和丙烯的选择性随温度的变化如图所示,随着温度升高,丙烯的选择性降低的可能原因有___________ (答一条即可);丙烷的平衡转化率增大的原因是___________ 。 下,向
下,向 恒容密闭容器中充入
恒容密闭容器中充入 ,发生反应
,发生反应 ,经过
,经过 达到平衡状态,测得平衡时气体压强是开始时的1.2倍。
达到平衡状态,测得平衡时气体压强是开始时的1.2倍。
①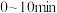 内丙烯的平均反应速率
内丙烯的平均反应速率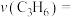
___________  。
。
②保持其他条件不变,反应达平衡后再向容器中充入少量 ,则
,则 的平衡转化率
的平衡转化率___________ (填“增大”“减小”或“不变”)。
③已知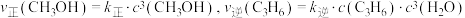 ,其中
,其中 、
、 为速率常数,只与温度有关,则
为速率常数,只与温度有关,则 时,
时,
___________ (结果保留两位有效数字)。
(4)在 、压强恒定为
、压强恒定为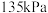 时,向有催化剂的密闭容器中按体积比
时,向有催化剂的密闭容器中按体积比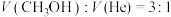 充入
充入 和
和 ,发生反应
,发生反应 ,达到平衡状态时
,达到平衡状态时 的转化率为
的转化率为 ,则该温度下,反应的平衡常数
,则该温度下,反应的平衡常数
___________  (用平衡分压代替平衡浓度计算,分压=总压
(用平衡分压代替平衡浓度计算,分压=总压 物质的量分数)。
物质的量分数)。
(1)丙烷脱氢制丙烯过程的主反应为:
反应①:

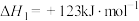 。
。副反应有:
反应②:

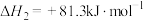
反应③:
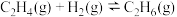
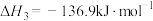
反应④:
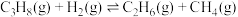

则

 。
。(2)已知:在纤维状BPO4/SiO2催化剂作用下,丙烷在一定温度下会发生(1)中反应①和反应②。丙烷的平衡转化率和丙烯的选择性随温度的变化如图所示,随着温度升高,丙烯的选择性降低的可能原因有
 下,向
下,向 恒容密闭容器中充入
恒容密闭容器中充入 ,发生反应
,发生反应 ,经过
,经过 达到平衡状态,测得平衡时气体压强是开始时的1.2倍。
达到平衡状态,测得平衡时气体压强是开始时的1.2倍。①
 内丙烯的平均反应速率
内丙烯的平均反应速率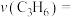
 。
。②保持其他条件不变,反应达平衡后再向容器中充入少量
 ,则
,则 的平衡转化率
的平衡转化率③已知
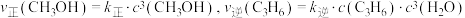 ,其中
,其中 、
、 为速率常数,只与温度有关,则
为速率常数,只与温度有关,则 时,
时,
(4)在
 、压强恒定为
、压强恒定为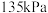 时,向有催化剂的密闭容器中按体积比
时,向有催化剂的密闭容器中按体积比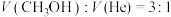 充入
充入 和
和 ,发生反应
,发生反应 ,达到平衡状态时
,达到平衡状态时 的转化率为
的转化率为 ,则该温度下,反应的平衡常数
,则该温度下,反应的平衡常数
 (用平衡分压代替平衡浓度计算,分压=总压
(用平衡分压代替平衡浓度计算,分压=总压 物质的量分数)。
物质的量分数)。
您最近一年使用:0次
4 . 低碳循环”引起各国的高度重视,对CO2回收或加以利用对缓解温室效应和能源危机意义十分重大,已成为科学家研究的重要课题,回答下列问题:
(1)已知:①CO(g)+H2O(g) H2(g)+CO2(g) △H=-41kJ•mol-1
H2(g)+CO2(g) △H=-41kJ•mol-1
②C(s)+2H2(g) CH4(g) △H=-72kJ•mol-1
CH4(g) △H=-72kJ•mol-1
③2CO(g) C(s)+CO2(g) △H=-171kJ•mol-1
C(s)+CO2(g) △H=-171kJ•mol-1
写出H2与CO2反应生成H2O(g)和CH4的热化学方程式:___________ 。
(2)以CO2与NH3为原料可以合成尿素[CO(NH2)2]。在尿素合成塔中的主要反应可表示为2NH3(g)+CO2(g) CO(NH2)2(s)+H2O(g) △H<0。
CO(NH2)2(s)+H2O(g) △H<0。
①T℃时,若向容积为2L的密闭容器中加入3mol NH3和1mol CO2,达到平衡时,容器内压强为开始时的0.75倍。则该反应平衡常数K=___________ 。若保持其他条件不变,向该容器中再加入1mol CO2和1mol H2O,NH3的转化率将___________ (填“增大”、“减小”或“不变”)。以下有利于提高NH3平衡转化率的条件有___________ (填标号)。
a.恒温低压 b.低温高压 c.恒压低温 d.高温低压
②合成尿素的正、逆反应的平衡常数(K)与温度(T)的关系如图甲所示。表示正反应平衡常数的曲线为___________ (填“a”或“b”);理由为___________ 。

(3)酸性条件下,对CO2进行电解可制取工业原料乙烯,其工作的原理如图乙所示,电解时,b极的电极反应式为___________ 。

(1)已知:①CO(g)+H2O(g)
 H2(g)+CO2(g) △H=-41kJ•mol-1
H2(g)+CO2(g) △H=-41kJ•mol-1②C(s)+2H2(g)
 CH4(g) △H=-72kJ•mol-1
CH4(g) △H=-72kJ•mol-1③2CO(g)
 C(s)+CO2(g) △H=-171kJ•mol-1
C(s)+CO2(g) △H=-171kJ•mol-1写出H2与CO2反应生成H2O(g)和CH4的热化学方程式:
(2)以CO2与NH3为原料可以合成尿素[CO(NH2)2]。在尿素合成塔中的主要反应可表示为2NH3(g)+CO2(g)
 CO(NH2)2(s)+H2O(g) △H<0。
CO(NH2)2(s)+H2O(g) △H<0。①T℃时,若向容积为2L的密闭容器中加入3mol NH3和1mol CO2,达到平衡时,容器内压强为开始时的0.75倍。则该反应平衡常数K=
a.恒温低压 b.低温高压 c.恒压低温 d.高温低压
②合成尿素的正、逆反应的平衡常数(K)与温度(T)的关系如图甲所示。表示正反应平衡常数的曲线为

(3)酸性条件下,对CO2进行电解可制取工业原料乙烯,其工作的原理如图乙所示,电解时,b极的电极反应式为

您最近一年使用:0次
名校
解题方法
5 . “绿水青山就是金山银山”,运用化学反应原理研究碳、 氮、硫的单质及其化合物的反应对缓解环境污染、能源危机具有重要意义。
I.甲醇是一种可再生能源,具有广泛的开发和应用前景:工业上一般以CO和H2为原料合成 甲醇,该反应的热化学方程式为:CO(g)+2H2(g)=CH3OH(g) ∆H1=-116kJ•mol-1
(1)已知:CO(g)+ O2(g)=CO2(g) ∆H2=-283kJ•mol-1
O2(g)=CO2(g) ∆H2=-283kJ•mol-1
H2(g)+ O2(g)=H2O(g) ∆H3=-242kJ•mol-1
O2(g)=H2O(g) ∆H3=-242kJ•mol-1
则表示1mol气态甲醇完全燃烧生成CO2和水蒸气时的热化学方程式为___________ 。
(2)下列措施中有利于增大反应:CO(g)+2H2(g) CH3OH(g)的反应速率且利于反应正向进行的是
CH3OH(g)的反应速率且利于反应正向进行的是___________ 。
a.随时将CH3OH与反应混合物分离 b.降低反应温度
c.增大体系压强 d.使用高效催化剂
(3)一定条件下向2L的密闭容器中充入1molCO和2molH2发生反应:CO(g)+2H2(g) CH3OH(g),CO的平衡转化率与温度、压强的关系如图所示:
CH3OH(g),CO的平衡转化率与温度、压强的关系如图所示:
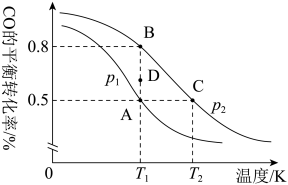
①该可逆反应的ΔH___________ 0(填“>”或“<”),A、B、C三点平衡常数KA、KB、KC的大小关系是___________ ;
②压强p1___________ p2(填“>”“<”或“=”),若p2=100kPa,则B点的Kp=___________ kPa-2(Kp为以分压表示的平衡常数;分压=总压×物质的量分数)
③在T1和p1条件下,由D点到A点过程中,正、逆反应速率之间的关系:υ正___________ υ逆 (填“>”“<”或“=”)。
II.在一定体积的密闭容器中,进行如下化学反应:CO2(g)+H2(g) CO(g)+H2O(g)其化学平衡常数K和温度t的关系如下:
CO(g)+H2O(g)其化学平衡常数K和温度t的关系如下:
回答下列问题:
(4)某温度下,平衡浓度符合下式:c(CO2)•c(H2)=c(CO)•c(H2O),试判断此时的温度为___________ ℃。
(5)800℃时,发生上述反应,某一时刻测得容器内物质的浓度分别为:CO2为2mol•L-1,H2为1.5mol•L-1,CO为1mol•L-1,H2O为3mol•L-1,则此时反应向___________ (填“正反应方向”或“逆反应方向”)进行。
I.甲醇是一种可再生能源,具有广泛的开发和应用前景:工业上一般以CO和H2为原料合成 甲醇,该反应的热化学方程式为:CO(g)+2H2(g)=CH3OH(g) ∆H1=-116kJ•mol-1
(1)已知:CO(g)+
 O2(g)=CO2(g) ∆H2=-283kJ•mol-1
O2(g)=CO2(g) ∆H2=-283kJ•mol-1H2(g)+
 O2(g)=H2O(g) ∆H3=-242kJ•mol-1
O2(g)=H2O(g) ∆H3=-242kJ•mol-1则表示1mol气态甲醇完全燃烧生成CO2和水蒸气时的热化学方程式为
(2)下列措施中有利于增大反应:CO(g)+2H2(g)
 CH3OH(g)的反应速率且利于反应正向进行的是
CH3OH(g)的反应速率且利于反应正向进行的是a.随时将CH3OH与反应混合物分离 b.降低反应温度
c.增大体系压强 d.使用高效催化剂
(3)一定条件下向2L的密闭容器中充入1molCO和2molH2发生反应:CO(g)+2H2(g)
 CH3OH(g),CO的平衡转化率与温度、压强的关系如图所示:
CH3OH(g),CO的平衡转化率与温度、压强的关系如图所示:
①该可逆反应的ΔH
②压强p1
③在T1和p1条件下,由D点到A点过程中,正、逆反应速率之间的关系:υ正
II.在一定体积的密闭容器中,进行如下化学反应:CO2(g)+H2(g)
 CO(g)+H2O(g)其化学平衡常数K和温度t的关系如下:
CO(g)+H2O(g)其化学平衡常数K和温度t的关系如下:| t℃ | 700 | 800 | 830 | 1000 | 1200 |
| K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
回答下列问题:
(4)某温度下,平衡浓度符合下式:c(CO2)•c(H2)=c(CO)•c(H2O),试判断此时的温度为
(5)800℃时,发生上述反应,某一时刻测得容器内物质的浓度分别为:CO2为2mol•L-1,H2为1.5mol•L-1,CO为1mol•L-1,H2O为3mol•L-1,则此时反应向
您最近一年使用:0次
名校
6 . 回答下列问题:
(1)已知室温下CO的燃烧热为283 kJ/mol,则CO的燃烧热的热化学方程式为___________________________________ 。
(2)工业上利用CO和H2合成清洁能源CH3OH,其反应为:CO(g)+2H2(g) CH3OH(g) ΔH=-116kJ/mol
CH3OH(g) ΔH=-116kJ/mol
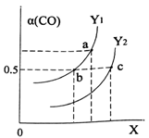
如图表示CO的平衡转化率(α)随温度和压强变化的示意图。X表示的是_____________ ,Y1_____ Y2(填“<”、“=”、“>”)。
(3)合成甲醇的反应原理为:CO2(g)+3H2(g) CH3OH(g)+H2O(g),在1L的密闭容器中,充入1mol CO2和3mol H2,在500℃下发生反应,测得CO2(g)和CH3OH(g)的浓度随时间变化如图所示。
CH3OH(g)+H2O(g),在1L的密闭容器中,充入1mol CO2和3mol H2,在500℃下发生反应,测得CO2(g)和CH3OH(g)的浓度随时间变化如图所示。
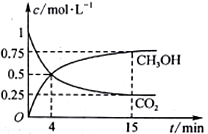
①反应进行到4min时,v(正)____ v(逆)(填“>”“<”或“=”)。0~4min,CO2的平均反应速率v(CO2)=____________ mol·L−1·min−1。
②该温度下平衡常数为_____________ 。
③下列能说明该反应已达到平衡状态的是______________ 。
A.v正(CH3OH)=3v逆(H2)
B.CO2、H2、CH3OH和H2O浓度之比为1∶3∶1∶1
C.恒温恒压下,气体的体积不再变化
D.恒温恒容下,气体的密度不再变化
(4)为提高燃料的能量利用率,常将其设计为燃料电池。某电池以甲烷为燃料,空气为氧化剂,KOH溶液为电解质溶液,以具有催化作用和导电性能的稀土金属为电极。写出该燃料电池的负极反应式:_____________________________ 。
(1)已知室温下CO的燃烧热为283 kJ/mol,则CO的燃烧热的热化学方程式为
(2)工业上利用CO和H2合成清洁能源CH3OH,其反应为:CO(g)+2H2(g)
 CH3OH(g) ΔH=-116kJ/mol
CH3OH(g) ΔH=-116kJ/mol如图表示CO的平衡转化率(α)随温度和压强变化的示意图。X表示的是

(3)合成甲醇的反应原理为:CO2(g)+3H2(g)
 CH3OH(g)+H2O(g),在1L的密闭容器中,充入1mol CO2和3mol H2,在500℃下发生反应,测得CO2(g)和CH3OH(g)的浓度随时间变化如图所示。
CH3OH(g)+H2O(g),在1L的密闭容器中,充入1mol CO2和3mol H2,在500℃下发生反应,测得CO2(g)和CH3OH(g)的浓度随时间变化如图所示。
①反应进行到4min时,v(正)
②该温度下平衡常数为
③下列能说明该反应已达到平衡状态的是
A.v正(CH3OH)=3v逆(H2)
B.CO2、H2、CH3OH和H2O浓度之比为1∶3∶1∶1
C.恒温恒压下,气体的体积不再变化
D.恒温恒容下,气体的密度不再变化
(4)为提高燃料的能量利用率,常将其设计为燃料电池。某电池以甲烷为燃料,空气为氧化剂,KOH溶液为电解质溶液,以具有催化作用和导电性能的稀土金属为电极。写出该燃料电池的负极反应式:
您最近一年使用:0次
2018-12-29更新
|
1246次组卷
|
4卷引用:甘肃省静宁县第一中学2021届高三上学期第四次模拟考试化学试题
甘肃省静宁县第一中学2021届高三上学期第四次模拟考试化学试题【全国百强校】青海省西宁市第四高级中学2019届高三上学期第四次模拟考试理科综合化学试题【市级联考】陕西省榆林市2019届高三下学期模拟考试化学试题(已下线)【南昌新东方】2019 南大附中 高二上 期中
名校
7 . 工业上用CO和H2合成CH3OH:CO(g)+2H2(g) CH3OH(g)。反应的平衡常数如下表:
CH3OH(g)。反应的平衡常数如下表:
下列说法正确的是
 CH3OH(g)。反应的平衡常数如下表:
CH3OH(g)。反应的平衡常数如下表:| 温度/℃ | 0 | 100 | 200 | 300 | 400 |
| 平衡常数 | 667 | 13 | 1.9x10-2 | 2.4×10-4 | 1×10-5 |
下列说法正确的是
| A.该反应的△H>0 |
| B.加压、增大H2浓度和加入催化剂都能提高CO的转化率 |
| C.工业上采用5×103 kPa和250℃的条件,其原因是原料气的转化率高 |
| D.t℃时,向2L密闭容器中投入0.2 mol CO和0.4 mol H2,平衡时CO转化率为50%,则该温度时反应的平衡常数的数值为100 |
您最近一年使用:0次
2018-12-15更新
|
419次组卷
|
4卷引用:甘肃省民乐县第一中学2021-2022学年上学期高三第二次诊断(12月)考试化学试题
甘肃省民乐县第一中学2021-2022学年上学期高三第二次诊断(12月)考试化学试题北京市北京师范大学附属中学2022-2023 学年高三上学期月考2化学试题【全国百强校】北京市北京四中2019届高三上学期期中考试化学试题(已下线)北京市第四中学2021-2022学年高三上学期期中考试化学试题
10-11高三·甘肃·阶段练习
8 . 能源问题是人类社会面临的重大课题,甲醇是未来重要的能源物质之一。
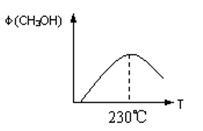
(1)合成甲醇的反应为:CO(g)+2H2(g) CH3OH(g);下图表示某次合成实验过程中甲醇的体积分数φ(CH3OH)与反应温度的关系曲线,则该反应的△H
CH3OH(g);下图表示某次合成实验过程中甲醇的体积分数φ(CH3OH)与反应温度的关系曲线,则该反应的△H__________ 0。(填“>、<或=”下同)
(2)在某温度下,向一个容积不变的密闭容器中通入2.5mol CO和7.5mol H2,达到平衡时CO的转化率为90%,此时容器内的压强为开始时的__________ 倍。
(3)利用甲醇燃料电池设计如图所示的装置:
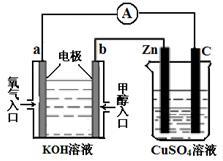
①则该装置中b为____________ 极,写出装置中电解池内发生反应的离子方程式_______________________ 。
②当锌片的质量变化为12.8 g时,a极上消耗的O2 在标准状况下的体积为___________ L。
(4)低碳经济是以低能耗、低污染、低排放为基础的经济模式,其中一种技术是将CO2转化成有机物实现碳循环。如:
2CO2(g)+2H2O(l)= C2H4(g)+3O2(g) ΔH=+1411.0 kJ/mol
2CO2(g)+3H2O(l)= C2H5OH(1)+3O2(g) ΔH=+1366.8 kJ/mol
则由乙烯水化制乙醇反应的热化学方程式____________________________________ 。
(1)合成甲醇的反应为:CO(g)+2H2(g)
 CH3OH(g);下图表示某次合成实验过程中甲醇的体积分数φ(CH3OH)与反应温度的关系曲线,则该反应的△H
CH3OH(g);下图表示某次合成实验过程中甲醇的体积分数φ(CH3OH)与反应温度的关系曲线,则该反应的△H
(2)在某温度下,向一个容积不变的密闭容器中通入2.5mol CO和7.5mol H2,达到平衡时CO的转化率为90%,此时容器内的压强为开始时的
(3)利用甲醇燃料电池设计如图所示的装置:

①则该装置中b为
②当锌片的质量变化为12.8 g时,a极上消耗的O2 在标准状况下的体积为
(4)低碳经济是以低能耗、低污染、低排放为基础的经济模式,其中一种技术是将CO2转化成有机物实现碳循环。如:
2CO2(g)+2H2O(l)= C2H4(g)+3O2(g) ΔH=+1411.0 kJ/mol
2CO2(g)+3H2O(l)= C2H5OH(1)+3O2(g) ΔH=+1366.8 kJ/mol
则由乙烯水化制乙醇反应的热化学方程式
您最近一年使用:0次
14-15高三上·甘肃兰州·期中
9 . 汽车作为一种现代交通工具正在进入千家万户,汽车尾气中含有CO、NOx等有毒气体,其污染问题也成为当今社会急需解决的问题。
(1)汽车发动机工作时会引发N2和O2反应,其能量变化示意图如图:

则该反应的热化学方程式为_____________________________ 。
(2)对汽车加装尾气净化装置,可使CO、NOx有毒气体相互反应转化为无毒气体。
2xCO+2NOx ="=" 2xCO2+N2,当转移电子物质的量为0.4x mol时,该反应生成标准状况下的N2体积_____________________ L。
(3)一氧化碳是一种用途相当广泛的化工基础原料。可以还原金属氧化物,还可以用来合成很多有机物如甲醇等。在压强为0.1 MPa条件下,将a mol CO与3a mol H2的混合气体在催化剂作用下反应生成甲醇: CO(g)+2H2(g) CH3OH(g);△H= -b kJ•mol-1
CH3OH(g);△H= -b kJ•mol-1
①该反应的平衡常数表达式为_____________________________ 。
②若容器容积不变,下列措施可增加甲醇产率的是______________
③经测定不同温度下该反应的平衡常数如下:
若某时刻、250℃测得该反应的反应物与生成物的浓度为c(CO) =0.4 mol/L、c(H2)=0.4 mol/L、c(CH3OH)=0.8 mol·L-1, 则此时v正___________ v逆(填>、<或=)。
(4)甲醇是重要的基础化工原料,又是一种新型的燃料,最近有人制造了一种燃料电池,一个电极通入空气,另一个电极加入甲醇,电池的电解质是掺杂了Y2O3的ZrO2晶体,它在高温下能传导O2-离子。该电池的正极反应式为_____________________________ 。电池工作时,固体电解质里的O2-向_______ 极移动。
(1)汽车发动机工作时会引发N2和O2反应,其能量变化示意图如图:

则该反应的热化学方程式为
(2)对汽车加装尾气净化装置,可使CO、NOx有毒气体相互反应转化为无毒气体。
2xCO+2NOx ="=" 2xCO2+N2,当转移电子物质的量为0.4x mol时,该反应生成标准状况下的N2体积
(3)一氧化碳是一种用途相当广泛的化工基础原料。可以还原金属氧化物,还可以用来合成很多有机物如甲醇等。在压强为0.1 MPa条件下,将a mol CO与3a mol H2的混合气体在催化剂作用下反应生成甲醇: CO(g)+2H2(g)
 CH3OH(g);△H= -b kJ•mol-1
CH3OH(g);△H= -b kJ•mol-1①该反应的平衡常数表达式为
②若容器容积不变,下列措施可增加甲醇产率的是
| A.升高温度 | B.将CH3OH(g)从体系中分离 |
| C.充入He,使体系总压强增大 | D.再充入1 mol CO和3 mol H2 |
③经测定不同温度下该反应的平衡常数如下:
| 温度(℃) | 250 | 300 | 350 |
| K | 2.041 | 0.270 | 0.012 |
若某时刻、250℃测得该反应的反应物与生成物的浓度为c(CO) =0.4 mol/L、c(H2)=0.4 mol/L、c(CH3OH)=0.8 mol·L-1, 则此时v正
(4)甲醇是重要的基础化工原料,又是一种新型的燃料,最近有人制造了一种燃料电池,一个电极通入空气,另一个电极加入甲醇,电池的电解质是掺杂了Y2O3的ZrO2晶体,它在高温下能传导O2-离子。该电池的正极反应式为
您最近一年使用:0次
2016-12-09更新
|
83次组卷
|
4卷引用:2015届甘肃省部分普高高三2月联考化学试卷
2015届甘肃省部分普高高三2月联考化学试卷(已下线)2015届甘肃省兰州一中高三上学期期中考试理综化学试卷2015届宁夏银川市第九中学高三上学期第三次月考理综试卷【懂做原理题】2020届高三化学选修4二轮专题练—— 浓度商及其应用【精编23题】



