名校
解题方法
1 . 25℃时,向40 mL 0.05 mol/L的 溶液中一次性加入10 mL 0.15 mol/L的KSCN溶液(体积变化忽略不计),发生反应
溶液中一次性加入10 mL 0.15 mol/L的KSCN溶液(体积变化忽略不计),发生反应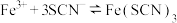 ,混合溶液中
,混合溶液中 与反应时间(t)的变化如图所示。下列说法不正确的是
与反应时间(t)的变化如图所示。下列说法不正确的是
 溶液中一次性加入10 mL 0.15 mol/L的KSCN溶液(体积变化忽略不计),发生反应
溶液中一次性加入10 mL 0.15 mol/L的KSCN溶液(体积变化忽略不计),发生反应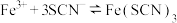 ,混合溶液中
,混合溶液中 与反应时间(t)的变化如图所示。下列说法不正确的是
与反应时间(t)的变化如图所示。下列说法不正确的是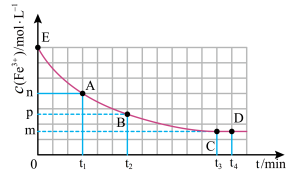
A. 时向溶液中加入50 mL 0.1 mol/L KCl溶液,平衡逆向移动。 时向溶液中加入50 mL 0.1 mol/L KCl溶液,平衡逆向移动。 |
| B.E点对应的坐标为(0,0.04) |
C.在25℃时该反应的平衡常数为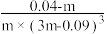 |
D. 分钟后加入少量KSCN固体,溶液红色加深,该现象可以证明 分钟后加入少量KSCN固体,溶液红色加深,该现象可以证明 与SCN-的反应是可逆反应 与SCN-的反应是可逆反应 |
您最近一年使用:0次
2023-12-12更新
|
232次组卷
|
3卷引用:北京市第十二中学2023-2024学年高二上学期期中考试化学试题
名校
2 . 小组同学探究盐溶液对反应 (血红色)的影响。将
(血红色)的影响。将
 的
的 溶液与
溶液与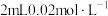 的
的 溶液混合,分别加入等量的试剂①~④,测得平衡后体系的透光率如下图所示。
溶液混合,分别加入等量的试剂①~④,测得平衡后体系的透光率如下图所示。
ii. (黄色)
(黄色)
iii.已知 对实验无影响
对实验无影响
下列说法不正确的是
 (血红色)的影响。将
(血红色)的影响。将
 的
的 溶液与
溶液与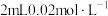 的
的 溶液混合,分别加入等量的试剂①~④,测得平衡后体系的透光率如下图所示。
溶液混合,分别加入等量的试剂①~④,测得平衡后体系的透光率如下图所示。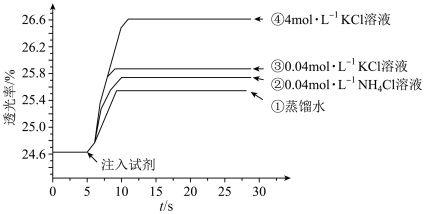
ii.
 (黄色)
(黄色)iii.已知
 对实验无影响
对实验无影响下列说法不正确的是
A.注入试剂①后溶液透光率增大,证明 逆向移动 逆向移动 |
B.透光率③比②高,可能是阳离子种类或溶液 不同导致的 不同导致的 |
C.透光率④比③高,可能发生了反应 |
D.若要证明试剂③中 对平衡体系有影响,还应使用 对平衡体系有影响,还应使用 的 的 溶液进行对照实验 溶液进行对照实验 |
您最近一年使用:0次
2023-11-21更新
|
362次组卷
|
7卷引用:北京市对外经济贸易大学附属中学2022-2023学年高二上学期期中考试化学试题
名校
3 . 小组同学探究盐溶液对反应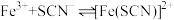 (血红色)的影响。将2mL0.01mol/LFeCl3的溶液与2mL0.02mol/L的KSCN溶液混合,分别加入等体积的试剂①~④,测得平衡后体系的透光率如下图所示。
(血红色)的影响。将2mL0.01mol/LFeCl3的溶液与2mL0.02mol/L的KSCN溶液混合,分别加入等体积的试剂①~④,测得平衡后体系的透光率如下图所示。
已知:ⅰ.溶液血红色越深,透光率越小,其它颜色对透光率的影响可忽略。
ⅱ. (黄色)
(黄色)
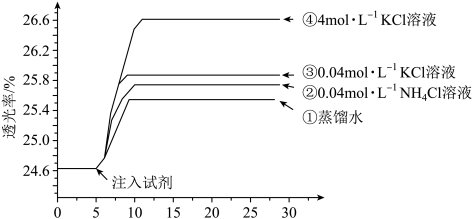
下列说法不正确的是
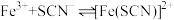 (血红色)的影响。将2mL0.01mol/LFeCl3的溶液与2mL0.02mol/L的KSCN溶液混合,分别加入等体积的试剂①~④,测得平衡后体系的透光率如下图所示。
(血红色)的影响。将2mL0.01mol/LFeCl3的溶液与2mL0.02mol/L的KSCN溶液混合,分别加入等体积的试剂①~④,测得平衡后体系的透光率如下图所示。已知:ⅰ.溶液血红色越深,透光率越小,其它颜色对透光率的影响可忽略。
ⅱ.
 (黄色)
(黄色)
下列说法不正确的是
A.注入试剂①后溶液透光率增大,一定是由于 平衡逆向移动引起的 平衡逆向移动引起的 |
| B.透光率③比②高,可能是阳离子种类或溶液pH导致的 |
C.透光率④比③高,可能发生了反应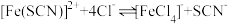 |
D.若要证明试剂③中Cl—对平衡体系有影响,还应使用与试剂③等体积的0.04mol/L的KNO3溶液进行对比实验(已知NO 对实验无影响) 对实验无影响) |
您最近一年使用:0次
2023-01-13更新
|
651次组卷
|
9卷引用:北京交通大学附属中学2022-2023学年高二上学期期中考试化学试题
名校
4 . 某同学为探究浓度对化学平衡的影响设计了如下实验:已知:
反应i:
反应ii: (黄色)
(黄色)不正确 的是
反应i:

反应ii:
 (黄色)
(黄色)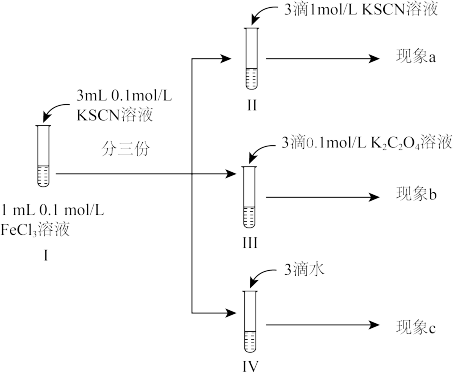
| A.观察到现象a比现象c中红色更深,即可证明增加反应物浓度,反应i平衡正向移动 |
| B.观察到现象b比现象c中红色浅,即可说明反应i平衡逆向移动,反应ⅱ平衡正向移动 |
| C.进行IV对比实验的主要目的是防止出于溶液体积变化引起各离子浓度变化而干扰实验结论得出 |
D.III中溶液一开始无 ,12小时后检出 ,12小时后检出 ,可能的原因是 ,可能的原因是 还原 还原 的速率较慢,反应ⅱ速率较快 的速率较慢,反应ⅱ速率较快 |
您最近一年使用:0次
2023-01-06更新
|
342次组卷
|
4卷引用:北京市人大附中2023-2024学年高二下学期期中考试化学试题
真题
名校
5 . 关于反应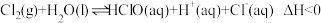 ,达到平衡后,下列说法
,达到平衡后,下列说法不正确 的是
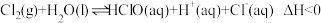 ,达到平衡后,下列说法
,达到平衡后,下列说法A.升高温度,氯水中的 减小 减小 |
B.氯水中加入少量醋酸钠固体,上述平衡正向移动, 增大 增大 |
C.取氯水稀释,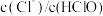 增大 增大 |
D.取两份氯水,分别滴加 溶液和淀粉KI溶液,若前者有白色沉淀,后者溶液变蓝色,可以证明上述反应存在限度 溶液和淀粉KI溶液,若前者有白色沉淀,后者溶液变蓝色,可以证明上述反应存在限度 |
您最近一年使用:0次
2022-06-14更新
|
7554次组卷
|
28卷引用:安徽省芜湖市安徽师范大学附属中学2022-2023学年高二上学期期中考查化学试题
安徽省芜湖市安徽师范大学附属中学2022-2023学年高二上学期期中考查化学试题(已下线)【2022】【高二上】【期中考】【高中化学】592022年6月浙江省普通高校招生选考化学试题(已下线)2022年浙江省6月高考真题变式题11-20(已下线)考点22 化学平衡状态与化学平衡移动-备战2023年高考化学一轮复习考点帮(全国通用)(已下线)第12讲 富集在海水中的元素——卤素(练)-2023年高考化学一轮复习讲练测(全国通用)(已下线)第29练 化学反应的调控-2023年高考化学一轮复习小题多维练(全国通用)(已下线)第10讲 氯及其化合物(讲)-2023年高考化学一轮复习讲练测(新教材新高考)(已下线)第21讲 化学平衡状态 化学平衡的移动(练)-2023年高考化学一轮复习讲练测(全国通用)江西省新余市第一中学2022-2023学年高二上学期开学考试化学试题(已下线)第19讲 化学平衡(讲)-2023年高考化学一轮复习讲练测(新教材新高考)(已下线)易错点09 氯元素及其化合物-备战2023年高考化学考试易错题(已下线)易错点22 化学反应平衡和移动-备战2023年高考化学考试易错题(已下线)专题20 溶液中粒子浓度大小的比较-2023年高考化学毕业班二轮热点题型归纳与变式演练(新高考专用)(已下线)专题卷11 化学反应速率与化学平衡归因分析-【小题小卷】冲刺2023年高考化学小题限时集训(新高考专用)(已下线)回归教材重难点09 盘点溶液中的“四大”平衡-【查漏补缺】2023年高考化学三轮冲刺过关(新高考专用)模块综合检测卷2(已下线)专题08 反应速率与化学平衡-2023年高考化学真题题源解密(新高考专用)(已下线)考点22 化学平衡状态与化学平衡(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(全国通用)第三章 水溶液中的离子反应与平衡 第一节 电离平衡浙江省余姚中学2023-2024学年高二上学期第一次月考化学试题(已下线)第2讲 化学平衡状态及化学平衡的移动(已下线)考点2 化学平衡 (核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(新高考专用)陕西省西安市2023-2024学年高二上学期期末化学测试卷B广东省江门市第一中学2023-2024学年高二上学期第二次段考化学(选考)试题上海市建平世纪中学2023-2024学年高二上学期阶段练习二 化学(等级)试题海南省海桂中学2023-2024学年高二上学期12月教学检测(三)化学试题2024届海南省海南中学高三下学期第一次模拟化学试题
名校
解题方法
6 . 铁元素及其化合物在生活生产中有广泛的用途。回答下列问题:
(1)Fe3+与SCN-的反应常用来检验Fe3+的存在: Fe3+ + 3SCN- Fe(SCN)3
Fe(SCN)3
若溶液中含有Fe3+,则加入KSCN溶液后的现象为_________ 向加入KSCN后的混合溶液中再加入少量NaOH固体,观察到的现象是_____________ ,产生该现象的原因是________________ 。
(2)向FeSO4溶液中滴入NaOH溶液,会观察到先产生白色沉淀,后迅速变为灰绿色,久置后变为红褐色,用化学方程式说明产生该现象的原因__________________ 。
(3)FeCl3溶液常被用作蚀刻剂腐蚀印刷电路板: 2Fe3++ Cu==2Fe2+ + Cu2+在过量FeCl3溶液腐蚀印刷电路板后的溶液中,加入过量铁粉,依次发生______ 、________ 两个反应(写离子方程式),若最后溶液中有固体剩余,则溶液中不可能含有的离子是____ 。
(4)FeCl2溶液在空气中容易被氧化,0.1 mol· L-1的FeCl2溶液暴露在空气中,20min 后,Fe2+的浓度变为0.05 mol· L-1,则20 min内,以Fe2+ 表示的平均反应速率为_____________ 若要验证该溶液中Fe2+未被完全氧化,则可以需要加入_____ 若出现_________ 现象,则证明Fe2+未被完全氧化。
(5)下列有关铁及其化合物的说法正确的是________
A.铁是第四周期第VIIIB族元素
B.亚铁盐只有还原性,没有氧化性
C.铁粉和铜粉的混合物可用磁铁吸引的方法分离
D.工业上通常采用电解法来冶炼单质铁
E.Fe3O4是一种纯净物
F.铁粉和氧化铝的混合物是一种铝热剂
(1)Fe3+与SCN-的反应常用来检验Fe3+的存在: Fe3+ + 3SCN-
 Fe(SCN)3
Fe(SCN)3 若溶液中含有Fe3+,则加入KSCN溶液后的现象为
(2)向FeSO4溶液中滴入NaOH溶液,会观察到先产生白色沉淀,后迅速变为灰绿色,久置后变为红褐色,用化学方程式说明产生该现象的原因
(3)FeCl3溶液常被用作蚀刻剂腐蚀印刷电路板: 2Fe3++ Cu==2Fe2+ + Cu2+在过量FeCl3溶液腐蚀印刷电路板后的溶液中,加入过量铁粉,依次发生
(4)FeCl2溶液在空气中容易被氧化,0.1 mol· L-1的FeCl2溶液暴露在空气中,20min 后,Fe2+的浓度变为0.05 mol· L-1,则20 min内,以Fe2+ 表示的平均反应速率为
(5)下列有关铁及其化合物的说法正确的是
A.铁是第四周期第VIIIB族元素
B.亚铁盐只有还原性,没有氧化性
C.铁粉和铜粉的混合物可用磁铁吸引的方法分离
D.工业上通常采用电解法来冶炼单质铁
E.Fe3O4是一种纯净物
F.铁粉和氧化铝的混合物是一种铝热剂
您最近一年使用:0次
名校
解题方法
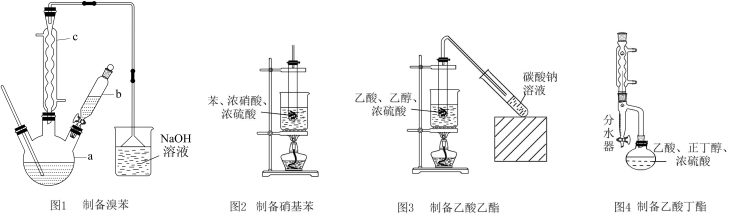
7 . 以下为有机物的制备实验装置。下列相关说法错误的是

| A.图1右侧烧杯中观察到淡黄色沉淀,可证明制备溴苯的反应为取代反应 |
| B.图2所制得的硝基苯因溶解有NO2略带黄色,可加入NaOH溶液,分液除去 |
| C.图3导气管口应在右侧试管中Na2CO3溶液液面上方,以防止倒吸 |
| D.图4球形冷凝管可冷凝回流提高产率,分水器分出生成的水可提高反应转化率 |
您最近一年使用:0次
2022-05-10更新
|
462次组卷
|
2卷引用:山东省淄博第四中学2021-2022学年高二下学期学分认定(期中) 化学试题
名校
8 . 下列关于实验内容和实验目的说法正确的是
| 编号 | 实验内容 | 实验目的 |
| A | 向含有酚酞的 溶液中加入少量 溶液中加入少量 固体,溶液红色变浅 固体,溶液红色变浅 | 证明 溶液中存在水解平衡 溶液中存在水解平衡 |
| B | 室温下,用 试纸测定浓度为 试纸测定浓度为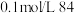 消毒液和 消毒液和 溶液的 溶液的 | 比较 和 和 的酸性强弱 的酸性强弱 |
| C | 用 注射器吸入 注射器吸入 和 和 的混合气体,将细管端用橡胶塞封闭,然后把注射器的活塞往外拉,可观察到混合气体的颜色先变浅后变深 的混合气体,将细管端用橡胶塞封闭,然后把注射器的活塞往外拉,可观察到混合气体的颜色先变浅后变深 | 证明对有气体参加的可逆反应,改变压强一定会使平衡发生移动 |
| D | 向 溶液中滴2滴 溶液中滴2滴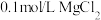 溶液,产生白色沉淀后,再滴加2滴 溶液,产生白色沉淀后,再滴加2滴 溶液,又生成红褐色沉淀 溶液,又生成红褐色沉淀 | 证明在相同温度下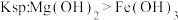 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2022-05-04更新
|
219次组卷
|
3卷引用:浙江省北斗联盟2021-2022学年高二下学期期中联考化学试题
名校
9 . 将5 mL 0.005 mol·L-1 FeCl3溶液和5 mL 0.015 mol·L-1 KSCN溶液混合,达到平衡后呈红色,再将混合液分为5份,分别进行如下实验:
下列说法不正确的是
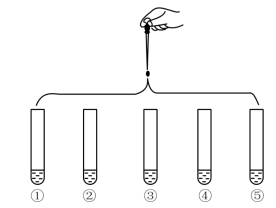 | 实验①:滴加四滴水,振荡 |
| 实验②:滴加四滴饱和的FeCl3溶液,振荡 | |
| 实验③:滴加四滴1 mol·L-1KCl溶液,振荡 | |
| 实验④:滴加四滴1 mol·L-1KSCN溶液,振荡 | |
| 实验⑤:滴加四滴1 mol·L-1NaOH 溶液,振荡 |
| A.对比实验①和②,为了证明增大反应物浓度,平衡正向移动 |
| B.对比实验①和③,为了证明增大生成物浓度,平衡逆向移动 |
| C.对比实验①和④,为了证明增大反应物浓度,平衡正向移动 |
| D.对比实验①和⑤,为了证明减小反应物浓度,平衡逆向移动 |
您最近一年使用:0次
2021-10-13更新
|
215次组卷
|
11卷引用:【区级联考】北京市海淀区2019届高三上学期期中考试化学试题
【区级联考】北京市海淀区2019届高三上学期期中考试化学试题福建省三明市四地四校2021-2022学年高二上学期期中联考协作卷化学试题上海财经大学附属中学2022-2023学年高二上学期期中考试化学试题山西省太原市山西大学附属中学2019-2020学年高二上学期12月月考化学试题河北省石家庄市第二中学2019-2020高一下期末考试化学模拟试题(三)江苏省2021届高三上学期新高考质量检测模拟考试化学试题四川省成都市蒲江县蒲江中学2019-2020学年高二上学期12月月考化学试题福建省三明第一中学2021-2022学年高二上学期第一次月考化学试题福建省莆田市擢英中学2021-2022学年高二上学期第一次月考化学试卷(已下线)题型118 化学平衡移动的影响因素作业(十一) 温度、浓度对化学平衡的影响
名校
10 . 为探究浓度对化学平衡的影响,某同学进行如下实验:下列说法不正确 的是
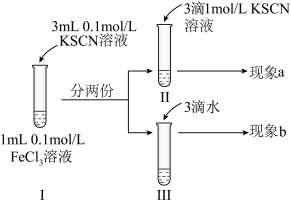

| A.该实验通过观察颜色变化以判断生成物浓度的变化 |
| B.观察到现象a比现象b中红色更深,即可证明增加反应物浓度,平衡正向移动 |
| C.进行II、III对比实验的主要目的是防止由于溶液体积变化引起各离子浓度变化而干扰实验结论得出 |
| D.若I中加入KSCN溶液的体积改为2mL也可以达到实验目的 |
您最近一年使用:0次
2020-07-09更新
|
270次组卷
|
7卷引用:河南省商丘名校联盟2022-2023学年高二上学期期中考试化学试题
河南省商丘名校联盟2022-2023学年高二上学期期中考试化学试题河南省兰考县第一高级中学2022-2023学年高二上学期期中考试化学试题北京市延庆区2019-2020学年高二下学期期末考试化学试题(已下线)第19讲 化学平衡 (练) — 2022年高考化学一轮复习讲练测(新教材新高考)湖南省长沙市长郡中学2021-2022学年高二上学期第一次月考化学试题(已下线)考向22 化学平衡状态 化学平衡的移动-备战2022年高考化学一轮复习考点微专题(已下线)第19讲 化学平衡(练)-2023年高考化学一轮复习讲练测(新教材新高考)



