解题方法
1 . 氧和氮是大气的主要成分,氮的化合物在工业上均有重要的应用。
(1)根据下列反应写出由热化学循环在较低温度下由水分解制备氢气的热化学方程式:___ 。
H2SO4(aq)=SO2(g)+H2O(l)+ O2(g) ΔH1=+327kJ·mol-1
O2(g) ΔH1=+327kJ·mol-1
SO2(g)+I2(s)+2H2O(l)=2HI(aq)+H2SO4(aq) ΔH2=-151kJ·mol-1
2HI(aq)=H2(g)+I2(s) ΔH3=+110kJ·mol-1
(2)在恒容密闭容器中,发生反应N2(g)+3H2(g) 2NH3(g),下列说法可以证明反应已达到平衡状态的是
2NH3(g),下列说法可以证明反应已达到平衡状态的是___ (填序号)。
①单位时间内生成nmolN2的同时生成2nmolNH3
②1个N≡N键断裂的同时,有6个N—H键形成
③1个N≡N键断裂的同时,有3个H—H键形成
④混合气体的密度不再改变的状态
⑤混合气体的压强不再改变的状态
⑥混合气体的平均相对分子质量不再改变的状态
为提高H2的转化率,实际生产中宜采取的措施是___ (填字母)。
A.及时移出氨 B.适当增大压强 C.循环利用和不断补充氮气 D.减小压强 E.降低温度
(3)电厂烟气脱氮的主反应①:4NH3(g)+6NO(g) 5N2(g)+6H2O(g),副反应②:2NH3(g)+8NO(g)
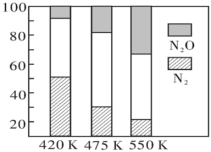
5N2(g)+6H2O(g),副反应②:2NH3(g)+8NO(g) 5N2O(g)+3H2O(g)。平衡混合气中N2与N2O含量与温度的关系如图,请解释在400~600K时,平衡混合气中这两种气体的含量随温度的变化而改变的原因是
5N2O(g)+3H2O(g)。平衡混合气中N2与N2O含量与温度的关系如图,请解释在400~600K时,平衡混合气中这两种气体的含量随温度的变化而改变的原因是__ 。
(4)肼(N2H4)是一种重要的化工原料,既可用于制药,又可用作火箭燃料。向2L的恒容密闭容器中充入2molN2H4,发生反应N2H4(g) N2(g)+2H2(g),
N2(g)+2H2(g), (用x表示)与时间的关系如图1所示,则该温度下,此反应的平衡常数K=
(用x表示)与时间的关系如图1所示,则该温度下,此反应的平衡常数K=__ 。

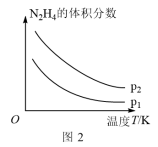
(5)肼在另一条件下也可达到分解平衡,同时生成两种气体,且其中一种气体能使湿润的红色石蕊试纸变蓝。图2为平衡体系中肼的体积分数与温度、压强的关系,则p2___ (填“大于”或“小于”)p1。
(1)根据下列反应写出由热化学循环在较低温度下由水分解制备氢气的热化学方程式:
H2SO4(aq)=SO2(g)+H2O(l)+
 O2(g) ΔH1=+327kJ·mol-1
O2(g) ΔH1=+327kJ·mol-1SO2(g)+I2(s)+2H2O(l)=2HI(aq)+H2SO4(aq) ΔH2=-151kJ·mol-1
2HI(aq)=H2(g)+I2(s) ΔH3=+110kJ·mol-1
(2)在恒容密闭容器中,发生反应N2(g)+3H2(g)
 2NH3(g),下列说法可以证明反应已达到平衡状态的是
2NH3(g),下列说法可以证明反应已达到平衡状态的是①单位时间内生成nmolN2的同时生成2nmolNH3
②1个N≡N键断裂的同时,有6个N—H键形成
③1个N≡N键断裂的同时,有3个H—H键形成
④混合气体的密度不再改变的状态
⑤混合气体的压强不再改变的状态
⑥混合气体的平均相对分子质量不再改变的状态
为提高H2的转化率,实际生产中宜采取的措施是
A.及时移出氨 B.适当增大压强 C.循环利用和不断补充氮气 D.减小压强 E.降低温度
(3)电厂烟气脱氮的主反应①:4NH3(g)+6NO(g)
 5N2(g)+6H2O(g),副反应②:2NH3(g)+8NO(g)
5N2(g)+6H2O(g),副反应②:2NH3(g)+8NO(g) 5N2O(g)+3H2O(g)。平衡混合气中N2与N2O含量与温度的关系如图,请解释在400~600K时,平衡混合气中这两种气体的含量随温度的变化而改变的原因是
5N2O(g)+3H2O(g)。平衡混合气中N2与N2O含量与温度的关系如图,请解释在400~600K时,平衡混合气中这两种气体的含量随温度的变化而改变的原因是
(4)肼(N2H4)是一种重要的化工原料,既可用于制药,又可用作火箭燃料。向2L的恒容密闭容器中充入2molN2H4,发生反应N2H4(g)
 N2(g)+2H2(g),
N2(g)+2H2(g), (用x表示)与时间的关系如图1所示,则该温度下,此反应的平衡常数K=
(用x表示)与时间的关系如图1所示,则该温度下,此反应的平衡常数K=
(5)肼在另一条件下也可达到分解平衡,同时生成两种气体,且其中一种气体能使湿润的红色石蕊试纸变蓝。图2为平衡体系中肼的体积分数与温度、压强的关系,则p2

您最近一年使用:0次
名校
2 . 二甲醚(CH3OCH3)是一种清洁能源,可由合成气(CO、H2)来制备,反应原理如下:
反应Ⅰ: CO(g)+2H2(g) CH3OH(g) ΔH1
CH3OH(g) ΔH1
反应Ⅱ: 2CH3OH CH3OCH3(g) +H2(g) ΔH2
CH3OCH3(g) +H2(g) ΔH2
回答下列问题:
(1)上述反应符合“原子经济性”原则的是______________ (填“反应Ⅰ”或“反应Ⅱ”)。
(2)图1中使曲线a对应反应按曲线b进行的措施是____________________ 由合成气(CO、H2)制备CH3OH(g)的热化学方程式为__________________________ ,该反应自发进行的条件为_________ (填“低温”或“高温”)。

(3)模拟该制备原理,起始时在某容器中充入2mol CO和4mol H2合成CH3OCH3(g),平衡时混合物中氢气的体积分数与温度、压强的关系如图2所示:
①下列有关说法能够证明恒温恒压时,反应 2CO(g)+4H2(g) CH3OCH3(g) +H2O(g) ΔH<0一定达到平衡状态的是
CH3OCH3(g) +H2O(g) ΔH<0一定达到平衡状态的是__________ (填序号)。
a.CO和H2的转化率相等
b.反应体系中混合气体密度保持不变
c. 的值保持不变
的值保持不变
d.反应体系压强保持不变
②图2中T1______ T2 (填“>”“<”或“=”);理由是______________________ 。
③在A、B两点对应的条件下,该反应从开始到平衡时生成二甲醚的平均速率:v(A)_____ v(B)。
反应Ⅰ: CO(g)+2H2(g)
 CH3OH(g) ΔH1
CH3OH(g) ΔH1反应Ⅱ: 2CH3OH
 CH3OCH3(g) +H2(g) ΔH2
CH3OCH3(g) +H2(g) ΔH2回答下列问题:
(1)上述反应符合“原子经济性”原则的是
(2)图1中使曲线a对应反应按曲线b进行的措施是

(3)模拟该制备原理,起始时在某容器中充入2mol CO和4mol H2合成CH3OCH3(g),平衡时混合物中氢气的体积分数与温度、压强的关系如图2所示:
①下列有关说法能够证明恒温恒压时,反应 2CO(g)+4H2(g)
 CH3OCH3(g) +H2O(g) ΔH<0一定达到平衡状态的是
CH3OCH3(g) +H2O(g) ΔH<0一定达到平衡状态的是a.CO和H2的转化率相等
b.反应体系中混合气体密度保持不变
c.
 的值保持不变
的值保持不变d.反应体系压强保持不变
②图2中T1
③在A、B两点对应的条件下,该反应从开始到平衡时生成二甲醚的平均速率:v(A)
您最近一年使用:0次
名校
3 . 将5 mL 0.005 mol·L-1 FeCl3溶液和5 mL 0.015 mol·L-1 KSCN溶液混合,达到平衡后呈红色,再将混合液分为5份,分别进行如下实验:
下列说法不正确的是
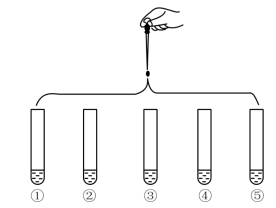 | 实验①:滴加四滴水,振荡 |
| 实验②:滴加四滴饱和的FeCl3溶液,振荡 | |
| 实验③:滴加四滴1 mol·L-1KCl溶液,振荡 | |
| 实验④:滴加四滴1 mol·L-1KSCN溶液,振荡 | |
| 实验⑤:滴加四滴1 mol·L-1NaOH 溶液,振荡 |
| A.对比实验①和②,为了证明增大反应物浓度,平衡正向移动 |
| B.对比实验①和③,为了证明增大生成物浓度,平衡逆向移动 |
| C.对比实验①和④,为了证明增大反应物浓度,平衡正向移动 |
| D.对比实验①和⑤,为了证明减小反应物浓度,平衡逆向移动 |
您最近一年使用:0次
2021-10-13更新
|
215次组卷
|
11卷引用:福建省三明市四地四校2021-2022学年高二上学期期中联考协作卷化学试题
福建省三明市四地四校2021-2022学年高二上学期期中联考协作卷化学试题【区级联考】北京市海淀区2019届高三上学期期中考试化学试题福建省三明第一中学2021-2022学年高二上学期第一次月考化学试题福建省莆田市擢英中学2021-2022学年高二上学期第一次月考化学试卷上海财经大学附属中学2022-2023学年高二上学期期中考试化学试题山西省太原市山西大学附属中学2019-2020学年高二上学期12月月考化学试题河北省石家庄市第二中学2019-2020高一下期末考试化学模拟试题(三)江苏省2021届高三上学期新高考质量检测模拟考试化学试题四川省成都市蒲江县蒲江中学2019-2020学年高二上学期12月月考化学试题(已下线)题型118 化学平衡移动的影响因素作业(十一) 温度、浓度对化学平衡的影响
名校
4 . 下列说法不正确的是
| A.容量瓶、量筒和滴定管上都标有使用温度,量筒、容量瓶无“0”刻度,滴定管有“0”刻度;使用时滴定管水洗后还需润洗,容量瓶水洗后不用润洗 |
| B.因为盐的水解是吸热过程,所以加热可提高盐的水解速率 |
C.为了证明氯化铵溶液可促进 固体的溶解,可向两份等量 固体的溶解,可向两份等量 固体中分别加入等体积蒸馏水和 固体中分别加入等体积蒸馏水和 溶液 溶液 |
D.在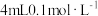 的 的 溶液中滴加数滴1mol/L的NaOH溶液,溶液颜色从橙色变成黄色 溶液中滴加数滴1mol/L的NaOH溶液,溶液颜色从橙色变成黄色 |
您最近一年使用:0次
名校
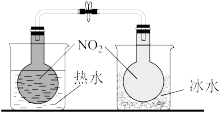
5 . 用下列实验装置进行相应实验,能达到实验目的的是
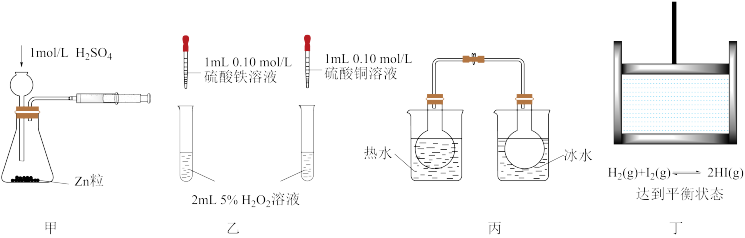

| A.利用装置甲测定化学反应速率 |
| B.利用装置乙证明对H2O2分解反应Fe3+催化效果好于Cu2+ |
| C.利用装置丙探究温度对平衡2NO2(g)⇌N2O4(g)的影响 |
| D.利用装置丁探究压强对平衡H2(g)+I2(g)⇌2HI(g)的影响 |
您最近一年使用:0次
2022-09-19更新
|
468次组卷
|
3卷引用:山东省济南市莱芜凤城高级中学2021-2022学年高二上学期期中考试化学试题
名校
6 . 已知: (aq)(橙色)+H2O(l)=2
(aq)(橙色)+H2O(l)=2 (aq)(黄色)+2H+(aq) ∆H=+13.8kJ/mol。 某同学研究浓度对化学平衡的影响,现象如下:
(aq)(黄色)+2H+(aq) ∆H=+13.8kJ/mol。 某同学研究浓度对化学平衡的影响,现象如下:
②滴加浓硫酸,试管c温度略有升高,溶液颜色与试管a相比,变深。
下列说法正确的是
 (aq)(橙色)+H2O(l)=2
(aq)(橙色)+H2O(l)=2 (aq)(黄色)+2H+(aq) ∆H=+13.8kJ/mol。 某同学研究浓度对化学平衡的影响,现象如下:
(aq)(黄色)+2H+(aq) ∆H=+13.8kJ/mol。 某同学研究浓度对化学平衡的影响,现象如下:
②滴加浓硫酸,试管c温度略有升高,溶液颜色与试管a相比,变深。
下列说法正确的是
| A.该反应是一个氧化还原反应 |
B.待试管b中溶液颜色不变的目的是使 完全反应 完全反应 |
| C.该实验能证明减小生成物浓度,平衡正向移动 |
| D.试管c中的现象说明影响平衡的主要因素是温度 |
您最近一年使用:0次
2022-09-19更新
|
245次组卷
|
4卷引用:天津市实验中学滨海学校2021-2022学年高二上学期期中质量监测化学试题
7 . 在一定条件下,反应FeO(s)+CO(g)⇌Fe(s)+CO2(g)的平衡常数为5。在体积为1升的容器中,已知CO(g)、CO2(g)的起始浓度分别为1.0mol∙L-1、4.0mol∙L-1,2min时反应达到化学平衡。
(1)下列叙述能证明该反应已达到化学平衡状态的是_______ (选填字母)。
A.容器内压强不再发生变化
B.容器内气体原子总数不再发生变化
C.混合气体密度不再变化
D.相同时间内消耗1molCO的同时消耗1molCO2
E.相同时间内消耗1molCO的同时生成1molCO2
(2)反应达到平衡后再改变下列条件,通过计算判断平衡移动的方向。(以下各项选填“正反应”、“逆反应”、“不移动”)
①保持温度不变,将容器体积压缩为原来的0.5倍,_______ 。
②保持体积不变,通入CO(g)和CO2(g)各1.0mol,_______ 。
③保持体积不变,通入1.0molCO2(g),_______ 。
(1)下列叙述能证明该反应已达到化学平衡状态的是
A.容器内压强不再发生变化
B.容器内气体原子总数不再发生变化
C.混合气体密度不再变化
D.相同时间内消耗1molCO的同时消耗1molCO2
E.相同时间内消耗1molCO的同时生成1molCO2
(2)反应达到平衡后再改变下列条件,通过计算判断平衡移动的方向。(以下各项选填“正反应”、“逆反应”、“不移动”)
①保持温度不变,将容器体积压缩为原来的0.5倍,
②保持体积不变,通入CO(g)和CO2(g)各1.0mol,
③保持体积不变,通入1.0molCO2(g),
您最近一年使用:0次
名校
8 . 利用下列实验装置无法实现实验目的的是
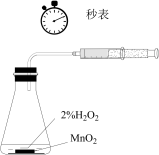 | 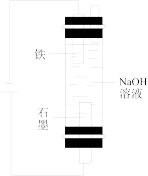 | 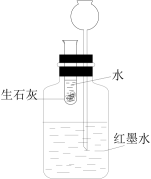 |  |
| ① | ② | ③ | ④ |
| A.用装置①测量2%双氧水分解生成O2的化学反应速率 |
B.用装置②制备 并能较长时间观察其颜色 并能较长时间观察其颜色 |
| C.用装置③证明生石灰与水反应是放热反应 |
| D.用装置④探究温度对化学平衡的影响 |
您最近一年使用:0次
2021-11-18更新
|
226次组卷
|
3卷引用:山东省青岛市4区市2021-2022学年高二上学期期中考试化学试题
9 . 可以证明可逆反应N2+3H2 2NH3已达到平衡状态的是
2NH3已达到平衡状态的是
①一个N≡N键断裂的同时,有3个H—H键断裂
②其他条件不变时,混合气体平均相对分子质量不再改变
③恒温恒容时,体系压强不再改变
④NH3、N2、H2的体积分数都不再改变
⑤恒温恒容时,混合气体密度保持不变
 2NH3已达到平衡状态的是
2NH3已达到平衡状态的是①一个N≡N键断裂的同时,有3个H—H键断裂
②其他条件不变时,混合气体平均相对分子质量不再改变
③恒温恒容时,体系压强不再改变
④NH3、N2、H2的体积分数都不再改变
⑤恒温恒容时,混合气体密度保持不变
| A.全部 | B.②③④⑤ | C.②③④ | D.③⑤ |
您最近一年使用:0次
10 . 某兴趣小组以重铬酸钾(K2Cr2O7)溶液为研究对象,结合所学反应原理的知识改变条件使其发生“色彩变幻”。
已知:①K2Cr2O7溶液存在平衡:Cr2O +H2O⇌2CrO
+H2O⇌2CrO +2H+。
+2H+。
②含铬元素的离子在溶液中的颜色:Cr2O (橙色);CrO
(橙色);CrO (黄色);Cr3+(绿色)。
(黄色);Cr3+(绿色)。

(1)i可证明反应Cr2O +H2O⇌2CrO
+H2O⇌2CrO +2H+的正反应是
+2H+的正反应是_______ (填“吸热”或“放热”)。
(2)ii是验证“只降低生成物的浓度,该平衡正向移动”,那么加入KOH后,现象是_______ 。
(3)iii的目的是要验证“增大生成物的浓度,该平衡逆向移动”,此实验是否能达到预期目的_______ (填“能”或“不能”),理由是_______ 。然后,根据实验Ⅱ中不同现象,可以得出的结论是在酸性条件下,K2Cr2O7的氧化性更强。
继续实验

(4)解释溶液变黄的主要原因是K2Cr2O7中存在平衡:Cr2O +H2O⇌2CrO
+H2O⇌2CrO +2H+,加入Na2SO3溶液以后,
+2H+,加入Na2SO3溶液以后,_______ 离子可以和_______ 离子结合,平衡正向移动,溶液变为黄色。
(5)溶液变绿色,该反应的离子方程式是_______ 。
已知:①K2Cr2O7溶液存在平衡:Cr2O
 +H2O⇌2CrO
+H2O⇌2CrO +2H+。
+2H+。②含铬元素的离子在溶液中的颜色:Cr2O
 (橙色);CrO
(橙色);CrO (黄色);Cr3+(绿色)。
(黄色);Cr3+(绿色)。
(1)i可证明反应Cr2O
 +H2O⇌2CrO
+H2O⇌2CrO +2H+的正反应是
+2H+的正反应是(2)ii是验证“只降低生成物的浓度,该平衡正向移动”,那么加入KOH后,现象是
(3)iii的目的是要验证“增大生成物的浓度,该平衡逆向移动”,此实验是否能达到预期目的
继续实验

(4)解释溶液变黄的主要原因是K2Cr2O7中存在平衡:Cr2O
 +H2O⇌2CrO
+H2O⇌2CrO +2H+,加入Na2SO3溶液以后,
+2H+,加入Na2SO3溶液以后,(5)溶液变绿色,该反应的离子方程式是
您最近一年使用:0次



