名校
1 . 在恒温恒容密闭容器中充入一定量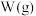 ,发生如下反应:
,发生如下反应: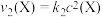 和
和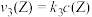 ,其中
,其中 、
、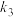 分别为反应②和③的速率常数,反应③的活化能大于反应②。测得
分别为反应②和③的速率常数,反应③的活化能大于反应②。测得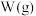 的浓度随时间的变化如下表。
的浓度随时间的变化如下表。
下列说法正确的是
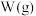 ,发生如下反应:
,发生如下反应: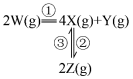
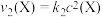 和
和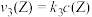 ,其中
,其中 、
、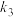 分别为反应②和③的速率常数,反应③的活化能大于反应②。测得
分别为反应②和③的速率常数,反应③的活化能大于反应②。测得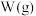 的浓度随时间的变化如下表。
的浓度随时间的变化如下表。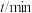 | 0 | 1 | 2 | 3 | 4 | 5 |
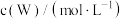 | 0.160 | 0.113 | 0.080 | 0.056 | 0.040 | 0.028 |
A.0~2min内,W的平均反应速率为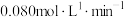 |
| B.若增大容器容积,平衡时Z的产率增大 |
C.若 ,平衡时 ,平衡时 |
D.若升高温度,平衡时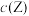 减小 减小 |
您最近一年使用:0次
今日更新
|
89次组卷
|
2卷引用:北京市第二中学2023-2024学年高三下学期三模化学试题
名校
解题方法
2 .  、
、 经干气重整(DRM)的产物
经干气重整(DRM)的产物 、CO(合成气)可用于合成清洁液体燃料,具有高效利用
、CO(合成气)可用于合成清洁液体燃料,具有高效利用 资源与保护环境的双重效益。DRM主要反应为:
资源与保护环境的双重效益。DRM主要反应为:
Ⅰ. ,
,
该过程中还可能发生一系列反应,如:
Ⅱ. ,
,
Ⅲ. ,
,
Ⅳ. ,
,
设定压强0.1 MPa下,初始投料 、
、 各1 mol,经热力学计算得到其平衡状态数据如图1示:
各1 mol,经热力学计算得到其平衡状态数据如图1示:_______ 。
(2)625℃平衡数据图1,此时焦炭的物质的量为_______ ,反应Ⅲ的
_______ MPa(计算结果保留两位有效数字)。
(3)0.1MPa下,改变初始投料比,平衡时H2的选择性(含氢产物占比)变化如图2,实际工业生产多选择投料比为1∶1,温度800~900℃,分析可能的原因为_______ 。
(4)若合成气直接用于合成烯烃(单烯)类液体燃料,结合图分析,DRM反应时合适的温度条件应调节至约_______ ,原因_______ 。_______ ,积碳量的多少与生产条件密切相关,结合图1分析,若想实现零积碳,应控制生产条件为_______ 。
 、
、 经干气重整(DRM)的产物
经干气重整(DRM)的产物 、CO(合成气)可用于合成清洁液体燃料,具有高效利用
、CO(合成气)可用于合成清洁液体燃料,具有高效利用 资源与保护环境的双重效益。DRM主要反应为:
资源与保护环境的双重效益。DRM主要反应为:Ⅰ.
 ,
,
该过程中还可能发生一系列反应,如:
Ⅱ.
 ,
,
Ⅲ.
 ,
,
Ⅳ.
 ,
,
设定压强0.1 MPa下,初始投料
 、
、 各1 mol,经热力学计算得到其平衡状态数据如图1示:
各1 mol,经热力学计算得到其平衡状态数据如图1示:
(2)625℃平衡数据图1,此时焦炭的物质的量为

(3)0.1MPa下,改变初始投料比,平衡时H2的选择性(含氢产物占比)变化如图2,实际工业生产多选择投料比为1∶1,温度800~900℃,分析可能的原因为
(4)若合成气直接用于合成烯烃(单烯)类液体燃料,结合图分析,DRM反应时合适的温度条件应调节至约

您最近一年使用:0次
名校
解题方法
3 . 丙烷的价格低廉且产量大,而丙烯及其衍生物具有较高的经济附加值,因此丙烷脱氢制丙烯具有重要的价值。回答下列问题:
(1)已知下列反应的热化学方程式:
直接脱氢
反应①: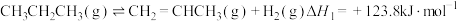
反应②: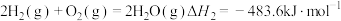
计算 氧化丙烷脱氢反应③:
氧化丙烷脱氢反应③: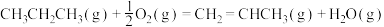 的
的
___________  。
。
(2)已知下列键能数据,结合反应①数据,计算 的键能是
的键能是___________  。
。
(3)一定温度下,向密闭容器中充入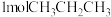 ,发生反应①。
,发生反应①。
①若该反应在恒压环境中进行,常通过向体系中通入稀有气体Ar的方式来提高CH3CH2CH3的平衡转化率,原因是___________ 。
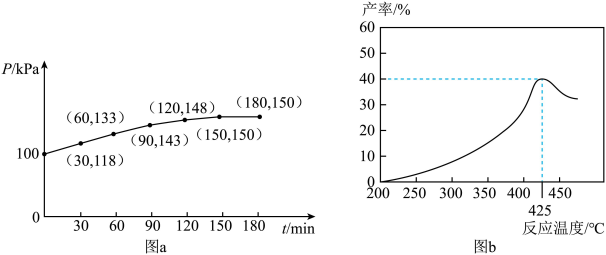
②若该反应在恒容环境中进行,用压强传感器测出容器内体系压强随时间的变化关系如图a所示,计算该温度下反应①的平衡常数Kp=___________ kPa(KP为用平衡时各气体分压代替气体的浓度表示的平衡常数,分压=总压×物质的量分数)。若保持相同反应时间,在不同温度下,丙烯产率如图b所示,丙烯产率在425℃之前随温度升高而增大的原因可能是___________ 和___________ ,随着温度继续升高,丙烷可能分解为其他产物。 作催化剂,对反应③的机理展开研究。以
作催化剂,对反应③的机理展开研究。以 和
和 为原料,初期产物中没有检测到
为原料,初期产物中没有检测到 ;以含有
;以含有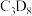 的
的 为
为 和
和 为原料,反应过程中没有检测到
为原料,反应过程中没有检测到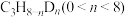 。下列推断合理的是
。下列推断合理的是___________ (填标号)。
A.V2O5先吸附氧气,吸附的氧气直接与吸附的丙烷反应
B.V2O5直接氧化吸附的丙烷,吸附的氧气补充V2O5中反应掉的氧
C.V2O5催化丙烷脱氢过程中,碳氢键的断裂是可逆的
(1)已知下列反应的热化学方程式:
直接脱氢
反应①:
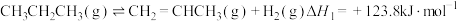
反应②:
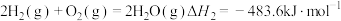
计算
 氧化丙烷脱氢反应③:
氧化丙烷脱氢反应③: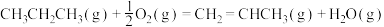 的
的
 。
。(2)已知下列键能数据,结合反应①数据,计算
 的键能是
的键能是 。
。| 化学键 |  |  |  |
键能 | 347.7 | 413.4 | 436.0 |
(3)一定温度下,向密闭容器中充入
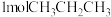 ,发生反应①。
,发生反应①。①若该反应在恒压环境中进行,常通过向体系中通入稀有气体Ar的方式来提高CH3CH2CH3的平衡转化率,原因是
②若该反应在恒容环境中进行,用压强传感器测出容器内体系压强随时间的变化关系如图a所示,计算该温度下反应①的平衡常数Kp=
 作催化剂,对反应③的机理展开研究。以
作催化剂,对反应③的机理展开研究。以 和
和 为原料,初期产物中没有检测到
为原料,初期产物中没有检测到 ;以含有
;以含有 的
的 为
为 和
和 为原料,反应过程中没有检测到
为原料,反应过程中没有检测到 。下列推断合理的是
。下列推断合理的是A.V2O5先吸附氧气,吸附的氧气直接与吸附的丙烷反应
B.V2O5直接氧化吸附的丙烷,吸附的氧气补充V2O5中反应掉的氧
C.V2O5催化丙烷脱氢过程中,碳氢键的断裂是可逆的
您最近一年使用:0次
4 . 向体积均为 的甲、乙两个恒容密闭容器中分别充入
的甲、乙两个恒容密闭容器中分别充入 和
和 ,发生反应:
,发生反应: 。分别在绝热、恒温条件下进行,两反应体系的压强随时间的变化曲线如图所示。下列说法错误的是
。分别在绝热、恒温条件下进行,两反应体系的压强随时间的变化曲线如图所示。下列说法错误的是
 的甲、乙两个恒容密闭容器中分别充入
的甲、乙两个恒容密闭容器中分别充入 和
和 ,发生反应:
,发生反应: 。分别在绝热、恒温条件下进行,两反应体系的压强随时间的变化曲线如图所示。下列说法错误的是
。分别在绝热、恒温条件下进行,两反应体系的压强随时间的变化曲线如图所示。下列说法错误的是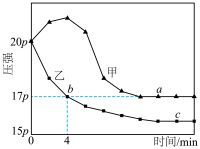
| A.正反应在较低温度下能自发进行 |
B.乙在恒温条件下进行, |
| C.a点的正反应速率大于c点的正反应速率 |
| D.甲条件下平衡常数K小于20.25 |
您最近一年使用:0次
名校
5 . “零碳甲醇”是符合“碳中和”属性的绿色能源。请回答下列有关问题。
(1)已知: ;
; ,
, (a>0,b>0)假设该反应的焓变和熵变不随温度的改变而改变,则该反应能自发进行温度范围
(a>0,b>0)假设该反应的焓变和熵变不随温度的改变而改变,则该反应能自发进行温度范围_____ K(用含a、b的代数式表示)。
(2)某温度下,用 溶液吸收一定量的
溶液吸收一定量的 后,
后, ,则该溶液pOH=
,则该溶液pOH=_____ (该温度下 的
的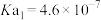 、
、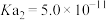 、
、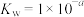 ,用含a的代数式表示)。
,用含a的代数式表示)。
(3)合成甲醇有两种方法。
直接法:
Ⅰ.
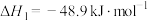
间接法: 和
和 通过逆水煤气反应,先合成CO后,CO和
通过逆水煤气反应,先合成CO后,CO和 再合成甲醇。
再合成甲醇。
Ⅱ.
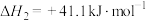
Ⅲ.
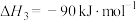
①若利用间接工艺法合成甲醇,反应的决速步为逆水煤气反应,下列示意图中能体现上述反应体系能量变化的是_____ (填字母)。_____ 。
③一定温度、50bar(1bar=100kPa)恒压下,按进料气含a% 、3a%
、3a% (体积分数,杂质气体不反应)合成甲醇,仅发生反应Ⅰ.平衡时二氧化碳转化率为90%,则
(体积分数,杂质气体不反应)合成甲醇,仅发生反应Ⅰ.平衡时二氧化碳转化率为90%,则
_____ bar,反应的平衡常数
_____  (用含a的代数式表示)。
(用含a的代数式表示)。
(4)甲醇、乙醇、正丙醇三种物质在温度传感器尖头处蒸发时的温度变化曲线如图,根据曲线下降的幅度和速率的快慢,可以比较分子间作用力的大小。请判断表示甲醇的曲线是_____ ,理由是_____ 。
(1)已知:
 ;
; ,
, (a>0,b>0)假设该反应的焓变和熵变不随温度的改变而改变,则该反应能自发进行温度范围
(a>0,b>0)假设该反应的焓变和熵变不随温度的改变而改变,则该反应能自发进行温度范围(2)某温度下,用
 溶液吸收一定量的
溶液吸收一定量的 后,
后, ,则该溶液pOH=
,则该溶液pOH= 的
的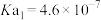 、
、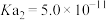 、
、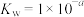 ,用含a的代数式表示)。
,用含a的代数式表示)。(3)合成甲醇有两种方法。
直接法:
Ⅰ.

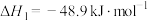
间接法:
 和
和 通过逆水煤气反应,先合成CO后,CO和
通过逆水煤气反应,先合成CO后,CO和 再合成甲醇。
再合成甲醇。Ⅱ.

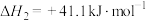
Ⅲ.

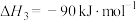
①若利用间接工艺法合成甲醇,反应的决速步为逆水煤气反应,下列示意图中能体现上述反应体系能量变化的是


③一定温度、50bar(1bar=100kPa)恒压下,按进料气含a%
 、3a%
、3a% (体积分数,杂质气体不反应)合成甲醇,仅发生反应Ⅰ.平衡时二氧化碳转化率为90%,则
(体积分数,杂质气体不反应)合成甲醇,仅发生反应Ⅰ.平衡时二氧化碳转化率为90%,则

 (用含a的代数式表示)。
(用含a的代数式表示)。(4)甲醇、乙醇、正丙醇三种物质在温度传感器尖头处蒸发时的温度变化曲线如图,根据曲线下降的幅度和速率的快慢,可以比较分子间作用力的大小。请判断表示甲醇的曲线是

您最近一年使用:0次
解题方法
6 . 氯及其化合物在生产生活中有广泛应用。回答下列问题:
(1)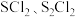 常用于硫化橡胶工业。
常用于硫化橡胶工业。
已知:① ;
;
② ;
;
③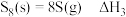 。
。
则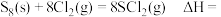
___________ (用含 的式子表示)。
的式子表示)。
(2)光气 在有机合成中常作氯化剂。工业上,可用
在有机合成中常作氯化剂。工业上,可用 和氯气混合合成光气。已知:合成
和氯气混合合成光气。已知:合成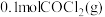 时放出
时放出 热量,写出该反应的热化学方程式:
热量,写出该反应的热化学方程式:___________ 。
(3)在恒温恒容的密闭容器中充入 和
和 ,发生反应:
,发生反应: ,下列情况表明该反应已达到平衡状态的是___________(填字母)。
,下列情况表明该反应已达到平衡状态的是___________(填字母)。
(4)硫酰氯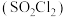 常用于有机合成。制备原理:
常用于有机合成。制备原理: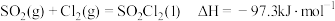 。实验测得速率方程为
。实验测得速率方程为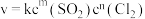 (k为速率常数,只与温度、催化剂有关,与浓度无关。m、n为反应级数,可以为整数、分数、正数、负数和0)。
(k为速率常数,只与温度、催化剂有关,与浓度无关。m、n为反应级数,可以为整数、分数、正数、负数和0)。
①为了测得反应级数,实验数据记录如下:
根据上述实验结果,计算
___________ ,
___________ 。
②已知: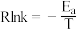 (R为常数,
(R为常数, 为活化能,T为温度)。测得
为活化能,T为温度)。测得 及在催化剂
及在催化剂 作用下随
作用下随 的变化如图所示。
的变化如图所示。 对应的活化能为
对应的活化能为___________  。催化效果:
。催化效果:
___________ (填“大于”“小于”或“等于”)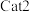 。
。
(5)我国古代采用“地康法”制备氯气: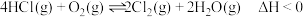 。为了探究制氯气的原理,总压强保持恒定为
。为了探究制氯气的原理,总压强保持恒定为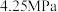 ,向密闭容器中充入
,向密闭容器中充入 和
和 ,发生上述反应,在温度
,发生上述反应,在温度 下,测得
下,测得 的平衡转化率与投料比
的平衡转化率与投料比 的关系如图所示。
的关系如图所示。
___________  (填“>”“<”或“=”)。
(填“>”“<”或“=”)。 时平衡常数
时平衡常数
___________  (
( 是以分压代替浓度表示的平衡常数,分压=总压×物质的量分数,结果保留两位小数)。从工业生产角度分析,投料比过大的缺点是
是以分压代替浓度表示的平衡常数,分压=总压×物质的量分数,结果保留两位小数)。从工业生产角度分析,投料比过大的缺点是___________ 。
(1)
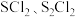 常用于硫化橡胶工业。
常用于硫化橡胶工业。已知:①
 ;
;②
 ;
;③
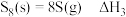 。
。则
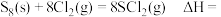
 的式子表示)。
的式子表示)。(2)光气
 在有机合成中常作氯化剂。工业上,可用
在有机合成中常作氯化剂。工业上,可用 和氯气混合合成光气。已知:合成
和氯气混合合成光气。已知:合成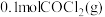 时放出
时放出 热量,写出该反应的热化学方程式:
热量,写出该反应的热化学方程式:(3)在恒温恒容的密闭容器中充入
 和
和 ,发生反应:
,发生反应: ,下列情况表明该反应已达到平衡状态的是___________(填字母)。
,下列情况表明该反应已达到平衡状态的是___________(填字母)。| A.混合气体密度不随时间变化 |
| B.气体总压强不随时间变化 |
C. 的消耗速率等于 的消耗速率等于 的生成速率 的生成速率 |
| D.Q(浓度商)不随时间变化 |
(4)硫酰氯
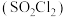 常用于有机合成。制备原理:
常用于有机合成。制备原理: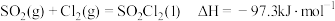 。实验测得速率方程为
。实验测得速率方程为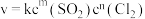 (k为速率常数,只与温度、催化剂有关,与浓度无关。m、n为反应级数,可以为整数、分数、正数、负数和0)。
(k为速率常数,只与温度、催化剂有关,与浓度无关。m、n为反应级数,可以为整数、分数、正数、负数和0)。①为了测得反应级数,实验数据记录如下:
| 序号 |  | 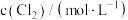 | 速率/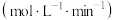 |
| a | 0.10 | 0.10 |  |
| b | 0.20 | 0.10 |  |
| c | 0.10 | 0.05 |  |


②已知:
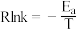 (R为常数,
(R为常数, 为活化能,T为温度)。测得
为活化能,T为温度)。测得 及在催化剂
及在催化剂 作用下随
作用下随 的变化如图所示。
的变化如图所示。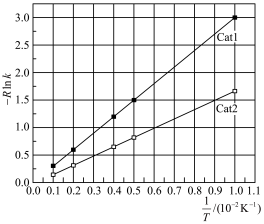
 对应的活化能为
对应的活化能为 。催化效果:
。催化效果:
 。
。(5)我国古代采用“地康法”制备氯气:
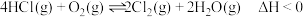 。为了探究制氯气的原理,总压强保持恒定为
。为了探究制氯气的原理,总压强保持恒定为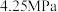 ,向密闭容器中充入
,向密闭容器中充入 和
和 ,发生上述反应,在温度
,发生上述反应,在温度 下,测得
下,测得 的平衡转化率与投料比
的平衡转化率与投料比 的关系如图所示。
的关系如图所示。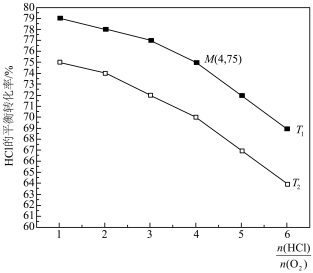

 (填“>”“<”或“=”)。
(填“>”“<”或“=”)。 时平衡常数
时平衡常数
 (
( 是以分压代替浓度表示的平衡常数,分压=总压×物质的量分数,结果保留两位小数)。从工业生产角度分析,投料比过大的缺点是
是以分压代替浓度表示的平衡常数,分压=总压×物质的量分数,结果保留两位小数)。从工业生产角度分析,投料比过大的缺点是
您最近一年使用:0次
名校
7 . 高纯镓广泛用于半导体、光电材料等领域。可以利用炼锌渣(主要含ZnO、CuO、 、FeO和一定量的
、FeO和一定量的 、不溶性杂质)为原料制备高纯镓,同时获得ZnS,流程如图所示:
、不溶性杂质)为原料制备高纯镓,同时获得ZnS,流程如图所示:
①电解制取镓时,溶液中的氯离子会影响镓的析出。
②溶液中存在反应: 。
。
③室温时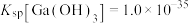 ;
;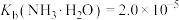 。
。
④黄钠铁矾晶体颗粒大,易沉降易过滤。
(1) 的价层电子排布式为
的价层电子排布式为_____ ,1mol 中含有σ键的物质的量为
中含有σ键的物质的量为_____ 。
(2)黄钠铁矾的化学式为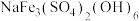 ,写出“沉铁”时的离子方程式
,写出“沉铁”时的离子方程式_____ 。
(3)不采用调节pH的方式沉铁,可能的原因是:①直接调pH沉铁易生成 胶体,不容易过滤;②
胶体,不容易过滤;②_____ ;③_____ 。
(4)“还原除杂”时先向溶液中加入一定量的铜粉,反应一段时间后再向溶液中加入稍过量Zn粉,加入铜粉的目的是_____ 。
(5) 与
与 的各物种的分布分数随pH的变化如图所示。“调节pH=8.2”时,pH不能过高的原因是
的各物种的分布分数随pH的变化如图所示。“调节pH=8.2”时,pH不能过高的原因是_____ 。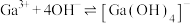 ,
,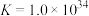 。通过计算探究氨水能否溶解
。通过计算探究氨水能否溶解 ,反应
,反应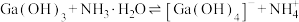 的平衡常数为
的平衡常数为_____ 。
(7)在沉铁前可以加入铁氰化钾检验 是否被完全氧化,若有
是否被完全氧化,若有 则会观察到蓝色沉淀。该蓝色沉淀是一种铁配合物
则会观察到蓝色沉淀。该蓝色沉淀是一种铁配合物 (其摩尔质量为M
(其摩尔质量为M ),其晶胞的
),其晶胞的 如图[
如图[ 未标出,占据四个互不相你的小方体晶胞的
未标出,占据四个互不相你的小方体晶胞的 部分)的体心。若该晶体的密度为
部分)的体心。若该晶体的密度为 ,则
,则 和
和 的最短距离为
的最短距离为_____ cm(设 为阿伏加德罗常数的值)。
为阿伏加德罗常数的值)。
 、FeO和一定量的
、FeO和一定量的 、不溶性杂质)为原料制备高纯镓,同时获得ZnS,流程如图所示:
、不溶性杂质)为原料制备高纯镓,同时获得ZnS,流程如图所示: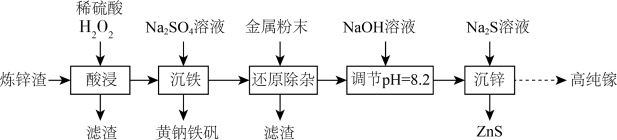
①电解制取镓时,溶液中的氯离子会影响镓的析出。
②溶液中存在反应:
 。
。③室温时
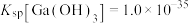 ;
;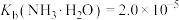 。
。④黄钠铁矾晶体颗粒大,易沉降易过滤。
(1)
 的价层电子排布式为
的价层电子排布式为 中含有σ键的物质的量为
中含有σ键的物质的量为(2)黄钠铁矾的化学式为
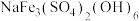 ,写出“沉铁”时的离子方程式
,写出“沉铁”时的离子方程式(3)不采用调节pH的方式沉铁,可能的原因是:①直接调pH沉铁易生成
 胶体,不容易过滤;②
胶体,不容易过滤;②(4)“还原除杂”时先向溶液中加入一定量的铜粉,反应一段时间后再向溶液中加入稍过量Zn粉,加入铜粉的目的是
(5)
 与
与 的各物种的分布分数随pH的变化如图所示。“调节pH=8.2”时,pH不能过高的原因是
的各物种的分布分数随pH的变化如图所示。“调节pH=8.2”时,pH不能过高的原因是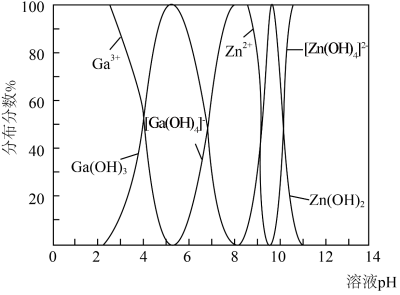
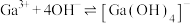 ,
,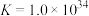 。通过计算探究氨水能否溶解
。通过计算探究氨水能否溶解 ,反应
,反应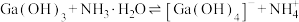 的平衡常数为
的平衡常数为(7)在沉铁前可以加入铁氰化钾检验
 是否被完全氧化,若有
是否被完全氧化,若有 则会观察到蓝色沉淀。该蓝色沉淀是一种铁配合物
则会观察到蓝色沉淀。该蓝色沉淀是一种铁配合物 (其摩尔质量为M
(其摩尔质量为M ),其晶胞的
),其晶胞的 如图[
如图[ 未标出,占据四个互不相你的小方体晶胞的
未标出,占据四个互不相你的小方体晶胞的 部分)的体心。若该晶体的密度为
部分)的体心。若该晶体的密度为 ,则
,则 和
和 的最短距离为
的最短距离为 为阿伏加德罗常数的值)。
为阿伏加德罗常数的值)。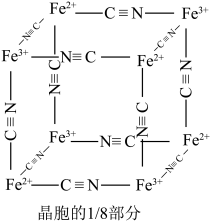
您最近一年使用:0次
8 . 我国科学家成功用二氧化碳人工合成淀粉,其中第一步是利用二氧化碳催化加氢制甲醇。在CO2(g)加氢合成CH3OH的体系中,同时发生以下反应:
反应I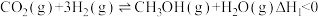
反应II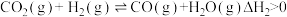
反应III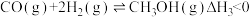
(1)反应Ⅰ、Ⅱ、Ⅲ的焓变ΔH随温度T的变化如图所示。据图判断,表示反应Ⅰ的焓变曲线为________ (填“a”、“b”或“c”);反应III在_______ (填“高温”或“低温”)下可自发进行。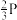 kPa。则反应过程中的热效应为
kPa。则反应过程中的热效应为__________ kJ,若反应速率用单位时间内分压变化表示,则10 min内生成CH3OH的反应速率v(CH3OH)为_______ kPa·min -1;反应I的标准平衡常数KΘ=________ (写出计算式)。(已知:分压=总压×该组分物质的量分数,对于反应dD(g)+eE(g) ⇌gG(g)+hH(g),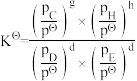 ,其中pΘ=100kPa,pC、pH、pD、pE为各组分的平衡分压)。
,其中pΘ=100kPa,pC、pH、pD、pE为各组分的平衡分压)。
(3)在其他条件相同的情况下,用新型催化剂可以显著提高甲醇的选择性,使用该催化剂,按n(CO2):n(H2)=1:3投料于恒容密闭容器中进行上述反应,CO2的平衡转化率和甲醇的选择性随温度的变化趋势如图所示: ,温度对催化剂的影响可以忽略。
,温度对催化剂的影响可以忽略。
①根据图中数据,温度选择_______ K,达到平衡时反应体系内甲醇的产量最高。
②在图示温度范围内,随着温度的升高,CO2的平衡转化率______ (填“升高”、“降低”或“不变”,下同),甲醇的选择性______ ,其原因是_______ 。
反应I
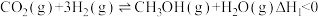
反应II
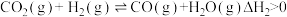
反应III
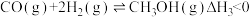
(1)反应Ⅰ、Ⅱ、Ⅲ的焓变ΔH随温度T的变化如图所示。据图判断,表示反应Ⅰ的焓变曲线为
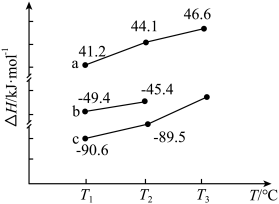
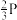 kPa。则反应过程中的热效应为
kPa。则反应过程中的热效应为 ,其中pΘ=100kPa,pC、pH、pD、pE为各组分的平衡分压)。
,其中pΘ=100kPa,pC、pH、pD、pE为各组分的平衡分压)。(3)在其他条件相同的情况下,用新型催化剂可以显著提高甲醇的选择性,使用该催化剂,按n(CO2):n(H2)=1:3投料于恒容密闭容器中进行上述反应,CO2的平衡转化率和甲醇的选择性随温度的变化趋势如图所示:
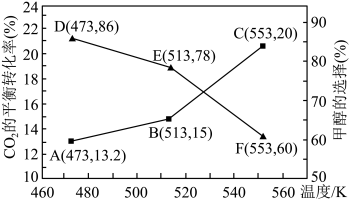
 ,温度对催化剂的影响可以忽略。
,温度对催化剂的影响可以忽略。①根据图中数据,温度选择
②在图示温度范围内,随着温度的升高,CO2的平衡转化率
您最近一年使用:0次
9 . 铁及其化合物在化工生产中发挥着重要作用。回答下列问题:
(1)一定温度下,在某密闭无氧环境中热分解 ,反应的热化学方程式为
,反应的热化学方程式为 。反应生成的混合气体中
。反应生成的混合气体中 的物质的量分数为
的物质的量分数为___________ 。反应达平衡后,缩小容器体积,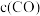
___________ (填“增大”“减小”或“不变”)。
(2)将 置入抽空的刚性容器中,升高温度,发生分解反应:
置入抽空的刚性容器中,升高温度,发生分解反应: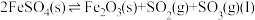 。平衡时
。平衡时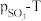 的关系如图所示。
的关系如图所示。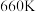 时,该反应的平衡总压
时,该反应的平衡总压
___________  ,压强平衡常数
,压强平衡常数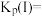
___________ 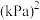 (压强平衡常数是用分压代表平衡浓度,分压=总压×物质的量分数)。
(压强平衡常数是用分压代表平衡浓度,分压=总压×物质的量分数)。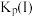 随反应温度升高而
随反应温度升高而___________ (填“增大”“减小”或“不变”)。 可用作脱除
可用作脱除 气体的脱硫剂。
气体的脱硫剂。 首先与表面的
首先与表面的 产生疏松多孔的产物
产生疏松多孔的产物 ,随着反应的进行,Fe2O3不断减少,产物层不断加厚,如图所示。失效的脱硫剂可在氧气中加热重新转化为Fe2O3实现“再生”。
,随着反应的进行,Fe2O3不断减少,产物层不断加厚,如图所示。失效的脱硫剂可在氧气中加热重新转化为Fe2O3实现“再生”。 “再生”时转化为Fe2O3的化学方程式:
“再生”时转化为Fe2O3的化学方程式:___________ 。
②“再生”时若 浓度过大、反应温度过高,“再生”后的脱硫剂脱硫效果明显变差的原因可能是
浓度过大、反应温度过高,“再生”后的脱硫剂脱硫效果明显变差的原因可能是___________ 。
(1)一定温度下,在某密闭无氧环境中热分解
 ,反应的热化学方程式为
,反应的热化学方程式为 。反应生成的混合气体中
。反应生成的混合气体中 的物质的量分数为
的物质的量分数为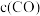
(2)将
 置入抽空的刚性容器中,升高温度,发生分解反应:
置入抽空的刚性容器中,升高温度,发生分解反应: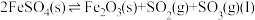 。平衡时
。平衡时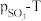 的关系如图所示。
的关系如图所示。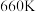 时,该反应的平衡总压
时,该反应的平衡总压
 ,压强平衡常数
,压强平衡常数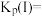
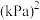 (压强平衡常数是用分压代表平衡浓度,分压=总压×物质的量分数)。
(压强平衡常数是用分压代表平衡浓度,分压=总压×物质的量分数)。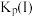 随反应温度升高而
随反应温度升高而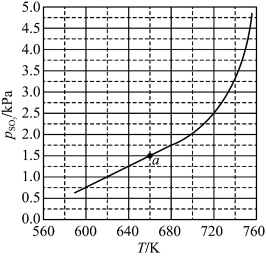
 可用作脱除
可用作脱除 气体的脱硫剂。
气体的脱硫剂。 首先与表面的
首先与表面的 产生疏松多孔的产物
产生疏松多孔的产物 ,随着反应的进行,Fe2O3不断减少,产物层不断加厚,如图所示。失效的脱硫剂可在氧气中加热重新转化为Fe2O3实现“再生”。
,随着反应的进行,Fe2O3不断减少,产物层不断加厚,如图所示。失效的脱硫剂可在氧气中加热重新转化为Fe2O3实现“再生”。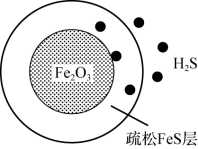
 “再生”时转化为Fe2O3的化学方程式:
“再生”时转化为Fe2O3的化学方程式:②“再生”时若
 浓度过大、反应温度过高,“再生”后的脱硫剂脱硫效果明显变差的原因可能是
浓度过大、反应温度过高,“再生”后的脱硫剂脱硫效果明显变差的原因可能是
您最近一年使用:0次
名校
解题方法
10 . 铟是一种稀有贵金属,广泛应用于航空航天、太阳能电池等高科技领域。从铜烟灰酸浸渣(主要含PbO、 、
、 、
、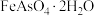 )中提取铟的工艺如图所示:
)中提取铟的工艺如图所示:
(1)铟(In)分布在元素周期表__________ 区,基态铟原子简化的核外电子排布式为__________ 。
(2)①“水浸”工艺中的滤渣除 外,还含有
外,还含有__________ 。
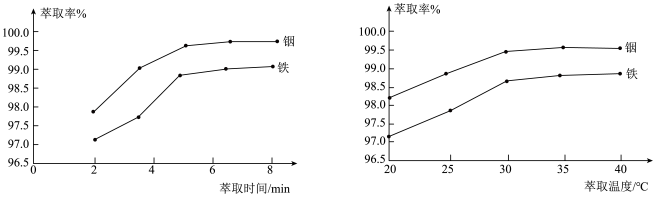
②在其他条件一定时,“水浸”铟、铁的萃取率结果如图所示,则萃取所采用的最佳条件为:萃取时间__________ ,萃取温度__________ 。__________ 。
(4)通过萃取除铁、反萃取、置换等过程,可制备金属铟。已知 能被有机萃取剂P204(简称
能被有机萃取剂P204(简称 )萃取,其萃取原理可表示为
)萃取,其萃取原理可表示为 ,平衡常数为K.已知
,平衡常数为K.已知 与萃取率(E%)的关系符合公式:
与萃取率(E%)的关系符合公式: 。当pH=2.30时,萃取率为50%,若将萃取率提升到95%,应调节溶液的pH=
。当pH=2.30时,萃取率为50%,若将萃取率提升到95%,应调节溶液的pH=__________ ( ,忽略萃取剂浓度的变化,结果保留三位有效数字)。
,忽略萃取剂浓度的变化,结果保留三位有效数字)。
(5)一种铜铟硒晶体(化学式为 )的晶胞结构如图所示,晶胞中In和Se未标明,用A或者B代替。推断In是
)的晶胞结构如图所示,晶胞中In和Se未标明,用A或者B代替。推断In是__________ (填“A”或“B”),晶体中1mol Cu周围与它最近且等距离的A粒子的数目为__________ 。
 、
、 、
、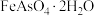 )中提取铟的工艺如图所示:
)中提取铟的工艺如图所示: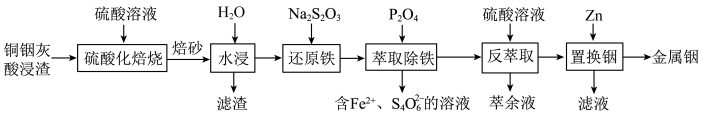
(1)铟(In)分布在元素周期表
(2)①“水浸”工艺中的滤渣除
 外,还含有
外,还含有②在其他条件一定时,“水浸”铟、铁的萃取率结果如图所示,则萃取所采用的最佳条件为:萃取时间
(4)通过萃取除铁、反萃取、置换等过程,可制备金属铟。已知
 能被有机萃取剂P204(简称
能被有机萃取剂P204(简称 )萃取,其萃取原理可表示为
)萃取,其萃取原理可表示为 ,平衡常数为K.已知
,平衡常数为K.已知 与萃取率(E%)的关系符合公式:
与萃取率(E%)的关系符合公式: 。当pH=2.30时,萃取率为50%,若将萃取率提升到95%,应调节溶液的pH=
。当pH=2.30时,萃取率为50%,若将萃取率提升到95%,应调节溶液的pH= ,忽略萃取剂浓度的变化,结果保留三位有效数字)。
,忽略萃取剂浓度的变化,结果保留三位有效数字)。(5)一种铜铟硒晶体(化学式为
 )的晶胞结构如图所示,晶胞中In和Se未标明,用A或者B代替。推断In是
)的晶胞结构如图所示,晶胞中In和Se未标明,用A或者B代替。推断In是
您最近一年使用:0次



