1 . 甲醇是重要的化工原料。利用合成气(主要成分为CO、 和
和 )在催化剂的作用下合成甲醇,发生的主要反应如下:
)在催化剂的作用下合成甲醇,发生的主要反应如下:
Ⅰ.

Ⅱ.

在恒容密闭容器进行反应Ⅰ,测得其化学平衡常数K和温度t的关系如表:
(1)
_______ 0,其理由是_______ 。
(2)能判断该反应达到化学平衡状态的依据是_______。
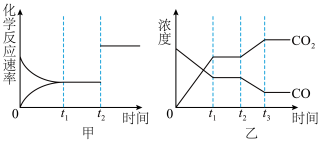
(3)图甲、图乙分别表示反应在 时刻达到平衡,在
时刻达到平衡,在 时刻因改变某个条件而发生变化的情况。图甲中
时刻因改变某个条件而发生变化的情况。图甲中 时刻发生改变的条件是
时刻发生改变的条件是_______ ,图乙中 时刻发生改变的条件是
时刻发生改变的条件是_______ 。
(4)若1200℃时,在某时刻平衡体系中 、
、 、
、 、
、 的浓度分别为
的浓度分别为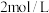 、
、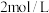 、
、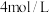 、
、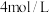 ,此时v(正)
,此时v(正)_______ v(逆)(填大于、小于或等于),其理由是_______ 。
 和
和 )在催化剂的作用下合成甲醇,发生的主要反应如下:
)在催化剂的作用下合成甲醇,发生的主要反应如下:Ⅰ.


Ⅱ.


在恒容密闭容器进行反应Ⅰ,测得其化学平衡常数K和温度t的关系如表:
| t/℃ | 700 | 800 | 830 | 1000 | 1200 |
| K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
(1)

(2)能判断该反应达到化学平衡状态的依据是_______。
A. | B.容器内 的体积分数保持不变 的体积分数保持不变 |
| C.容器内气体密度保持不变 | D.容器中压强保持不变 |
(3)图甲、图乙分别表示反应在
 时刻达到平衡,在
时刻达到平衡,在 时刻因改变某个条件而发生变化的情况。图甲中
时刻因改变某个条件而发生变化的情况。图甲中 时刻发生改变的条件是
时刻发生改变的条件是 时刻发生改变的条件是
时刻发生改变的条件是
(4)若1200℃时,在某时刻平衡体系中
 、
、 、
、 、
、 的浓度分别为
的浓度分别为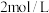 、
、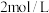 、
、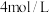 、
、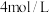 ,此时v(正)
,此时v(正)
您最近一年使用:0次
名校
2 . 由γ-羟基丁酸生成γ-丁内酯的反应为HOCH2CH2CH2COOH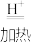
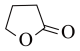 +H2O △H<0,在298K下,γ-羟基丁酸水溶液的初始浓度为0.180 mol·L-1,测得γ-丁内酯的浓度随时间变化的数据如图所示:
+H2O △H<0,在298K下,γ-羟基丁酸水溶液的初始浓度为0.180 mol·L-1,测得γ-丁内酯的浓度随时间变化的数据如图所示:

(1)该反应的平衡常数表达式为:___________ ,达到平衡后,升高温度,平衡___________ 移动(填“正向”“不”或“逆向)。
(2)在120min时,γ-羟基丁酸的转化率为___________ 。
(3)为提高平衡时γ-羟基丁酸的转化率,除适当控制反应温度外,还可采取的措施___________ 。
(4)25℃时,该反应的平衡常数K=___________ (结果保留两位小数),在25℃时,当γ-丁内酯与γ-羟基丁酸的物质的量浓度之比保持不变时,反应___________ 达到平衡(填“一定”或“不一定”)。
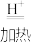
 +H2O △H<0,在298K下,γ-羟基丁酸水溶液的初始浓度为0.180 mol·L-1,测得γ-丁内酯的浓度随时间变化的数据如图所示:
+H2O △H<0,在298K下,γ-羟基丁酸水溶液的初始浓度为0.180 mol·L-1,测得γ-丁内酯的浓度随时间变化的数据如图所示:
(1)该反应的平衡常数表达式为:
(2)在120min时,γ-羟基丁酸的转化率为
(3)为提高平衡时γ-羟基丁酸的转化率,除适当控制反应温度外,还可采取的措施
(4)25℃时,该反应的平衡常数K=
您最近一年使用:0次
名校
3 . 在一个体积为 2L 的密闭容器中发生以下反应: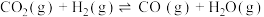 ,其平衡常数(K)和温度(t)的关系如下表所示
,其平衡常数(K)和温度(t)的关系如下表所示
(1)该反应的平衡常数表达式 K= ___________ ;该反应___________ 反应(填“吸热”或“放热”)
(2)600℃时,向容器中充入 1mol H2和 1mol CO2 气体,平衡时 CO 气体有 0.4mol,则 600℃时K=___________
(3)在 830℃向容器中充入 2mol CO 和 2mol H2O,保持温度不变,5 分钟后反应达到平衡后,其平衡常数___________ (填“大于”“小于”或“等于”)1,此时 H2O 的转化率为 ___________ 。
(4)若 1000℃时,某时刻反应混合物中 CO2、H2、CO、H2O 物质的量分别为 2mol 、2mol 、4mol 、4mol ,则此时上述反应的平衡移动方向为___________ (填“正反应方向”“逆反应方向”或“不移动”)
(5)为提高平衡时 H2的转化率,除了适当控制反应温度,还可以采取的措施是___________ 。
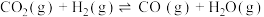 ,其平衡常数(K)和温度(t)的关系如下表所示
,其平衡常数(K)和温度(t)的关系如下表所示| t/℃ | 700 | 800 | 830 | 1000 | 1200 |
| K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
(2)600℃时,向容器中充入 1mol H2和 1mol CO2 气体,平衡时 CO 气体有 0.4mol,则 600℃时K=
(3)在 830℃向容器中充入 2mol CO 和 2mol H2O,保持温度不变,5 分钟后反应达到平衡后,其平衡常数
(4)若 1000℃时,某时刻反应混合物中 CO2、H2、CO、H2O 物质的量分别为 2mol 、2mol 、4mol 、4mol ,则此时上述反应的平衡移动方向为
(5)为提高平衡时 H2的转化率,除了适当控制反应温度,还可以采取的措施是
您最近一年使用:0次
2023-10-07更新
|
77次组卷
|
3卷引用:吉林省梅河口市第五中学2023-2024学年高二下学期开学化学试题
名校
解题方法
4 . 科学家对汽车尾气进行无害化处理反应为:2CO+2NO⇌2CO2+N2。一定条件下,在1L密闭容器中充入2.00molCO和2.00molNO,一段时间后测得CO、CO2浓度随时间变化如图1所示,CO的平衡转化率与温度、起始投料比m的关系如图2所示,图中起始投料比m= ,完成问题:
,完成问题:
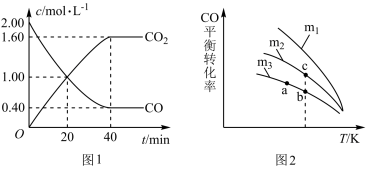
(1)该反应的化学平衡常数表达式是___________ ,根据图1,用N2表示该反应达平衡过程中的平均反应速率是___________ 。
(2)该反应的正反应是___________ 反应(填“吸热”或“放热”)。图2中a、b、c三点对应的平衡常数Ka、Kb、Kc相对大小关系是___________ 。
(3)关于该可逆反应的说法正确的是___________ 。
a.加入催化剂可提高NO的平衡转化率
b.当体系中c(CO2):c(N2)=2:1时,该反应达到平衡状态
c.保持其他条件不变,若充入N2,则达到新平衡时,正、逆反应速率均增大
d.投料比:m1>m2>m3
(4)随着温度的升高,不同投料比下CO的平衡转化率趋于相近的原因为___________ 。
 ,完成问题:
,完成问题:
(1)该反应的化学平衡常数表达式是
(2)该反应的正反应是
(3)关于该可逆反应的说法正确的是
a.加入催化剂可提高NO的平衡转化率
b.当体系中c(CO2):c(N2)=2:1时,该反应达到平衡状态
c.保持其他条件不变,若充入N2,则达到新平衡时,正、逆反应速率均增大
d.投料比:m1>m2>m3
(4)随着温度的升高,不同投料比下CO的平衡转化率趋于相近的原因为
您最近一年使用:0次
2023-07-02更新
|
557次组卷
|
5卷引用:吉林省长春外国语学校2023-2024学年高二下学期开学化学试题
吉林省长春外国语学校2023-2024学年高二下学期开学化学试题上海市育才中学2022-2023学年高二下学期(等级考)期末调研化学试题(已下线)专题04 可逆反应、化学平衡状态、化学平衡常数【考点清单】(讲+练)-2023-2024学年高二化学期中考点大串讲(人教版2019选择性必修1)重庆市第八中学校2023-2024学年高二上学期9月适应性考试化学试题(已下线)专题04 化学反应的速率与工业合成氨-【好题汇编】备战2023-2024学年高二化学上学期期末真题分类汇编(上海专用)
解题方法
5 . 1913年,德国化学家哈伯实现了合成氨的工业化生产,被称作解救世界粮食危机的化学天才,现将1mol N2和3mol H2投入1L的密闭容器,在一定条件下,利用反应模拟哈伯合成氨的工业化生产:N2(g)+3H2(g) 2NH3(g) ΔH<0。
2NH3(g) ΔH<0。
回答下列问题:
(1)合成氨反应平衡常数的表达式为_______ 。温度升高,K值_______ (填“增大”“减小”或“不变”)。
(2)反应的ΔS_______ 0(填“>”“<”或“=”)
(3)有利于提高平衡混合物中氨含量的条件有_______ (填序号)。
A.低温 B.高温 C.低压 D.高压 E.催化剂
(4)当反应达到平衡后,向体系中充入N2的,平衡_______ 移动(填“正向”“逆向”或“不”);给体系升温,v正_______ (填“增大”“减小”或“不变”),v逆_______ (填“增大”“减小”或“不变”),平衡_______ 移动(填“正向”“逆向”或“不”)。
 2NH3(g) ΔH<0。
2NH3(g) ΔH<0。回答下列问题:
(1)合成氨反应平衡常数的表达式为
(2)反应的ΔS
(3)有利于提高平衡混合物中氨含量的条件有
A.低温 B.高温 C.低压 D.高压 E.催化剂
(4)当反应达到平衡后,向体系中充入N2的,平衡
您最近一年使用:0次
解题方法
6 . 合成氨工业对国民经济和社会发展具有重要的意义。其原理为: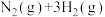

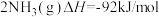 ;据此回答以下问题:
;据此回答以下问题:
(1)根据温度对化学平衡的影响规律可知,对于该反应温度越高,其化学平衡常数的值_______ 。(填“越大”、“越小”或“不变”)
(2)某温度下,若把 与
与 置于体积为
置于体积为 的密闭容器内,反应达到平衡状态时,测得混合气体的压强变为开始时的
的密闭容器内,反应达到平衡状态时,测得混合气体的压强变为开始时的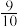 ,则平衡时氢气的转化率
,则平衡时氢气的转化率 =
=_______ (用百分数表示 。能说明该反应达到化学平衡状态的是
。能说明该反应达到化学平衡状态的是_______  填字母
填字母 。
。
a.容器内的密度保持不变b.容器内压强保持不变
c.v正(N2)=2v逆(NH3) d.混合气体中c(NH3)不变
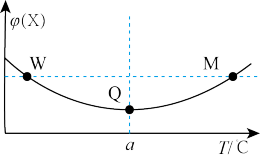
(3)某2L恒容密闭容器中充入2mol X(g)和1mol Y(g)发生反应:2X(g)+Y(g)⇌3Z(g)△H,反应过程中持续升高温度,测得混合体系中X的体积分数与温度的关系如图所示,△H______ 0
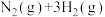

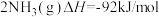 ;据此回答以下问题:
;据此回答以下问题:(1)根据温度对化学平衡的影响规律可知,对于该反应温度越高,其化学平衡常数的值
(2)某温度下,若把
 与
与 置于体积为
置于体积为 的密闭容器内,反应达到平衡状态时,测得混合气体的压强变为开始时的
的密闭容器内,反应达到平衡状态时,测得混合气体的压强变为开始时的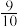 ,则平衡时氢气的转化率
,则平衡时氢气的转化率 =
= 。能说明该反应达到化学平衡状态的是
。能说明该反应达到化学平衡状态的是 填字母
填字母 。
。a.容器内的密度保持不变b.容器内压强保持不变
c.v正(N2)=2v逆(NH3) d.混合气体中c(NH3)不变
(3)某2L恒容密闭容器中充入2mol X(g)和1mol Y(g)发生反应:2X(g)+Y(g)⇌3Z(g)△H,反应过程中持续升高温度,测得混合体系中X的体积分数与温度的关系如图所示,△H
您最近一年使用:0次
名校
解题方法
7 . 利用反应CO(g)+H2O(g) H2(g)+CO2(g)可得到清洁能源H2。
H2(g)+CO2(g)可得到清洁能源H2。
(1)该反应化学平衡常数表达式K=____ 。
(2)该反应的平衡常数随温度的变化如表:
从上表可以推断:此反应是____ (填“吸热”或“放热”)反应。
(3)830℃时,向容积为2L的密闭容器中充入1molCO与1molH2O,2min时CO为0.6mol。2min内v(CO2)=____ ,此时反应进行的方向是___ ,依据是____ ,可以判断该反应达到平衡的标志是____ (填字母)。
a.体系的压强不再发生变化 b.混合气体的密度不变
c.CO的消耗速率与CO2的消耗速率相等 d.各组分的物质的量浓度不再改变
 H2(g)+CO2(g)可得到清洁能源H2。
H2(g)+CO2(g)可得到清洁能源H2。(1)该反应化学平衡常数表达式K=
(2)该反应的平衡常数随温度的变化如表:
| 温度/℃ | 400 | 500 | 830 | 1000 |
| 平衡常数K | 10 | 9 | 1 | 0.6 |
(3)830℃时,向容积为2L的密闭容器中充入1molCO与1molH2O,2min时CO为0.6mol。2min内v(CO2)=
a.体系的压强不再发生变化 b.混合气体的密度不变
c.CO的消耗速率与CO2的消耗速率相等 d.各组分的物质的量浓度不再改变
您最近一年使用:0次
2022-03-14更新
|
584次组卷
|
3卷引用:吉林省普通高中友好学校联合体2023-2024学年高二上学期期中联考化学试题
吉林省普通高中友好学校联合体2023-2024学年高二上学期期中联考化学试题北京市日坛中学2021-2022学年高二上学期期中考试化学试题(已下线)2.2.2 影响化学平衡的因素 -2022-2023学年高二化学上学期课后培优分级练(人教版2019选择性必修1)
名校
8 . 化工中常需研究不同温度下平衡常数。投料比及热值等问题。
已知反应CO(g) +H2O(g) H2(g) +CO2(g)的平衡常数随温度的变化如下表:
H2(g) +CO2(g)的平衡常数随温度的变化如下表:
回答下列问题:
(1)在800°C发生上述反应,按下表所列物质的量将各物质投入恒容反应器,其中反应向正反应方向进行的有___________ ,(多选,填字母)。
(2)在1 L密闭容器中通入10 mol CO和10 mol水蒸气进行上述反应,在500 °C下经过30 s反应达到平衡,则0~30 s内CO的平均反应速率为___________ , 水蒸气的平衡转化率为___________ 。
(3)一定温度下的密闭容器中有反应:C(s)+CO2(g) 2CO(g)
2CO(g)
①能判断该反应达到化学平衡状态的依据是___________ ( 多选,填字母)。
a. c(CO2)=c(CO) b.容器中的压强不变
c. v正(C O)= 2v正(CO2) d. c(CO)保持不变
②该反应的平衡常数表达式为K=___________ 。
③若反应C(s)+ H2O(g) CO(g)+ H2(g)的平衡常数为K2,则K、K1、K2之间的关系为
CO(g)+ H2(g)的平衡常数为K2,则K、K1、K2之间的关系为___________ 。
已知反应CO(g) +H2O(g)
 H2(g) +CO2(g)的平衡常数随温度的变化如下表:
H2(g) +CO2(g)的平衡常数随温度的变化如下表: | 温度/°C | 400 | 500 | 800 |
| 平衡常数K1 | 9.94 | 9 | 1 |
(1)在800°C发生上述反应,按下表所列物质的量将各物质投入恒容反应器,其中反应向正反应方向进行的有
| 选项 | n(CO)/ mol | n( H2O)/mol | n(H2)/mol | n(CO2)/mol |
| A | 1 | 5 | 2 | 3 |
| B | 2 | 2 | 1 | 1 |
| C | 3 | 3 | 0 | 0 |
| D | 0.5 | 2 | 1 | 1 |
| E | 3 | 1 | 2 | 2 |
(3)一定温度下的密闭容器中有反应:C(s)+CO2(g)
 2CO(g)
2CO(g) ①能判断该反应达到化学平衡状态的依据是
a. c(CO2)=c(CO) b.容器中的压强不变
c. v正(C O)= 2v正(CO2) d. c(CO)保持不变
②该反应的平衡常数表达式为K=
③若反应C(s)+ H2O(g)
 CO(g)+ H2(g)的平衡常数为K2,则K、K1、K2之间的关系为
CO(g)+ H2(g)的平衡常数为K2,则K、K1、K2之间的关系为
您最近一年使用:0次
名校
9 . 已知NO2和N2O4可以相互转化:反应2NO2(g)  N2O4(g)△H=﹣57.2kJ/mol。
N2O4(g)△H=﹣57.2kJ/mol。
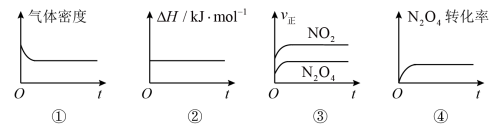
(1)一定温度下,现将1molN2O4充入一恒压密闭容器中,下列示意图正确且能说明反应达到平衡状态的是___________ (填序号,下同)。
(2)若反应2NO2(g) N2O4(g)在体积为1L的恒容密闭容器中进行,保持温度不变,达到平衡后,向反应容器中再充入少量N2O4,平衡向
N2O4(g)在体积为1L的恒容密闭容器中进行,保持温度不变,达到平衡后,向反应容器中再充入少量N2O4,平衡向___________ 移动(填“左”、“右”或“不”),重新平衡后和原平衡相比,混合气体颜色___________ (填“变深”“变浅”或“不变”),N2O4的体积分数___________ (填“增大”、“减小”或“不变”)。
(3)一定温度下,向容积为20L的密闭容器中充入1molNO2气体,发生反应2NO2(g)⇌N2O4(g),反应中测得相关数据如表所示:
①此条件下该反应的化学平衡常数K=___________ 。
②在第150min末,测量容器中NO2的含量是0.8mol/L,N2O4的含量是0.4 mol/L,是判断此时v正___________ v逆(填“>”“<”“=”)
 N2O4(g)△H=﹣57.2kJ/mol。
N2O4(g)△H=﹣57.2kJ/mol。(1)一定温度下,现将1molN2O4充入一恒压密闭容器中,下列示意图正确且能说明反应达到平衡状态的是

(2)若反应2NO2(g)
 N2O4(g)在体积为1L的恒容密闭容器中进行,保持温度不变,达到平衡后,向反应容器中再充入少量N2O4,平衡向
N2O4(g)在体积为1L的恒容密闭容器中进行,保持温度不变,达到平衡后,向反应容器中再充入少量N2O4,平衡向(3)一定温度下,向容积为20L的密闭容器中充入1molNO2气体,发生反应2NO2(g)⇌N2O4(g),反应中测得相关数据如表所示:
| 反应时间/min | 0 | 10 | 20 | 30 | 40 | 50 |
| 气体相对分子质量 | 46 | 57 | 64 | 69 | 69 | 69 |
①此条件下该反应的化学平衡常数K=
②在第150min末,测量容器中NO2的含量是0.8mol/L,N2O4的含量是0.4 mol/L,是判断此时v正
您最近一年使用:0次
名校
10 . 已知化学反应①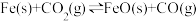 ,其平衡常数为K1;
,其平衡常数为K1;
化学反应② ,其平衡常数为K2。
,其平衡常数为K2。
在温度973 K和1173 K情况下, K1、K2的值分别如下:
(1)通过表格中的数值可以推断:①反应是___________ (填“吸热”或“放热”)反应。
(2)现有反应③ ,请你写出该反应的平衡常数K3的表达式:K3=
,请你写出该反应的平衡常数K3的表达式:K3=___________ 。
(3)根据反应①与②可推导出K3, K1、K2与K3之间的关系式___________ 。据此关系及上表数据,也能推断出反应③是___________ (填“吸热”或“放热”)反应。要使反应③在一定条件下建立的平衡向正反应方向移动,可采取的措施有___________ (填写序号)。
A.扩大反应容器容积 B.升高温度
C.使用合适的催化剂 D.设法减少CO的量
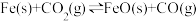 ,其平衡常数为K1;
,其平衡常数为K1;化学反应②
 ,其平衡常数为K2。
,其平衡常数为K2。在温度973 K和1173 K情况下, K1、K2的值分别如下:
| 温度 | K1 | K2 |
| T1=973K | 1.47 | 2.38 |
| T2=1173K | 2.15 | 1.67 |
(2)现有反应③
 ,请你写出该反应的平衡常数K3的表达式:K3=
,请你写出该反应的平衡常数K3的表达式:K3=(3)根据反应①与②可推导出K3, K1、K2与K3之间的关系式
A.扩大反应容器容积 B.升高温度
C.使用合适的催化剂 D.设法减少CO的量
您最近一年使用:0次



