解题方法
1 . 在硫酸工业中,通过下列反应使SO2氧化成SO3: 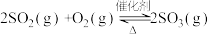
 。(已知制
。(已知制 过程中催化剂是
过程中催化剂是 ,它在400~500 ℃时催化效果最好)下表为不同温度和压强下
,它在400~500 ℃时催化效果最好)下表为不同温度和压强下 的转化率(%):
的转化率(%):
(1)根据化学原理综合分析,从化学反应速率和原料转化率角度分析,生产中应采取的条件是_______ 。
(2)实际生产中,选定400~500 ℃作为操作温度,其原因是_______ 。
(3)实际生产中,采用的压强为1×105 Pa,其原因是_______ 。
(4)在生产中,通入过量空气的目的是_______ 。
(5)尾气中有SO2必须回收是为了_______ 。
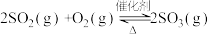
 。(已知制
。(已知制 过程中催化剂是
过程中催化剂是 ,它在400~500 ℃时催化效果最好)下表为不同温度和压强下
,它在400~500 ℃时催化效果最好)下表为不同温度和压强下 的转化率(%):
的转化率(%):| 1×105 Pa | 1×106 Pa | 5×106 Pa | 1×107 Pa | |
| 450 ℃ | 97.5% | 99.2% | 99.6% | 99.7% |
| 550 ℃ | 85.6% | 94.9% | 97.7% | 98.3% |
(2)实际生产中,选定400~500 ℃作为操作温度,其原因是
(3)实际生产中,采用的压强为1×105 Pa,其原因是
(4)在生产中,通入过量空气的目的是
(5)尾气中有SO2必须回收是为了
您最近一年使用:0次
解题方法
2 . 氮的氧化物(NOx)是大气主要污染物,有效去除大气中的NOx是环境保护的重要课题。
(1)N2O又称笑气,有轻微的麻醉作用,N2O在一定条件下可分解为N2、O2。回答下列问题:
已知:①N2(g)+O2(g)=2NO(g) ΔH1=+180.5kJ/mol
②2NO(g)+O2(g)=2NO2(g) ΔH2=-114.14kJ/mol
③3NO(g)=N2O(g)+NO2(g) ΔH3=-115.52kJ/mol
则反应2NO2(g)=N2(g)+2O2(g) ΔH=_____ kJ/mol。
(2)汽车尾气中的NO和CO可在催化剂作用下生成无污染的气体而除去。在密闭容器中充入10molCO和8molNO发生反应,测得平衡时NO的体积分数与温度、压强的关系如图:
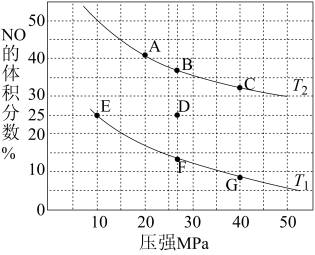
①已知T2>T1,则反应2NO(g)+2CO(g) N2(g)+2CO2(g),ΔH
N2(g)+2CO2(g),ΔH_____ 0(填“>”“=”或“<”)。
②该反应达到平衡后,为同时提高反应速率和NO的转化率,可采取的措施有_____ (填字母序号)。
a.改用高效催化剂 b.缩小容器的体积 c.增加CO的浓度 d.升高温度
③压强为10MPa、温度为T1下,若反应进行到10min达到平衡状态,压强保持不变,此时容器的体积为4L,则用N2的浓度变化表示的平均反应速率v(N2)=____ ,该温度下用分压表示的平衡常数Kp=____ MPa-1(分压=总压×物质的量分数)。
④在D点,对反应容器升温的同时扩大体积至体系压强减小,重新达到的平衡状态可能是图中A~G点中_____ 点。
(3)在有氧条件下,新型催化剂M能催化NH3与NOx反应生成N2,将一定比例的O2、NH3和NOx的混合气体匀速通入装有催化剂M的反应器中反应,反应相同时间,NOx的去除率随反应温度的变化曲线如图所示。
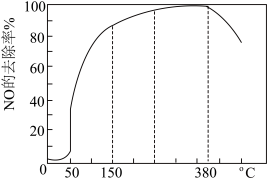
问:在50℃~150℃范围内随温度升高,NOx的去除率迅速上升的原因是_____ 。
(1)N2O又称笑气,有轻微的麻醉作用,N2O在一定条件下可分解为N2、O2。回答下列问题:
已知:①N2(g)+O2(g)=2NO(g) ΔH1=+180.5kJ/mol
②2NO(g)+O2(g)=2NO2(g) ΔH2=-114.14kJ/mol
③3NO(g)=N2O(g)+NO2(g) ΔH3=-115.52kJ/mol
则反应2NO2(g)=N2(g)+2O2(g) ΔH=
(2)汽车尾气中的NO和CO可在催化剂作用下生成无污染的气体而除去。在密闭容器中充入10molCO和8molNO发生反应,测得平衡时NO的体积分数与温度、压强的关系如图:

①已知T2>T1,则反应2NO(g)+2CO(g)
 N2(g)+2CO2(g),ΔH
N2(g)+2CO2(g),ΔH②该反应达到平衡后,为同时提高反应速率和NO的转化率,可采取的措施有
a.改用高效催化剂 b.缩小容器的体积 c.增加CO的浓度 d.升高温度
③压强为10MPa、温度为T1下,若反应进行到10min达到平衡状态,压强保持不变,此时容器的体积为4L,则用N2的浓度变化表示的平均反应速率v(N2)=
④在D点,对反应容器升温的同时扩大体积至体系压强减小,重新达到的平衡状态可能是图中A~G点中
(3)在有氧条件下,新型催化剂M能催化NH3与NOx反应生成N2,将一定比例的O2、NH3和NOx的混合气体匀速通入装有催化剂M的反应器中反应,反应相同时间,NOx的去除率随反应温度的变化曲线如图所示。

问:在50℃~150℃范围内随温度升高,NOx的去除率迅速上升的原因是
您最近一年使用:0次
名校
解题方法
3 . 如图所示为工业合成氨的流程图。下列说法错误的是
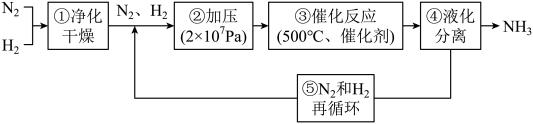

| A.步骤①中“净化”可以防止催化剂中毒 |
| B.步骤②中“加压”既可以提高原料的转化率,又可以加快反应速率 |
| C.步骤③、④、⑤均有利于提高原料平衡的转化率 |
| D.为保持足够高的反应速率,应在反应达到一定转化率时及时将氨从混合气中分离出去 |
您最近一年使用:0次
2022-12-07更新
|
254次组卷
|
4卷引用:山东省临沂市第二中学2021-2022学年高二10月月考化学试题
山东省临沂市第二中学2021-2022学年高二10月月考化学试题新疆乌鲁木齐市第八中学2022-2023学年高二上学期期末考试化学试题(已下线)专题06 化学反应的方向及调控【考题猜想】(6大题型)-2023-2024学年高二化学期中考点大串讲(人教版2019选择性必修1)广东省 广州市西关培英中学2023-2024学年高二上学期11月期中化学试题
名校
解题方法
4 . 硫酸在国民经济中占有极其重要的地位,工业上常以黄铁矿为原料用接触法制硫酸。
(1)接触室中发生的反应:
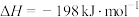 。
。
①若测得2h后 的浓度为0.6
的浓度为0.6 ,此时间内
,此时间内 的消耗速率为0.2
的消耗速率为0.2 ,则开始时
,则开始时 的浓度为
的浓度为_________  。
。
②将0.050mol (g)和0.030mol
(g)和0.030mol  (g)放入容积为1L的密闭容器中,在一定条件下达到平衡,测
(g)放入容积为1L的密闭容器中,在一定条件下达到平衡,测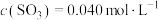 。计算该条件下反应的平衡常数K=
。计算该条件下反应的平衡常数K=_________ , 的平衡转化率为
的平衡转化率为_________ 。
③ 可作为该反应的催化剂,其过程如图。c步的化学方程式可表示为
可作为该反应的催化剂,其过程如图。c步的化学方程式可表示为_________ 。
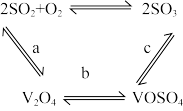
(2)硫酸的生产中,下列说法不正确的是_________(填字母)。
(3)为减少 的排放,工业上将
的排放,工业上将 转化为
转化为 固定,但存在C0会同时发生以下两个反应:
固定,但存在C0会同时发生以下两个反应:
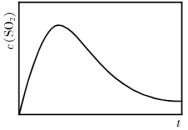
恒容、恒温( )条件下,反应体系中
)条件下,反应体系中 随时间t变化的总趋势如图。结合已知信息分析
随时间t变化的总趋势如图。结合已知信息分析 随时间t变化的原因:
随时间t变化的原因:_________ 。
(1)接触室中发生的反应:

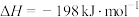 。
。①若测得2h后
 的浓度为0.6
的浓度为0.6 ,此时间内
,此时间内 的消耗速率为0.2
的消耗速率为0.2 ,则开始时
,则开始时 的浓度为
的浓度为 。
。②将0.050mol
 (g)和0.030mol
(g)和0.030mol  (g)放入容积为1L的密闭容器中,在一定条件下达到平衡,测
(g)放入容积为1L的密闭容器中,在一定条件下达到平衡,测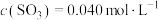 。计算该条件下反应的平衡常数K=
。计算该条件下反应的平衡常数K= 的平衡转化率为
的平衡转化率为③
 可作为该反应的催化剂,其过程如图。c步的化学方程式可表示为
可作为该反应的催化剂,其过程如图。c步的化学方程式可表示为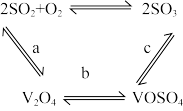
(2)硫酸的生产中,下列说法不正确的是_________(填字母)。
| A.把黄铁矿磨成细粉末在“沸腾”状态下燃烧,可以提高反应速率和原料的利用率 |
| B.气体在进接触室前要先净化,可防止催化剂中毒 |
| C.接触室中反应温度采用400~500℃,主要是为了提高原料的平衡转化率 |
D.吸收塔中操作采取逆流的形式, 从下而上,水从上而下 从下而上,水从上而下 |
 的排放,工业上将
的排放,工业上将 转化为
转化为 固定,但存在C0会同时发生以下两个反应:
固定,但存在C0会同时发生以下两个反应:| 反应 | 活化能 | 平衡常数 | |
| Ⅰ |  | 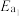 | 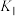 |
| Ⅱ |  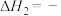 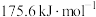 | 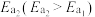 | 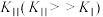 |
恒容、恒温(
 )条件下,反应体系中
)条件下,反应体系中 随时间t变化的总趋势如图。结合已知信息分析
随时间t变化的总趋势如图。结合已知信息分析 随时间t变化的原因:
随时间t变化的原因:
您最近一年使用:0次
2022-12-05更新
|
36次组卷
|
2卷引用:陕西省咸阳市实验中学2021-2022学年高二上学期第二次月考化学试题
名校
5 . 二氧化锰是化学工业中常用的氧化剂和催化剂。我国主要以贫菱锰矿(有效成分为MnCO3)为原料,通过热解法进行生产。
(1)碳酸锰热解制二氧化锰分两步进行:
i.MnCO3(s) MnO(s)+CO2(g) ΔH1=+a kJ·mol−1
MnO(s)+CO2(g) ΔH1=+a kJ·mol−1
ii.2MnO(s)+O2(g) 2MnO2(s) ΔH2=+b kJ·mol−1
2MnO2(s) ΔH2=+b kJ·mol−1
①反应i的化学平衡常数表达式K=_________ 。
②焙烧MnCO3制取MnO2的热化学方程式是_________ 。
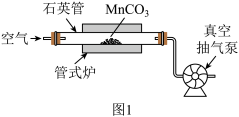
(2)焙烧(装置如图1)时持续通入空气,并不断抽气的目的是_________ 。
(3)在其他条件不变时,某科研团队对影响MnCO3转化率的生产条件进行了研究,结果如图2、图3所示。
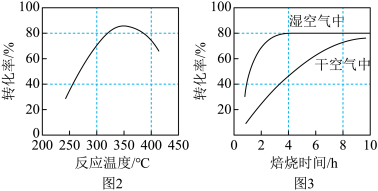
①图2是在常压(0.1 MPa)下的研究结果,请在图2中用虚线画出10 MPa下MnCO3转化率与反应温度的关系图_________ 。
②常压下,要提高MnCO3的转化率,应选择的生产条件是_________ 焙烧6~8h。
(1)碳酸锰热解制二氧化锰分两步进行:
i.MnCO3(s)
 MnO(s)+CO2(g) ΔH1=+a kJ·mol−1
MnO(s)+CO2(g) ΔH1=+a kJ·mol−1ii.2MnO(s)+O2(g)
 2MnO2(s) ΔH2=+b kJ·mol−1
2MnO2(s) ΔH2=+b kJ·mol−1①反应i的化学平衡常数表达式K=
②焙烧MnCO3制取MnO2的热化学方程式是
(2)焙烧(装置如图1)时持续通入空气,并不断抽气的目的是

(3)在其他条件不变时,某科研团队对影响MnCO3转化率的生产条件进行了研究,结果如图2、图3所示。

①图2是在常压(0.1 MPa)下的研究结果,请在图2中用虚线画出10 MPa下MnCO3转化率与反应温度的关系图
②常压下,要提高MnCO3的转化率,应选择的生产条件是
您最近一年使用:0次
2022-12-05更新
|
99次组卷
|
3卷引用:北京市第四十三中学2021-2022学年高二上学期12月月考化学试题
名校
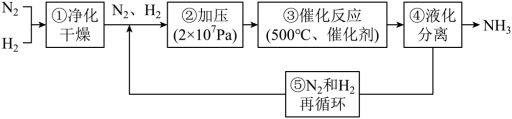
6 . 哈伯工业合成氨的流程如图,为提高原料平衡转化率采取的措施是

| A.①②③④⑤ | B.②③④⑤ | C.②④⑤ | D.②③④ |
您最近一年使用:0次
2022-10-21更新
|
179次组卷
|
18卷引用:江西省九江市第一中学2021-2022学年高二上学期第一次月考化学试题
江西省九江市第一中学2021-2022学年高二上学期第一次月考化学试题山西省长治市第二中学校2021-2022学年高二上学期第一次月考化学试题山西省长治市第二中学2019-2020学年高二上学期12月月考化学试题山东省淄博市沂源县第二中学2020-2021学年高二下学期期中考试化学试题黑龙江省齐齐哈尔市第八中学2022-2023学年高二上学期10月月考化学试题重庆市南川中学2022-2023学年高二上学期第一学月考试化学试题河南省濮阳市第一高级中学2023-2024学年高二上学期9月月考化学试题安徽省宣城市2018-2019学年高二下学期期末考试化学试题人教版(2019)高二选择性必修第一册 第二章 化学反应速率与化学平衡 第四节 化学反应的调控 方法帮(已下线)第29练 化学反应的调控-2023年高考化学一轮复习小题多维练(全国通用)宁夏回族自治区银川一中2022-2023学年高二上学期期末考试化学试题山西省太原市2019-2020学年高二上学期期中测评化学试题天津市部分区2022-2023 学年高三上学期1月期末考试化学试题广东省湛江市第二十一中学2022-2023学年高二上学期期中考试化学试题第二章 化学反应速率与化学平衡 第四节 化学反应的调控四川省内江市威远中学校2023-2024学年高二上学期期中考试化学试题四川省内江市威远中学校2023-2024学年高二上学期第二次月考(期中)化学试卷湖北省武汉市重点中学5G联合体2023-2024学年高二上学期期中考试化学试题
7 . 下列有关说法正确的是
A.可以用勒夏特列原理解释2NO2(g) N2O4(g)体系加压后颜色变深 N2O4(g)体系加压后颜色变深 |
B.N2(g)+3H2(g) 2NH3(g) ΔH<0可通过加压方式增大其平衡常数 2NH3(g) ΔH<0可通过加压方式增大其平衡常数 |
| C.合成氨时将氨液化分离,可提高原料的转化率 |
| D.工业上合成氨,其他条件相同时恒温恒容比恒温恒压条件下的N2的转化率大 |
您最近一年使用:0次
8 . 硫酸是一种重要的化工产品,目前主要采用“接触法”进行生产。有关反应2SO2+O2 2SO3的说法中不正确的是
2SO3的说法中不正确的是
 2SO3的说法中不正确的是
2SO3的说法中不正确的是| A.实际生产中,SO2、O2再循环使用提高原料利用率 |
| B.实际生产中,为了提高经济效率压强越高越好 |
| C.在生产中,通入过量空气的目的是提高SO2的转化率 |
| D.实际生产中,选定400~500 ℃作为操作温度的主要原因是催化剂的活性最高 |
您最近一年使用:0次
名校
解题方法
9 . 工业上,以钛白副产品硫酸亚铁制备的铁黄(FeOOH)代替硝酸铁等可溶性铁盐制备高铁酸钾,可降低生产工艺成本且产品质量好。工艺流程如图所示:

已知:①K2FeO4为暗紫色固体,可溶于水,微溶于KOH溶液。
②FeO 具有强氧化性,在酸性或者中性溶液中能产生O2,在碱性溶液中较稳定。
具有强氧化性,在酸性或者中性溶液中能产生O2,在碱性溶液中较稳定。
③铁黄在177℃开始分解。
(1)从电子排布的角度分析,Fe2+稳定性小于Fe3+的原因_______ 。
(2)制备铁黄的离子方程式为_______ 。
(3)实验测得反应液的温度、pH对铁黄产量的影响如图所示。
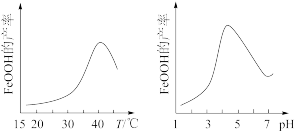
①反应液温度高于40 °C时,铁黄的产量下降的原因可能是_______ 。
②pH大于4.5时铁黄产量降低的主要原因可能是_______ 。
(4)粗产品K2FeO4提纯时采用重结晶、洗涤、低温烘干的方法,洗涤剂最好选用 _______(填序号)。
(5)用K2FeO4处理水时,不仅能消毒杀菌,还能除去水体中的S2-、CN-、NH3等,生成的Fe(OH)3胶体还能吸附水中的悬浮杂质。试写出K2FeO4处理含有CN- 的碱性污水时与CN-反应的离子方程式_______ 。

已知:①K2FeO4为暗紫色固体,可溶于水,微溶于KOH溶液。
②FeO
 具有强氧化性,在酸性或者中性溶液中能产生O2,在碱性溶液中较稳定。
具有强氧化性,在酸性或者中性溶液中能产生O2,在碱性溶液中较稳定。③铁黄在177℃开始分解。
(1)从电子排布的角度分析,Fe2+稳定性小于Fe3+的原因
(2)制备铁黄的离子方程式为
(3)实验测得反应液的温度、pH对铁黄产量的影响如图所示。
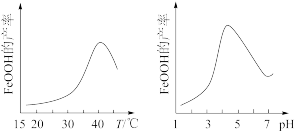
①反应液温度高于40 °C时,铁黄的产量下降的原因可能是
②pH大于4.5时铁黄产量降低的主要原因可能是
(4)粗产品K2FeO4提纯时采用重结晶、洗涤、低温烘干的方法,洗涤剂最好选用 _______(填序号)。
| A.冰水 | B.NaOH溶液 | C.稀硫酸 | D.Fe(NO3)3溶液 |
您最近一年使用:0次
2022-09-02更新
|
333次组卷
|
4卷引用:江苏省南师附中、天一中学、海安中学、海门中学四校2021-2022学年高三12月联考化学试题
10 . 下列有关合成氨工业的说法中正确的是
| A.铁触媒作催化剂可加快反应速率,且有利于化学平衡向合成氨的方向移动 |
| B.升高温度可以加快反应速率,且有利于化学平衡向合成氨的方向移动 |
| C.增大压强能缩短达到平衡状态所用的时间 |
| D.合成氨采用的压强是10~30MPa,因为该压强下铁触媒的活性最高 |
您最近一年使用:0次
2022-07-26更新
|
756次组卷
|
17卷引用:吉林省长春外国语学校2021-2022学年高二上学期第一次月考化学试题
吉林省长春外国语学校2021-2022学年高二上学期第一次月考化学试题湖南省益阳市箴言中学2021-2022学年高二上学期10月月考化学试题黑龙江省大兴安岭实验中学(西校区)2021-2022学年高二上学期第一次月考化学试题黑龙江省哈尔滨市宾县第二中学2021-2022学年高二上学期第二次月考化学试题(已下线)必考点04 化学反应的方向和调控-【对点变式题】2021-2022学年高二化学上学期期中期末必考题精准练(人教版2019选择性必修1)湖南省怀化市第五中学2021-2022学年高二上学期期中考试化学试题新疆昌吉州行知学校2022-2023学年高二上学期第一次线上月考化学试题(已下线)第29练 化学反应的调控-2023年高考化学一轮复习小题多维练(全国通用)(已下线)第12讲 化学反应的调控-【帮课堂】2022-2023学年高二化学同步精品讲义(人教2019选择性必修1)(已下线)2.4.1 合成氨生产适宜条件的选择-【帮课堂】2022-2023学年高二化学同步精品讲义(沪科版2020选择性必修第一册)天津市第二十五中学2022 -2023学年高二上学期期中考试化学试题湖南省隆回县第二中学2022-2023学年高二上学期线上课程摸底(期中)考试化学试题重庆市为明学校2022-2023学年高二上学期期末检测化学试题第四节 化学反应的调控河南省周口市太康县2022-2023学年高二上学期11月期中考试化学试题第二章 第四节 化学反应的调控(已下线)专题06 化学反应的方向及调控【考题猜想】(6大题型)-2023-2024学年高二化学期中考点大串讲(人教版2019选择性必修1)



