解题方法
1 . 近年,科学家研究了乙醇催化合成乙酸乙酯新方法: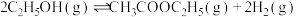 ,在常压下反应,冷凝收集,测得常温下液态收集物中主要产物的质量分数如图所示。关于该方法,下列推测
,在常压下反应,冷凝收集,测得常温下液态收集物中主要产物的质量分数如图所示。关于该方法,下列推测不 合理的是
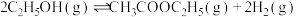 ,在常压下反应,冷凝收集,测得常温下液态收集物中主要产物的质量分数如图所示。关于该方法,下列推测
,在常压下反应,冷凝收集,测得常温下液态收集物中主要产物的质量分数如图所示。关于该方法,下列推测
| A.乙醛是反应中的催化剂 |
| B.减小体系压强,有利于提高乙醇平衡转化率 |
C.反应温度不宜超过 |
| D.该工艺除了产生乙醚、乙酸外,还可能产生乙烯等副产物 |
您最近一年使用:0次
解题方法
2 . I.钛和钨都是非常重要的材料金属,钛、钨资源的高效利用有着非常重要的现实意义。一种利用废催化剂(含TiO2,WO3等)回收金属Ti、W的工艺流程如图所示。
请回答下列问题:
(1)为加快“碱浸”的速率,可采取的措施为___________ (任写两条);“碱浸”时生成偏钛酸钠的离子方程式为___________ 。
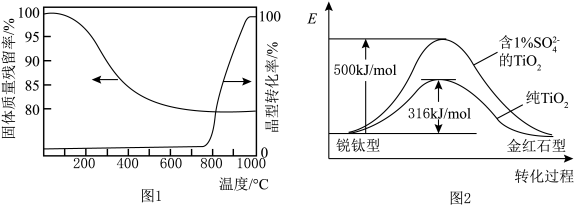
(2)锐钛型和金红石型是TiO2最常见的两种晶体类型,煅烧H2TiO3过程中,TiO2会发生“锐钛型→金红石型”转化,固体质量残留率和晶型转化率随温度变化如图1所示,晶型转化过程中的能量变化如图2所示。___________ 。(可选用的试剂:盐酸溶液、硫酸溶液)
Ⅱ.工业上先将金红石(TiO2)转化为TiCl4,然后可制得在医疗等领域具有重要用途的钛(Ti)。已知在一定条件下如下反应的热化学方程式及平衡常数:
i.
 kJ mol
kJ mol ;
;
ii.2C(s,石墨)
 kJ mol
kJ mol ;
;
iii.碳氯化法: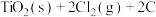 (s石墨)
(s石墨)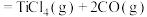
 (
(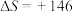 JK
JK mol
mol );
);
(3)△H3=___________ ;K3=___________ (用含K1、K2的代数式表示)。反应iii自发进行的条件为___________ (填“低温”“高温”或“任意温度”)。
(4)在V L的密闭容器中,投入一定量的TiO2、C、Cl2,进行反应iii的模拟实验。体系中气体平衡组成比例(物质的量分数)随温度变化的理论计算结果如图所示。 的平衡常数的值Kc=
的平衡常数的值Kc=___________ (用含n、V的代数式表示)。在200平衡时TiO2几乎完全转化为TiCl4。但实际生产TiCl4采用1000左右的反应温度,其理由是___________ 。
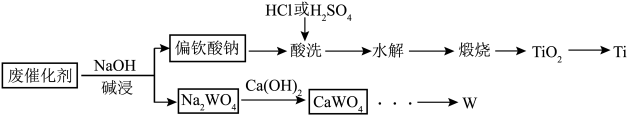
请回答下列问题:
(1)为加快“碱浸”的速率,可采取的措施为
(2)锐钛型和金红石型是TiO2最常见的两种晶体类型,煅烧H2TiO3过程中,TiO2会发生“锐钛型→金红石型”转化,固体质量残留率和晶型转化率随温度变化如图1所示,晶型转化过程中的能量变化如图2所示。
Ⅱ.工业上先将金红石(TiO2)转化为TiCl4,然后可制得在医疗等领域具有重要用途的钛(Ti)。已知在一定条件下如下反应的热化学方程式及平衡常数:
i.

 kJ mol
kJ mol ;
;ii.2C(s,石墨)

 kJ mol
kJ mol ;
;iii.碳氯化法:
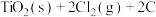 (s石墨)
(s石墨)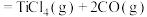
 (
(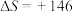 JK
JK mol
mol );
);
(3)△H3=
(4)在V L的密闭容器中,投入一定量的TiO2、C、Cl2,进行反应iii的模拟实验。体系中气体平衡组成比例(物质的量分数)随温度变化的理论计算结果如图所示。
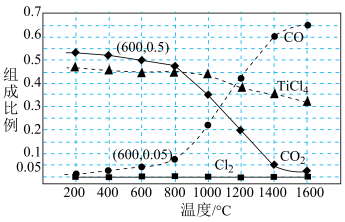
 的平衡常数的值Kc=
的平衡常数的值Kc=
您最近一年使用:0次
名校
解题方法
3 . 实验室用以下装置(夹持和水浴加热装置略)制备乙酸异戊酯(沸点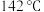 ),实验中利用环己烷—水的共沸体系(沸点
),实验中利用环己烷—水的共沸体系(沸点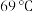 )带出水分,已知体系中沸点最低的有机物是环己烷(沸点
)带出水分,已知体系中沸点最低的有机物是环己烷(沸点 ),其反应原理如下,下列说法错误的是
),其反应原理如下,下列说法错误的是
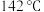 ),实验中利用环己烷—水的共沸体系(沸点
),实验中利用环己烷—水的共沸体系(沸点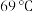 )带出水分,已知体系中沸点最低的有机物是环己烷(沸点
)带出水分,已知体系中沸点最低的有机物是环己烷(沸点 ),其反应原理如下,下列说法错误的是
),其反应原理如下,下列说法错误的是
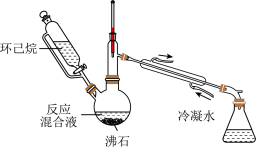
| A.盛装环己烷的仪器名称为恒压滴液漏斗 |
| B.实验时应先加热,再通冷凝水 |
| C.根据带出水的体积可估算反应进度 |
D.反应时水浴温度可控制在 之间 之间 |
您最近一年使用:0次
2024-07-14更新
|
139次组卷
|
2卷引用:河南省漯河市高级中学2023-2024学年高一下学期7月月考化学试题
名校
解题方法
4 . 氨气可用于生产化肥、硝酸等,低成本合成氨技术的研发有利于降低化肥价格,提高种粮农户的积极性。
(1)合成氨工业中,考虑到动力和生产设备的要求,并兼顾化学反应速率和限度,应选择合适的___________ ;考虑到催化剂的活性、化学反应速率和限度,应选择合适的___________ ;如果起始投入2mol  和3mol
和3mol  ,平衡时,容器中还含有1.5mol
,平衡时,容器中还含有1.5mol  ,则此时
,则此时 的转化率为
的转化率为___________ %。
(2)利用生物燃料电池原理可在室温下合成氨,优点是条件温和、生成氨的同时释放电能,电池中通入氮气的一极是___________ 极(填“正”或“负”),若外电路上通过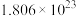 个电子时,理论上会产生
个电子时,理论上会产生___________ g的氨气。
(3)一定温度下,向2L的恒容密闭容器甲中通入2mol 和4mol
和4mol  发生反应,若相同体积的恒容密闭容器乙采用下列投料和条件,容器乙中的化学反应速率比容器甲中快的是
发生反应,若相同体积的恒容密闭容器乙采用下列投料和条件,容器乙中的化学反应速率比容器甲中快的是___________ (填字母)。
a. 和
和 的量与容器甲相同,温度比容器甲高30℃
的量与容器甲相同,温度比容器甲高30℃
b.2mol 、4mol
、4mol  和1mol He
和1mol He
c.1mol 、1mol He和4mol
、1mol He和4mol 
(4)我国科学家研发出一种新型双温催化剂催化合成氨反应,原理如图所示,每生成4.48L(标准状况)的氨气,放出wkJ的能量,若断开1mol化学键 、N—H需要吸收的能量分别为akJ、bkJ,则断开1mol H—H键需要吸收
、N—H需要吸收的能量分别为akJ、bkJ,则断开1mol H—H键需要吸收___________ kJ的能量(用含w、a和b的代数式表示)。
(1)合成氨工业中,考虑到动力和生产设备的要求,并兼顾化学反应速率和限度,应选择合适的
 和3mol
和3mol  ,平衡时,容器中还含有1.5mol
,平衡时,容器中还含有1.5mol  ,则此时
,则此时 的转化率为
的转化率为(2)利用生物燃料电池原理可在室温下合成氨,优点是条件温和、生成氨的同时释放电能,电池中通入氮气的一极是
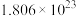 个电子时,理论上会产生
个电子时,理论上会产生(3)一定温度下,向2L的恒容密闭容器甲中通入2mol
 和4mol
和4mol  发生反应,若相同体积的恒容密闭容器乙采用下列投料和条件,容器乙中的化学反应速率比容器甲中快的是
发生反应,若相同体积的恒容密闭容器乙采用下列投料和条件,容器乙中的化学反应速率比容器甲中快的是a.
 和
和 的量与容器甲相同,温度比容器甲高30℃
的量与容器甲相同,温度比容器甲高30℃b.2mol
 、4mol
、4mol  和1mol He
和1mol Hec.1mol
 、1mol He和4mol
、1mol He和4mol 
(4)我国科学家研发出一种新型双温催化剂催化合成氨反应,原理如图所示,每生成4.48L(标准状况)的氨气,放出wkJ的能量,若断开1mol化学键
 、N—H需要吸收的能量分别为akJ、bkJ,则断开1mol H—H键需要吸收
、N—H需要吸收的能量分别为akJ、bkJ,则断开1mol H—H键需要吸收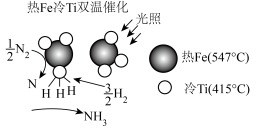
您最近一年使用:0次
2024-07-14更新
|
18次组卷
|
2卷引用:安徽省蚌埠市皖北私立联考2023-2024学年高一下学期5月月考化学试题
名校
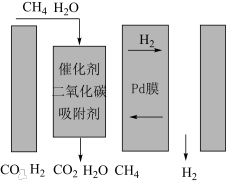
5 . 氢能将在实现“双碳”目标中起重要作用。一种Pd膜反应器催化制氢气原理如下:
i.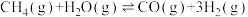
ii.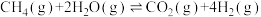
iii.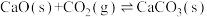
(1)某温度下, 在
在 膜表面上的解离过程如下图,存在如下平衡:
膜表面上的解离过程如下图,存在如下平衡: ,其正反应的活化能远小于逆反应的活化能,下列说法错误的是_______。
,其正反应的活化能远小于逆反应的活化能,下列说法错误的是_______。
(2)在特定温度下,由稳定态单质生成 化合物的焓变叫做该物质在此温度下的标准摩尔生成焓。表中为几种物质在
化合物的焓变叫做该物质在此温度下的标准摩尔生成焓。表中为几种物质在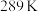 的标准摩尔生成焓,则反应ii的
的标准摩尔生成焓,则反应ii的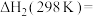
_______ kJ/mol,该反应_______ (填“高温”或“低温”)自发进行。
(3) 、
、 、
、 对复合膜透氢能力影响如下图,
对复合膜透氢能力影响如下图,_______ 对 膜的渗透性能和使用寿命产生致命影响,请结合反应原理和下图分析
膜的渗透性能和使用寿命产生致命影响,请结合反应原理和下图分析 吸附剂
吸附剂 可增加氢气透过率的原因
可增加氢气透过率的原因_______ 。 膜反应器中按甲烷、水蒸气
膜反应器中按甲烷、水蒸气 投料,体系压强为
投料,体系压强为 ,平衡后测得甲烷转化率为80%,
,平衡后测得甲烷转化率为80%, 选择性为60%(
选择性为60%( 选择性
选择性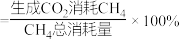 ),氧化钙对二氧化碳的吸收率为50%,则
),氧化钙对二氧化碳的吸收率为50%,则 的分压为
的分压为_______  ,反应i的平衡常数
,反应i的平衡常数
_______ kPa2。(写出计算式即可:用分压代替物质的量浓度计算:分压=总压×物质的量分数)
i.
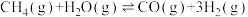
ii.
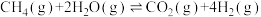
iii.
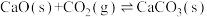
(1)某温度下,
 在
在 膜表面上的解离过程如下图,存在如下平衡:
膜表面上的解离过程如下图,存在如下平衡: ,其正反应的活化能远小于逆反应的活化能,下列说法错误的是_______。
,其正反应的活化能远小于逆反应的活化能,下列说法错误的是_______。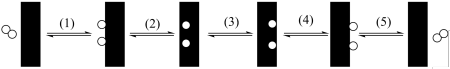
A.过程(1)为 在 在 膜表面上的解离过程, 膜表面上的解离过程, |
B.加快 膜内H原子迁移有利于 膜内H原子迁移有利于 的解离 的解离 |
| C.Pd膜对气体分子的透过具有选择性 |
D.反应器存在 膜时使 膜时使 具有更高转化率 具有更高转化率 |
(2)在特定温度下,由稳定态单质生成
 化合物的焓变叫做该物质在此温度下的标准摩尔生成焓。表中为几种物质在
化合物的焓变叫做该物质在此温度下的标准摩尔生成焓。表中为几种物质在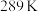 的标准摩尔生成焓,则反应ii的
的标准摩尔生成焓,则反应ii的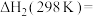
| 物质 |  |  |  |  |
| 标准摩尔生成焓(kJ/mol) | 0 | -394 | -74.6 | -242 |
(3)
 、
、 、
、 对复合膜透氢能力影响如下图,
对复合膜透氢能力影响如下图, 膜的渗透性能和使用寿命产生致命影响,请结合反应原理和下图分析
膜的渗透性能和使用寿命产生致命影响,请结合反应原理和下图分析 吸附剂
吸附剂 可增加氢气透过率的原因
可增加氢气透过率的原因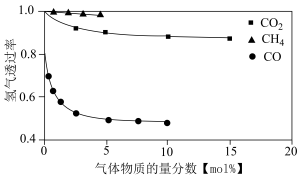
 膜反应器中按甲烷、水蒸气
膜反应器中按甲烷、水蒸气 投料,体系压强为
投料,体系压强为 ,平衡后测得甲烷转化率为80%,
,平衡后测得甲烷转化率为80%, 选择性为60%(
选择性为60%( 选择性
选择性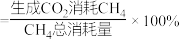 ),氧化钙对二氧化碳的吸收率为50%,则
),氧化钙对二氧化碳的吸收率为50%,则 的分压为
的分压为 ,反应i的平衡常数
,反应i的平衡常数
您最近一年使用:0次
名校
解题方法
6 . 汽车尾气是造成空气污染的重要原因之一,治理汽车尾气是环境保护的重要课题。回答下列问题:
(1)汽车发动机工作时会引发 和
和 反应生成NO,其能量变化如下图所示,图中三种分子中最稳定的是
反应生成NO,其能量变化如下图所示,图中三种分子中最稳定的是_______ 。根据图示数据计算,当有1mol NO生成时,反应会_______ (填“吸收”或“放出”)能量_______ kJ。 ,下图为相同时间内不同催化剂的条件下汽车尾气中NO的转化率随温度的变化情况。该反应最佳的催化剂与温度为
,下图为相同时间内不同催化剂的条件下汽车尾气中NO的转化率随温度的变化情况。该反应最佳的催化剂与温度为_______ 。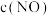 随时间变化的曲线如下图所示。
随时间变化的曲线如下图所示。_______ 。
②由图可知,b条件下,0~10min内,用N2表示反应的平均速率为_______ 。
③a条件下,平衡时的压强与起始压强之比为_______ 。
④下列选项中能说明该反应已经达到平衡状态的是_______ (填序号)。
a.CO和NO的物质的量之比不变
b.混合气体的密度保持不变
c.混合气体的压强保持不变
d.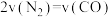
(4) 空气质子交换膜燃料电池将化学能转化为电能的同时,实现了制硝酸、发电、环保三位一体的结合,其工作原理如下图所示,电池负极发生的电极反应为
空气质子交换膜燃料电池将化学能转化为电能的同时,实现了制硝酸、发电、环保三位一体的结合,其工作原理如下图所示,电池负极发生的电极反应为_______ 。
(1)汽车发动机工作时会引发
 和
和 反应生成NO,其能量变化如下图所示,图中三种分子中最稳定的是
反应生成NO,其能量变化如下图所示,图中三种分子中最稳定的是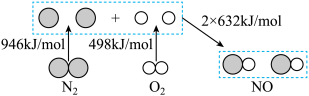
 ,下图为相同时间内不同催化剂的条件下汽车尾气中NO的转化率随温度的变化情况。该反应最佳的催化剂与温度为
,下图为相同时间内不同催化剂的条件下汽车尾气中NO的转化率随温度的变化情况。该反应最佳的催化剂与温度为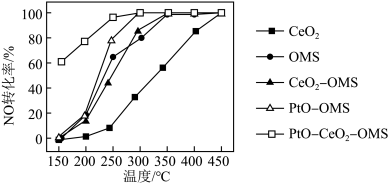
 随时间变化的曲线如下图所示。
随时间变化的曲线如下图所示。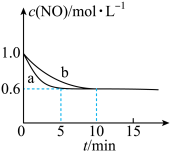
②由图可知,b条件下,0~10min内,用N2表示反应的平均速率为
③a条件下,平衡时的压强与起始压强之比为
④下列选项中能说明该反应已经达到平衡状态的是
a.CO和NO的物质的量之比不变
b.混合气体的密度保持不变
c.混合气体的压强保持不变
d.
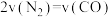
(4)
 空气质子交换膜燃料电池将化学能转化为电能的同时,实现了制硝酸、发电、环保三位一体的结合,其工作原理如下图所示,电池负极发生的电极反应为
空气质子交换膜燃料电池将化学能转化为电能的同时,实现了制硝酸、发电、环保三位一体的结合,其工作原理如下图所示,电池负极发生的电极反应为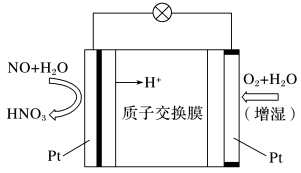
您最近一年使用:0次
名校
7 . 能源是现代文明的原动力,通过化学方法可以使能量按人们所期望的形式转化,从而开辟新能源和提高能源的利用率。请回答下列问题。
I.气态分子中1mol化学键解离成气态原子所吸收的能量称为键能( ),一些共价键的键能如下表所示。
),一些共价键的键能如下表所示。
(1)请根据上表数据计算,在工业合成氨的反应中,当生成17.0g氨气时___________ (填“放出”或“吸收”)的热量为___________ kJ。
Ⅱ.实验室模拟工业合成氨时,在容积为5L的密闭容器内,开始时加入2.0molN2(g)和5.0molH2(g),在20min末,测得NH3(g)的物质的量是1.0mol。
(2)20min末时,N2的体积分数为___________ 。
(3)反应开始至20min,H2的平均反应速率为___________ 。
(4)20min末时,容器内的压强与起始压强之比为___________ 。
(5)一定条件下,将一定量CH4(g)与H2O(g)充入密闭容器中发生反应 ,下列措施可以提高化学反应速率的是
,下列措施可以提高化学反应速率的是___________ 。
a.恒容条件下充入He b.增大容器体积 c.升高温度
d.保持恒容投入更多的H2O(g) e.加入合适的催化剂
(6)下列化学反应过程中的能量变化能用下图表示的有___________ 。
b.乙烷在氧气中燃烧生成水和二氧化碳
c.钠和水反应
d.二氧化碳通过炽热的碳
e.
f.高温煅烧石灰石使其分解
I.气态分子中1mol化学键解离成气态原子所吸收的能量称为键能(
 ),一些共价键的键能如下表所示。
),一些共价键的键能如下表所示。| 共价键 | H-H |  | N-H |
键能( ) ) | 436 | 946 | 391 |
(1)请根据上表数据计算,在工业合成氨的反应中,当生成17.0g氨气时
Ⅱ.实验室模拟工业合成氨时,在容积为5L的密闭容器内,开始时加入2.0molN2(g)和5.0molH2(g),在20min末,测得NH3(g)的物质的量是1.0mol。
(2)20min末时,N2的体积分数为
(3)反应开始至20min,H2的平均反应速率为
(4)20min末时,容器内的压强与起始压强之比为
(5)一定条件下,将一定量CH4(g)与H2O(g)充入密闭容器中发生反应
 ,下列措施可以提高化学反应速率的是
,下列措施可以提高化学反应速率的是a.恒容条件下充入He b.增大容器体积 c.升高温度
d.保持恒容投入更多的H2O(g) e.加入合适的催化剂
(6)下列化学反应过程中的能量变化能用下图表示的有

b.乙烷在氧气中燃烧生成水和二氧化碳
c.钠和水反应
d.二氧化碳通过炽热的碳
e.

f.高温煅烧石灰石使其分解
您最近一年使用:0次
名校
解题方法
8 . 我国合成氨联产甲醇经过近半个世纪的发展,从节能、环保、降耗等方面对联醇工艺实现了组合创新。合成氨联产甲醇工艺是在生产合成氨的同时,利用原料气中的CO、 与
与 进行反应,副产化工原料甲醇。
进行反应,副产化工原料甲醇。
I.在铁触媒的催化下 ,在合成塔中每产生
,在合成塔中每产生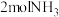 ,放出92.2kJ热量。
,放出92.2kJ热量。
(1)若起始时向密闭容器内充入 和
和 ,达平衡后放出的热量为Q,则Q
,达平衡后放出的热量为Q,则Q___________ (填“>”、“<”或“=”)92.2kJ。
(2)合成氨反应的正反应速率和逆反应速率随时间变化的曲线如下图所示。下列有关说法错误的是___________。
(3)下列关于合成氨反应的描述能说明该反应一定达到化学平衡的是___________。
(4)为了提高氨的产率和生产的效率,可以调控的反应条件是:___________ 、___________ 。(任写两条)
II.利用原料气中的 与
与 一定条件下发生反应:
一定条件下发生反应: ,此反应为放热反应。在体积为1L的密闭容器中,充入
,此反应为放热反应。在体积为1L的密闭容器中,充入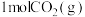 和一定量的
和一定量的 ,测得
,测得 和
和 的浓度随时间变化如图所示。
的浓度随时间变化如图所示。
___________ ;
___________ 。
(6)达到反应限度后, 的转化率为
的转化率为___________ 。(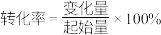 )
)
 与
与 进行反应,副产化工原料甲醇。
进行反应,副产化工原料甲醇。I.在铁触媒的催化下
 ,在合成塔中每产生
,在合成塔中每产生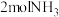 ,放出92.2kJ热量。
,放出92.2kJ热量。(1)若起始时向密闭容器内充入
 和
和 ,达平衡后放出的热量为Q,则Q
,达平衡后放出的热量为Q,则Q(2)合成氨反应的正反应速率和逆反应速率随时间变化的曲线如下图所示。下列有关说法错误的是___________。
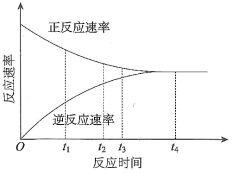
A.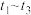 时段,正反应速率一直大于逆反应速率 时段,正反应速率一直大于逆反应速率 |
B. 时刻,反应逆向进行 时刻,反应逆向进行 |
C.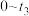 时段,正反应速率一直减小至快接近0 时段,正反应速率一直减小至快接近0 |
D. 时刻,逆反应的速率达到最大 时刻,逆反应的速率达到最大 |
A. 、 、 和 和 的物质的量浓度之比为 的物质的量浓度之比为 |
| B.N2的质量分数保持不变 |
| C.混合气体的压强保持不变 |
D.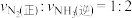 |
II.利用原料气中的
 与
与 一定条件下发生反应:
一定条件下发生反应: ,此反应为放热反应。在体积为1L的密闭容器中,充入
,此反应为放热反应。在体积为1L的密闭容器中,充入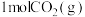 和一定量的
和一定量的 ,测得
,测得 和
和 的浓度随时间变化如图所示。
的浓度随时间变化如图所示。


(6)达到反应限度后,
 的转化率为
的转化率为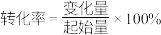 )
)
您最近一年使用:0次
9 . 氨是重要的化工原料,我国目前氨的生产能力位居世界首位。回答下列问题:
(1)工业上通常采用铁触媒作催化剂,在400℃~500℃、10~30MPa,原料气中 和
和 物质的量之比为1.08:3的条件下合成氨,分析说明原料气中
物质的量之比为1.08:3的条件下合成氨,分析说明原料气中 过量的理由是
过量的理由是_____ 。
(2)若在1L的密闭容器中,一定量的氮气和氢气进行如下反应:
 ,其化学平衡常数K与温度T的关系如下表所示。
,其化学平衡常数K与温度T的关系如下表所示。
①试比较 、
、 的大小,
的大小,
_____  (填“>”“<”或“=”)。
(填“>”“<”或“=”)。
②400℃时, 反应中,当测得
反应中,当测得 、
、 和
和 物质的量分别为3mol、2mol和1mol时,则该反应
物质的量分别为3mol、2mol和1mol时,则该反应_____ (填“达到平衡状态”“正向进行”或“逆向进行”)。
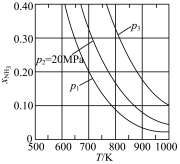
(3)若在不同压强下,以投料比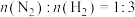 的方式进料,反应达平衡时氨的摩尔分数与温度的计算结果如图所示:(物质i的摩尔分数:
的方式进料,反应达平衡时氨的摩尔分数与温度的计算结果如图所示:(物质i的摩尔分数: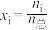 )
)_____ <20MPa<_____ ,判断依据是_____ 。
②当 时,某温度下
时,某温度下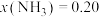 。则该温度下,反应
。则该温度下,反应 的平衡常数
的平衡常数
_____ 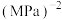 (化为最简式,
(化为最简式, 为以平衡分压代替平衡浓度表示的平衡常数,分压=总压×摩尔分数)。
为以平衡分压代替平衡浓度表示的平衡常数,分压=总压×摩尔分数)。
(4)二十世纪初,工业上以 和
和 为原料在一定温度和压强下合成尿素。反应分两步:a.
为原料在一定温度和压强下合成尿素。反应分两步:a. 和
和 生成
生成 ;b.
;b. 分解生成尿素,结合反应过程中能量变化示意图(如图),回答问题:
分解生成尿素,结合反应过程中能量变化示意图(如图),回答问题:_____ (填“a”或“b”)。
②

_____ kJ/mol(用含“ 、
、 、
、 、
、 ”的代数式表示)。
”的代数式表示)。
(1)工业上通常采用铁触媒作催化剂,在400℃~500℃、10~30MPa,原料气中
 和
和 物质的量之比为1.08:3的条件下合成氨,分析说明原料气中
物质的量之比为1.08:3的条件下合成氨,分析说明原料气中 过量的理由是
过量的理由是(2)若在1L的密闭容器中,一定量的氮气和氢气进行如下反应:

 ,其化学平衡常数K与温度T的关系如下表所示。
,其化学平衡常数K与温度T的关系如下表所示。| T/℃ | 200 | 300 | 400 |
| K |  |  | 0.5 |
 、
、 的大小,
的大小,
 (填“>”“<”或“=”)。
(填“>”“<”或“=”)。②400℃时,
 反应中,当测得
反应中,当测得 、
、 和
和 物质的量分别为3mol、2mol和1mol时,则该反应
物质的量分别为3mol、2mol和1mol时,则该反应(3)若在不同压强下,以投料比
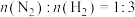 的方式进料,反应达平衡时氨的摩尔分数与温度的计算结果如图所示:(物质i的摩尔分数:
的方式进料,反应达平衡时氨的摩尔分数与温度的计算结果如图所示:(物质i的摩尔分数: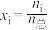 )
)
②当
 时,某温度下
时,某温度下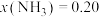 。则该温度下,反应
。则该温度下,反应 的平衡常数
的平衡常数
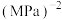 (化为最简式,
(化为最简式, 为以平衡分压代替平衡浓度表示的平衡常数,分压=总压×摩尔分数)。
为以平衡分压代替平衡浓度表示的平衡常数,分压=总压×摩尔分数)。(4)二十世纪初,工业上以
 和
和 为原料在一定温度和压强下合成尿素。反应分两步:a.
为原料在一定温度和压强下合成尿素。反应分两步:a. 和
和 生成
生成 ;b.
;b. 分解生成尿素,结合反应过程中能量变化示意图(如图),回答问题:
分解生成尿素,结合反应过程中能量变化示意图(如图),回答问题: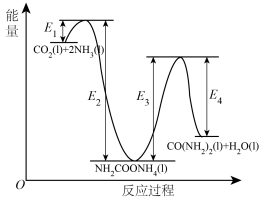
②


 、
、 、
、 、
、 ”的代数式表示)。
”的代数式表示)。
您最近一年使用:0次
10 . HDS废催化剂是石油精炼加工产生的废弃物,但富含Mo、Ni等元素,是重要的二次资源。一种从HDS中回收Mo的工艺流程如图所示。 、
、 、
、 ;
;
②“浸出渣”的成分为 、
、 ;
;
③常温下, 易溶于水。
易溶于水。
(1)钼酸镍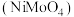 中
中 元素的化合价为
元素的化合价为_____ 价。
(2)“操作1”为_____ ,在化学实验室中“操作1”用到的玻璃仪器有烧杯、_____ 和_____ 。
(3)结合下图,碱浸时选择的 最佳添加量为
最佳添加量为_____ wt%,最佳浸出温度为_____ ℃。 在碱浸时有
在碱浸时有 和
和 生成,该反应化学方程式为
生成,该反应化学方程式为_____ 。
(5)采用碳酸根类型的N263萃取钼的反应为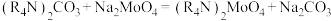 。已知一些离子被
。已知一些离子被 萃取的先后顺序为
萃取的先后顺序为 ,则加入
,则加入 反萃取发生反应的离子方程式为
反萃取发生反应的离子方程式为_____ 。萃取后有机相为 型,加入
型,加入 处理后可实现萃取剂再生。
处理后可实现萃取剂再生。
(6)在实验室进行萃取操作时,需要打开分液漏斗活塞放气,正确的放气图示为_____ (填标号)。_____ 和_____ 。
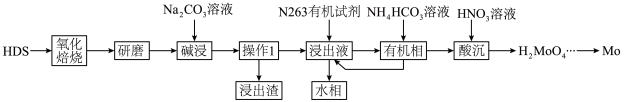
 、
、 、
、 ;
;②“浸出渣”的成分为
 、
、 ;
;③常温下,
 易溶于水。
易溶于水。(1)钼酸镍
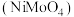 中
中 元素的化合价为
元素的化合价为(2)“操作1”为
(3)结合下图,碱浸时选择的
 最佳添加量为
最佳添加量为
 在碱浸时有
在碱浸时有 和
和 生成,该反应化学方程式为
生成,该反应化学方程式为(5)采用碳酸根类型的N263萃取钼的反应为
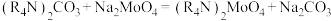 。已知一些离子被
。已知一些离子被 萃取的先后顺序为
萃取的先后顺序为 ,则加入
,则加入 反萃取发生反应的离子方程式为
反萃取发生反应的离子方程式为 型,加入
型,加入 处理后可实现萃取剂再生。
处理后可实现萃取剂再生。(6)在实验室进行萃取操作时,需要打开分液漏斗活塞放气,正确的放气图示为
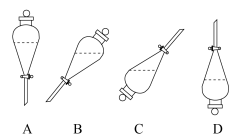
您最近一年使用:0次
2024-06-06更新
|
112次组卷
|
3卷引用:2024届安徽省名校教研联盟高三下学期3月月考化学试卷



