1 . “丁烯裂解法”是一种重要的丙烯生产法,生产过程中会有生成乙烯的副反应发生。反应如下:
主反应: ;
;
副反应: 。
。
测得上述两反应的平衡体系中,各组分的质量分数(w%)随温度(T)和压强(p)变化的趋势分别如图1和图2所示:

(1)平衡体系中的丙烯和乙烯的质量比[ ]是工业生产丙烯时选择反应条件的重要指标之一,从产物的纯度考虑,该数值越高越好,从图1和图2中表现的趋势来看,下列反应条件最适宜的是_______(填字母序号)。
]是工业生产丙烯时选择反应条件的重要指标之一,从产物的纯度考虑,该数值越高越好,从图1和图2中表现的趋势来看,下列反应条件最适宜的是_______(填字母序号)。
(2)有研究者结合图1数据并综合考虑各种因素,认为450℃的反应温度比300℃或700℃更合适,从反应原理角度分析其理由可能是_______ 。
(3)图2中,随压强增大,平衡体系中丙烯的质量分数呈上升趋势,从平衡角度解释其原因是_______ 。
(4)353K时,在刚性容器中充入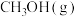 ,发生反应:
,发生反应: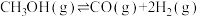 。体系的总压强p随时间t的变化如表所示。
。体系的总压强p随时间t的变化如表所示。
①若升高反应温度至373K,则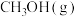 分解后体系压强
分解后体系压强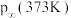
_______ 121.2kPa(填“大于”“小于”或“等于”),原因是_______ 。
②353K时,当该反应达到平衡后,继续充入少量CO(g),反应经过一段时候后重新达到平衡,此时与旧平衡相比,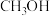 的体积分数
的体积分数_______ (增大、减小或不变)。
主反应:
 ;
;副反应:
 。
。测得上述两反应的平衡体系中,各组分的质量分数(w%)随温度(T)和压强(p)变化的趋势分别如图1和图2所示:

(1)平衡体系中的丙烯和乙烯的质量比[
 ]是工业生产丙烯时选择反应条件的重要指标之一,从产物的纯度考虑,该数值越高越好,从图1和图2中表现的趋势来看,下列反应条件最适宜的是_______(填字母序号)。
]是工业生产丙烯时选择反应条件的重要指标之一,从产物的纯度考虑,该数值越高越好,从图1和图2中表现的趋势来看,下列反应条件最适宜的是_______(填字母序号)。| A.300℃ 0.1MPa | B.700℃ 0.1MPa |
| C.300℃ 0.5MPa | D.700℃ 0.5MPa |
(3)图2中,随压强增大,平衡体系中丙烯的质量分数呈上升趋势,从平衡角度解释其原因是
(4)353K时,在刚性容器中充入
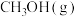 ,发生反应:
,发生反应: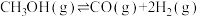 。体系的总压强p随时间t的变化如表所示。
。体系的总压强p随时间t的变化如表所示。| t/min | 0 | 5 | 10 | 15 | 20 |  |
| p/kPa | 101.2 | 107.4 | 112.6 | 116.4 | 118.6 | 121.2 |
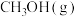 分解后体系压强
分解后体系压强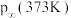
②353K时,当该反应达到平衡后,继续充入少量CO(g),反应经过一段时候后重新达到平衡,此时与旧平衡相比,
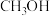 的体积分数
的体积分数
您最近一年使用:0次
名校
解题方法
2 . 在 、
、 的工业生产中,具有的共同点是
的工业生产中,具有的共同点是
 、
、 的工业生产中,具有的共同点是
的工业生产中,具有的共同点是| A.使用吸收塔设备 | B.使用尾气吸收装置 | C.使用 作原料 作原料 | D.使用催化剂 |
您最近一年使用:0次
3 . 科学家利用太阳能分解水生成氢气,再用氢气与二氧化碳在催化剂作用下反应生成甲醇,并开发出直接以甲醇为燃料的燃料电池。已知:
H2(g)+1/2O2(g)=H2O(l) △H=-285.8kJ·mol-1;
CO(g)+1/2O2(g)=CO2(g) △H=-283.0kJ·mol-1;
CH3OH(l)+3/2O2(g)=CO2(g)+2H2O(l) △H=-726.5kJ·mol-1。
请回答下列问题:
(1)用太阳能分解10mol水消耗的能量是_______ kJ;
(2)甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式为_______ ;
(3)CO可用于合成甲醇,反应方程式为CO(g)+2H2(g)⇌CH3OH(g)。CO在不同温度下的平衡转化率与压强的关系如图所示。该反应ΔH_______ 0(填“>”或“<”),实际生产条件控制在250℃、1.3×104kPa左右,选择此压强而不选择更高压强的理由是_______ 。

H2(g)+1/2O2(g)=H2O(l) △H=-285.8kJ·mol-1;
CO(g)+1/2O2(g)=CO2(g) △H=-283.0kJ·mol-1;
CH3OH(l)+3/2O2(g)=CO2(g)+2H2O(l) △H=-726.5kJ·mol-1。
请回答下列问题:
(1)用太阳能分解10mol水消耗的能量是
(2)甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式为
(3)CO可用于合成甲醇,反应方程式为CO(g)+2H2(g)⇌CH3OH(g)。CO在不同温度下的平衡转化率与压强的关系如图所示。该反应ΔH

您最近一年使用:0次
4 . 下列关于工业合成氨的说法正确的是
| A.工业合成氨采用10~30MPa,是因为该条件下催化剂的活性最好 |
| B.选择不同的催化剂会改变此反应△H的数值 |
| C.合成氨工业中采用低温以提高平衡转化率 |
| D.合成氨工业中采用循环操作,主要是为了提高氮气和氢气的利用率 |
您最近一年使用:0次
2022-10-01更新
|
556次组卷
|
6卷引用:河北省邢台市第二中学2022-2023学年高二上学期第一次月考化学试题
2022高三·全国·专题练习
5 . 过氧乙酸(CH3COOOH)不仅在卫生医疗、食品消毒及漂白剂领域有广泛应用,也应用于环境工程、精细化工等领域。实验室利用醋酸(CH3COOH)与双氧水(H2O2)共热,在固体酸的催化下制备过氧乙酸(CH3COOOH),其装置如图所示。请回答下列问题:
实验步骤:
I.先在反应瓶中加入冰醋酸、乙酸丁酯和固体酸催化剂,开通仪器1和8,温度维持为55℃;
II.待真空度达到反应要求时,打开仪器3的活塞,逐滴滴入浓度为35%的双氧水,再通入冷却水;
III.从仪器5定期放出乙酸丁酯和水的混合物,待反应结束后分离反应器2中的混合物,得到粗产品。
反应中维持冰醋酸过量,目的是提高___________ ;分离反应器2中的混合物得到粗产品,分离的方法是___________ 。

实验步骤:
I.先在反应瓶中加入冰醋酸、乙酸丁酯和固体酸催化剂,开通仪器1和8,温度维持为55℃;
II.待真空度达到反应要求时,打开仪器3的活塞,逐滴滴入浓度为35%的双氧水,再通入冷却水;
III.从仪器5定期放出乙酸丁酯和水的混合物,待反应结束后分离反应器2中的混合物,得到粗产品。
反应中维持冰醋酸过量,目的是提高
您最近一年使用:0次
6 . “碳中和”引起各国的高度重视,正成为科学家研究的热点课题。利用CO2生产甲醇是资源化利用CO2的一种有效途径。涉及的反应如下:
反应I:CO2(g)+3H2(g) CH3OH(g)+H2O(g) ΔH=-49.5 kJ·mol-1
CH3OH(g)+H2O(g) ΔH=-49.5 kJ·mol-1
反应II:CO (g)+2H2(g) CH3OH(g)
CH3OH(g)
反应III:CO2(g)+H2(g) CO(g)+H2O(g) ΔH=+41.1kJ·mol-1
CO(g)+H2O(g) ΔH=+41.1kJ·mol-1
(1)分析反应II能自发进行的条件是_______ 。
(2)不同压强下,按照n(CO2):n(H2)=1:3投料,实验测定CO2的平衡转化率和CH3OH的平衡产率随温度的变化关系如下图所示,下列说法正确的是_______。(已知:CO2的平衡转化率= CH3OH的平衡产率=
CH3OH的平衡产率= )
)

(3)若T1℃时,控制条件仅发生反应I,将6molCO2和8molH2充入2L密闭容器中发生上述反应,初始压强为p0 kPa,测得H2的物质的量随时间变化如下图中状态I。图中数据A(1,6)代表在1min 时H2的物质的量是6mol。

①T1℃时,该反应的平衡常数KP=_______ (对于气相反应,用某组分B的平衡压强 p(B)代替物质的量浓度c(B)也可表示平衡常数,记作Kp,如p(B)=p•x(B),p为平衡总压强,x(B)为平衡体系中B的物质的量分数)。
②其他条件不变,仅改变某一条件后,测得H2的物质的量随时间变化如图状态II、状态III 所示。则状态III改变的条件可能是_______ 。
(4)在某催化剂作用下,维持压强不变,按固定初始投料比将CO2和H2按一定流速通过该催化剂发生反应I,反应III,经过相同时间测得实验数据如表(反应未达平衡状态):
注:甲醇的选择性是指发生反应的CO2中转化为甲醇的CO2的百分比。
表中数据说明,升高温度,CO2的实际转化率升高而甲醇的选择性降低,其原因是_______ 。
(5)一定条件下,若只按反应I进行,温度和时间对CO2转化率的影响曲线如下图所示。若图中曲线对应的温度为523K,请在下图中作出温度为583K的影响曲线_________ 。

反应I:CO2(g)+3H2(g)
 CH3OH(g)+H2O(g) ΔH=-49.5 kJ·mol-1
CH3OH(g)+H2O(g) ΔH=-49.5 kJ·mol-1反应II:CO (g)+2H2(g)
 CH3OH(g)
CH3OH(g) 反应III:CO2(g)+H2(g)
 CO(g)+H2O(g) ΔH=+41.1kJ·mol-1
CO(g)+H2O(g) ΔH=+41.1kJ·mol-1(1)分析反应II能自发进行的条件是
(2)不同压强下,按照n(CO2):n(H2)=1:3投料,实验测定CO2的平衡转化率和CH3OH的平衡产率随温度的变化关系如下图所示,下列说法正确的是_______。(已知:CO2的平衡转化率=
 CH3OH的平衡产率=
CH3OH的平衡产率= )
)
| A.纵坐标表示CO2平衡转化率的是图乙 |
| B.压强大小:p1<p2<p3 |
| C.图乙中T1时以反应III为主,压强改变对平衡无影响 |
| D.为同时提高CO2的平衡转化率和CH3OH的平衡产率,应选择低温低压的反应条件 |

①T1℃时,该反应的平衡常数KP=
②其他条件不变,仅改变某一条件后,测得H2的物质的量随时间变化如图状态II、状态III 所示。则状态III改变的条件可能是
(4)在某催化剂作用下,维持压强不变,按固定初始投料比将CO2和H2按一定流速通过该催化剂发生反应I,反应III,经过相同时间测得实验数据如表(反应未达平衡状态):
| T/K | CO2实际转化率/% | 甲醇选择性/% |
| 543 | 12.3 | 42.3 |
| 553 | 15.3 | 39.1 |
表中数据说明,升高温度,CO2的实际转化率升高而甲醇的选择性降低,其原因是
(5)一定条件下,若只按反应I进行,温度和时间对CO2转化率的影响曲线如下图所示。若图中曲线对应的温度为523K,请在下图中作出温度为583K的影响曲线

您最近一年使用:0次
名校
7 . 关于化工生产的叙述中,符合生产实际的是
| A.石油化工中,采用干馏的方法把石油分成不同沸点范围的产品 |
| B.硫酸工业中,利用热交换器预热反应物,降低能耗提高生产效率 |
| C.纯碱工业中,采用侯氏制碱法时向饱和食盐水中依次通入CO2和NH3,提高原料的利用率 |
| D.合成氨工业中,采用高压条件,增大合成氨反应的平衡常数,增大原料转化率 |
您最近一年使用:0次
2022高二·全国·专题练习
名校
8 . 某实验小组利用0.1mol/LNa2S2O3溶液与0.2mol/LH2SO4溶液反应研究外界条件对化学反应速率的影响。设计实验如表:
下列说法不正确的是
| 实验编号 | 温度/℃ | V(Na2S2O3)/mL | V(H2SO4)/mL | V(H2O)/mL | 出现浑浊时间/s |
| ① | 20 | 5.0 | 10.0 | 0 | t1 |
| ② | 20 | 5.0 | 5.0 | a | t2 |
| ③ | 50 | 5.0 | 10.0 | 0 | t3 |
| A.实验②中a=5.0 |
| B.t2>t1>t3 |
| C.实验①、②、③均应先将溶液混合好后再置于不同温度的水浴中 |
| D.实验探究了浓度和温度对化学反应速率的影响 |
您最近一年使用:0次
2022-09-11更新
|
779次组卷
|
6卷引用:第06讲 影响化学反应速率的因素(word讲义)-【帮课堂】2022-2023学年高二化学同步精品讲义(人教2019选择性必修1)
(已下线)第06讲 影响化学反应速率的因素(word讲义)-【帮课堂】2022-2023学年高二化学同步精品讲义(人教2019选择性必修1)上海市进才中学2022-2023学年高二上学期10月阶段测试化学试题黑龙江省哈尔滨师范大学附属中学2022-2023学年高二上学期期中考试化学试题河北省石家庄市第二十七中学2023-2024学年高二上学期第一次月考化学试题浙江省海盐高级中学2023-2024学年高二上学期10月阶段测化学试题2.4 化学反应的调控课堂例题
名校
解题方法
9 . 含碳化合物资源化综合利用,不仅可减少温室气体的排放,还可重新获得重要工业产品。
(1)工业上可通过甲醇洗基化法制取甲酸甲酯,反应为:
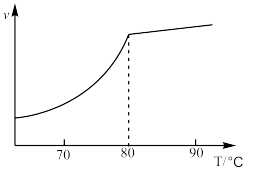
①科研人员对该反应进行了研究,在一定压强时,温度对反应速率的影响如图所示。实际工业生产中采用的温度是 ,其理由是
,其理由是___________ 。
②反应过程发生副反应: 。该反应的机理分二步完成,可以用如图所示,写出第二步的反应方程式
。该反应的机理分二步完成,可以用如图所示,写出第二步的反应方程式___________ 。

(2)华盛顿大学的研究人员研究出一种方法,可实现 零排放,其基本原理如图所示:反应温度控制在
零排放,其基本原理如图所示:反应温度控制在 时,电解质为熔融碳酸钠。电解过程中碳元素转化的过程可描述为
时,电解质为熔融碳酸钠。电解过程中碳元素转化的过程可描述为___________ 。
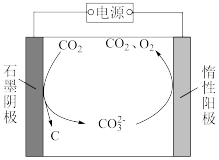
(3) 气氛下乙苯催化脱氢制苯乙烯的反应为:
气氛下乙苯催化脱氢制苯乙烯的反应为: +CO2(g)
+CO2(g) 
 +CO(g)+H2O(g);原料在催化剂面充分吸附进行反应。现保持原料中乙苯浓度不变,增加
+CO(g)+H2O(g);原料在催化剂面充分吸附进行反应。现保持原料中乙苯浓度不变,增加 浓度,乙苯平衡转化率与
浓度,乙苯平衡转化率与 浓度的关系如图所示,请解释乙苯平衡转化率随着
浓度的关系如图所示,请解释乙苯平衡转化率随着 浓度变化的原因
浓度变化的原因___________ 。

(1)工业上可通过甲醇洗基化法制取甲酸甲酯,反应为:

①科研人员对该反应进行了研究,在一定压强时,温度对反应速率的影响如图所示。实际工业生产中采用的温度是
 ,其理由是
,其理由是
②反应过程发生副反应:
 。该反应的机理分二步完成,可以用如图所示,写出第二步的反应方程式
。该反应的机理分二步完成,可以用如图所示,写出第二步的反应方程式
(2)华盛顿大学的研究人员研究出一种方法,可实现
 零排放,其基本原理如图所示:反应温度控制在
零排放,其基本原理如图所示:反应温度控制在 时,电解质为熔融碳酸钠。电解过程中碳元素转化的过程可描述为
时,电解质为熔融碳酸钠。电解过程中碳元素转化的过程可描述为
(3)
 气氛下乙苯催化脱氢制苯乙烯的反应为:
气氛下乙苯催化脱氢制苯乙烯的反应为: +CO2(g)
+CO2(g) 
 +CO(g)+H2O(g);原料在催化剂面充分吸附进行反应。现保持原料中乙苯浓度不变,增加
+CO(g)+H2O(g);原料在催化剂面充分吸附进行反应。现保持原料中乙苯浓度不变,增加 浓度,乙苯平衡转化率与
浓度,乙苯平衡转化率与 浓度的关系如图所示,请解释乙苯平衡转化率随着
浓度的关系如图所示,请解释乙苯平衡转化率随着 浓度变化的原因
浓度变化的原因
您最近一年使用:0次
解题方法
10 . 工业合成氨:
 ,一般采用700K左右的温度,其原因是
,一般采用700K左右的温度,其原因是
①提高 的平衡转化率②适当提高氨的合成速率③提高氨的产率④催化剂在700K左右时活性最大
的平衡转化率②适当提高氨的合成速率③提高氨的产率④催化剂在700K左右时活性最大

 ,一般采用700K左右的温度,其原因是
,一般采用700K左右的温度,其原因是①提高
 的平衡转化率②适当提高氨的合成速率③提高氨的产率④催化剂在700K左右时活性最大
的平衡转化率②适当提高氨的合成速率③提高氨的产率④催化剂在700K左右时活性最大| A.只有① | B.②④ | C.②③④ | D.①② |
您最近一年使用:0次
2022-09-04更新
|
458次组卷
|
4卷引用:第四节 化学反应的调控
第四节 化学反应的调控福建省三明市三地三校2019-2020学年高二上学期期中联考化学试题河南省洛阳市第一中学2022-2023学年高二上学期期末检测化学试题(已下线)化学反应速率与化学平衡——课时7化学反应的调控



