名校
1 . 下列叙述与图对应的是
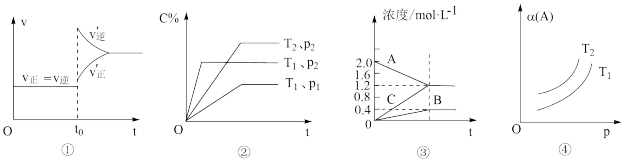

A.已达平衡状态的反应:N2(g)+3H2(g)  2NH3(g),图①表示在t0时刻充入了一定量的NH3,平衡逆向移动 2NH3(g),图①表示在t0时刻充入了一定量的NH3,平衡逆向移动 |
B.由图②可知,P2>P1、T1>T2满足反应:2A(g)+B(g)  2C(g) ΔH<0 2C(g) ΔH<0 |
| C.图③表示的反应方程式为:2A(g)=B(g)+3C(g) |
D.由图④可知,对于反应aA(g) bB(g)+cC(g),该反应用于工业生产时,采用的压强越大越好 bB(g)+cC(g),该反应用于工业生产时,采用的压强越大越好 |
您最近一年使用:0次
2023-02-02更新
|
406次组卷
|
2卷引用:四川省成都石室中学2022—2023学年高二上学期期中考试化学试题
名校
解题方法
2 . 铜和三氧化二铁在工农业生产中用途广泛,用黄铜矿(主要成分为 ,其中
,其中 为+2价、
为+2价、 为+2价)制取铜和三氧化二铁的工艺流程如图所示:
为+2价)制取铜和三氧化二铁的工艺流程如图所示:
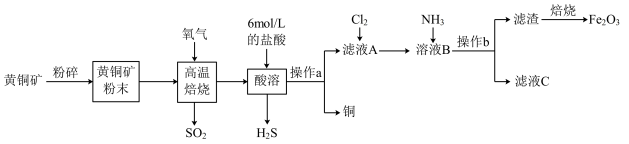
(1)将黄铜矿粉碎的目的是_______ 。
(2)高温熔烧时发生的反应是 ,当1
,当1
 参加反应时,反应中转移电子
参加反应时,反应中转移电子_______  。
。
(3)向滤液A中通入 的目的是
的目的是_______ 。
(4)向溶液B中通入 后发生反应的离子方程式为
后发生反应的离子方程式为_______ 。
(5)工业上用生物法处理 的原理为(硫杆菌作催化剂):
的原理为(硫杆菌作催化剂):

由图甲和图乙可知,使用硫杆菌的最佳条件为_______ ,若反应温度过高,反应速率下降,其原因是_______ 。

 ,其中
,其中 为+2价、
为+2价、 为+2价)制取铜和三氧化二铁的工艺流程如图所示:
为+2价)制取铜和三氧化二铁的工艺流程如图所示:
(1)将黄铜矿粉碎的目的是
(2)高温熔烧时发生的反应是
 ,当1
,当1
 参加反应时,反应中转移电子
参加反应时,反应中转移电子 。
。(3)向滤液A中通入
 的目的是
的目的是(4)向溶液B中通入
 后发生反应的离子方程式为
后发生反应的离子方程式为(5)工业上用生物法处理
 的原理为(硫杆菌作催化剂):
的原理为(硫杆菌作催化剂):
由图甲和图乙可知,使用硫杆菌的最佳条件为

您最近一年使用:0次
2022-11-22更新
|
176次组卷
|
4卷引用:四川省德阳市第五中学校2022-2023学年高二上学期期中考试化学试题
四川省德阳市第五中学校2022-2023学年高二上学期期中考试化学试题(已下线)山东省济南市2022届高三3月高考模拟考试(一模)(工业流程题)四川省绵阳市南山中学实验学校2022-2023学年高二下学期2月月考化学试题四川省宾市叙州区第二中学校2023-2024学年高二上学期11月期中化学试题
名校
3 . 工业合成氨是人类科学技术的一项重大突破,目前已有三位科学家因其获得诺贝尔奖。回答下列问题:
(1)科学家研究利用铁触媒催化合成氨的反应历程如图所示,其中吸附在催化剂表面的物种用“ ”表示。
”表示。

上述历程中反应速率最慢的步骤的化学方程式为_______ 。由图得出合成氨反应 的
的
 ,又已知:
,又已知: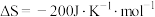 ,则合成氨反应在常温
,则合成氨反应在常温 下
下_______ (填“能”或“不能”)自发。
(2)_______ 温(填“高”或“低”,下同)有利于提高反应速率,_______ 温有利于提高平衡转化率,综合考虑催化剂(铁触媒)活性等因素,工业常采用400C~500℃。
针对反应速率与平衡产率的矛盾,我国科学家提出了如下解决方案。
(3)方案: 复合催化剂。
复合催化剂。


下列说法正确的是_______ 。
A.300℃时,复合催化剂比单一催化剂效率更高
B.同温同压下,复合催化剂有利于提高氨的平衡产率
C.温度越高,复合催化剂活性一定越高
(4)某合成氨速率方程为: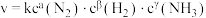 ,其中
,其中 为速率常数,根据表中数据,
为速率常数,根据表中数据,
_______ 。
在合成氨过程中,需要不断分离出氨的原因为_______ 。
A.有利于平衡正向移动 B.防止催化剂中毒 C.提高正反应速率
(1)科学家研究利用铁触媒催化合成氨的反应历程如图所示,其中吸附在催化剂表面的物种用“
 ”表示。
”表示。
上述历程中反应速率最慢的步骤的化学方程式为
 的
的
 ,又已知:
,又已知: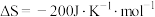 ,则合成氨反应在常温
,则合成氨反应在常温 下
下(2)
针对反应速率与平衡产率的矛盾,我国科学家提出了如下解决方案。
(3)方案:
 复合催化剂。
复合催化剂。

下列说法正确的是
A.300℃时,复合催化剂比单一催化剂效率更高
B.同温同压下,复合催化剂有利于提高氨的平衡产率
C.温度越高,复合催化剂活性一定越高
(4)某合成氨速率方程为:
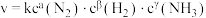 ,其中
,其中 为速率常数,根据表中数据,
为速率常数,根据表中数据,
| 实验 | c(N2)/mol•L-1 | c(H2)/mol•L-1 | c(NH3)/mol•L-1 | v/mol·L-1·s-1 |
| 1 | m | n | p | q |
| 2 | 2m | n | p | 2q |
| 3 | m | n | 0.1p | 10q |
| 4 | m | 2n | p | 2.828q |
A.有利于平衡正向移动 B.防止催化剂中毒 C.提高正反应速率
您最近一年使用:0次
名校
解题方法
4 . 铬是一种重要的金属材料,被广泛用于冶金、化工、耐火材料等行业。某铬铁矿的主要成分为Cr2O3、Fe2O3、FeO,还有少量 MgO、Al2O3和杂质SiO2等,利用其制备多种铬产品和其他金属产品的工艺流程如下:

已知:Al2O3+Na2CO3 2NaAlO2+CO2↑ SiO2+Na2CO3
2NaAlO2+CO2↑ SiO2+Na2CO3 Na2SiO3+CO2↑
Na2SiO3+CO2↑
回答下列问题:
(1)步骤①发生的主要反应为2FeO+Cr2O3+2Na2CO3+4NaNO3 2Na2CrO4+Fe2O3+4NaNO2+2A↑,反应时应选用何种材质的容器?_______(填字母)。
2Na2CrO4+Fe2O3+4NaNO2+2A↑,反应时应选用何种材质的容器?_______(填字母)。
(2)步骤②的操作是_______ ,“滤渣 2”是Al(OH)3和_______ 。 写出过量物质A与“滤液1"中溶质生成Al(OH)3 的离子方程式:_______ 。
(3)“滤液2”中的Na2CrO4需要用H2SO4酸化,用离子方程式表示该反应:_______ 。
(4)制取高纯铬常用电解法和铝热法,铝热法的缺点是_______ 。步骤④是在隔绝空气条件下,除生成Cr2O3 外,还生成了Na2CO3和CO,若该反应中有3 molNa2Cr2O7 参加反应,则转移的电子为_______ mol。
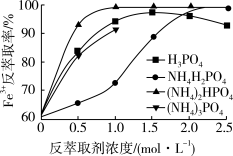
(5)“滤渣1”中铁元素含量较高,具有回收价值。为回收金属,需要将含Fe3+的有机相进行反萃取,当反萃取剂的浓度均为0.5 mol•L-1 时,反萃取效果最好的物质是_______ (填化学式)。

已知:Al2O3+Na2CO3
 2NaAlO2+CO2↑ SiO2+Na2CO3
2NaAlO2+CO2↑ SiO2+Na2CO3 Na2SiO3+CO2↑
Na2SiO3+CO2↑回答下列问题:
(1)步骤①发生的主要反应为2FeO+Cr2O3+2Na2CO3+4NaNO3
 2Na2CrO4+Fe2O3+4NaNO2+2A↑,反应时应选用何种材质的容器?_______(填字母)。
2Na2CrO4+Fe2O3+4NaNO2+2A↑,反应时应选用何种材质的容器?_______(填字母)。| A.塑料 | B.刚玉 | C.铁 | D.石英 |
(3)“滤液2”中的Na2CrO4需要用H2SO4酸化,用离子方程式表示该反应:
(4)制取高纯铬常用电解法和铝热法,铝热法的缺点是
(5)“滤渣1”中铁元素含量较高,具有回收价值。为回收金属,需要将含Fe3+的有机相进行反萃取,当反萃取剂的浓度均为0.5 mol•L-1 时,反萃取效果最好的物质是

您最近一年使用:0次
解题方法
5 . 苯酚(C6H5OH)是一种广泛使用、易氧化的化工产品。一种在650K下用N2O废气催化氧化苯制备苯酚的新方法为:反应C6H6(g)+N2O(g)  C6H5OH(g)+N2(g)。
C6H5OH(g)+N2(g)。
(1)已知6C(s,石墨)+3H2(g) C6H6(g) ΔH1=+82.9kJ·mol-1
C6H6(g) ΔH1=+82.9kJ·mol-1
2N2(g)+O2(g) 2N2O(g) ΔH2=+163.2kJ·mol-1
2N2O(g) ΔH2=+163.2kJ·mol-1
12C(s,石墨)+6H2(g)+O2(g) 2C6H5OH(g) ΔH3=-243kJ·mol-1
2C6H5OH(g) ΔH3=-243kJ·mol-1
则C6H6(g)+N2O(g) C6H5OH(g)+N2(g) ΔH=
C6H5OH(g)+N2(g) ΔH=_______ kJ·mol-1。
(2)制备苯酚的苯和N2O的最佳投料比为10:1。此时,N2O、N2的平衡浓度分别为0.050mol/L、0.95mol/L。则制备反应的平衡常数Kc=_______ (写出计算式)。
(3)如图中,温度过低造成苯酚产率低的主要原因是_______ ;反应时间过长造成产率下降的可能原因是_______ 。

(4)反应中使用更高效的催化剂_______ (填“可”或“不可”)提高反应的平衡转化率。已知475℃下反应仍未达到平衡,此时的苯酚产率比450℃时的低,可能原因是_______ 。
(5)研究表明,反应速率符合关系式v=kca(C6H6)cb(N2O),有关数据如表:
有人据此提出反应可分为三个步骤:
①N2O→N2+O*(活性氧) 快反应
②C6H6+O*→C6H5OH*(活性苯酚) 慢反应
③C6H5OH*→C6H5OH 快反应
下列有关说法正确的是_______ 。
 C6H5OH(g)+N2(g)。
C6H5OH(g)+N2(g)。(1)已知6C(s,石墨)+3H2(g)
 C6H6(g) ΔH1=+82.9kJ·mol-1
C6H6(g) ΔH1=+82.9kJ·mol-12N2(g)+O2(g)
 2N2O(g) ΔH2=+163.2kJ·mol-1
2N2O(g) ΔH2=+163.2kJ·mol-112C(s,石墨)+6H2(g)+O2(g)
 2C6H5OH(g) ΔH3=-243kJ·mol-1
2C6H5OH(g) ΔH3=-243kJ·mol-1则C6H6(g)+N2O(g)
 C6H5OH(g)+N2(g) ΔH=
C6H5OH(g)+N2(g) ΔH=(2)制备苯酚的苯和N2O的最佳投料比为10:1。此时,N2O、N2的平衡浓度分别为0.050mol/L、0.95mol/L。则制备反应的平衡常数Kc=
(3)如图中,温度过低造成苯酚产率低的主要原因是

(4)反应中使用更高效的催化剂
(5)研究表明,反应速率符合关系式v=kca(C6H6)cb(N2O),有关数据如表:
| c(C6H6)/×10-3mol·L-1 | c(N2O)/×10-3mol·L-1 | v/×10-3mol·L-1·s-1 |
| 12 | 8.0 | 1.0 |
| 24 | 8.0 | 2.0 |
| 24 | 24 | 6.0 |
①N2O→N2+O*(活性氧) 快反应
②C6H6+O*→C6H5OH*(活性苯酚) 慢反应
③C6H5OH*→C6H5OH 快反应
下列有关说法正确的是
| A.O*(活性氧)是该反应的催化剂 | B.②的反应的活化能最小 |
| C.反应速率v(N2O)=v(N2) | D.第二步中C6H6与O*的碰撞仅部分有效 |
您最近一年使用:0次
6 . 碳及其化合物与人类工农业生产、生活紧密相关。如甲醇就是一种重要的化工原料。
(1)已知:①CH3OH(l)+ O2(g)=CO2(g)+2H2O(g) ΔH =-637.8 kJ·mol-1;
O2(g)=CO2(g)+2H2O(g) ΔH =-637.8 kJ·mol-1;
②2CO(g)+O2(g)=2CO2(g) ΔH=- 566.0 kJ·mol-1
则反应③CH3OH(1)+O2(g) CO(g)+2H2O(g)的ΔH=
CO(g)+2H2O(g)的ΔH=________________ 。
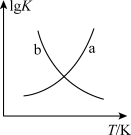
(2)图中能正确表示反应③的平衡常数的对数(lgK)随着温度(T)变化的曲线是_____________ (填“a”或“b”)。
(3)不同催化剂对CO和H2生成CH3OH的效果比较如下表所示:
①结合上表信息综合考虑,建议目前最好选择____________ 作催化剂。一般来说,催化剂的活性越好,表示使反应活化能降低得越____________ (填“多”或“少”),反应速率越____________ (填“快”或“慢”);
②选择催化剂无须考虑的因素是____________ (填正确答案标号)
A.更长的使用寿命
B.在延长使用期间有更高的平衡转化率
C.较高的活性和优越的选择性,副产物少
D.在较大的合成气组成范围内的操作弹性
E.对硫敏感(易与杂质气体中的硫元素结合)
(4)某实验室控制CO和H2的初始投料比为1:2 (物质的量)时,进行反应:
CO(g)+2H2(g) CH3OH(g) ΔH= - 90.0 kJ·mol-1
CH3OH(g) ΔH= - 90.0 kJ·mol-1
下列措施不利于提高CO平衡转化率的措施是 。(填正确答案标号)
(1)已知:①CH3OH(l)+
 O2(g)=CO2(g)+2H2O(g) ΔH =-637.8 kJ·mol-1;
O2(g)=CO2(g)+2H2O(g) ΔH =-637.8 kJ·mol-1; ②2CO(g)+O2(g)=2CO2(g) ΔH=- 566.0 kJ·mol-1
则反应③CH3OH(1)+O2(g)
 CO(g)+2H2O(g)的ΔH=
CO(g)+2H2O(g)的ΔH=(2)图中能正确表示反应③的平衡常数的对数(lgK)随着温度(T)变化的曲线是

(3)不同催化剂对CO和H2生成CH3OH的效果比较如下表所示:
| 催化剂种类 | 操作条件 | 性能比较 |
| 锌铬催化剂 (ZnO-Cr2O3) | 590 K-670 K 25 MPa-35 MPa | 选择性低 活性低 |
| 铜基催化剂 (CuO-ZnO-Al2O3) | 483 K-573 K 5 MPa-10 MPa | 选择性高(99%) 活性好 |
| 钯系催化剂 | ________ | 选择性低 活性一般 |
| 钼系催化剂 (MoS2-K2CO3-MgO-SiO2) | 533 K 8.1 MPa | 选择性53.2% CO的转化率36.1% |
②选择催化剂无须考虑的因素是
A.更长的使用寿命
B.在延长使用期间有更高的平衡转化率
C.较高的活性和优越的选择性,副产物少
D.在较大的合成气组成范围内的操作弹性
E.对硫敏感(易与杂质气体中的硫元素结合)
(4)某实验室控制CO和H2的初始投料比为1:2 (物质的量)时,进行反应:
CO(g)+2H2(g)
 CH3OH(g) ΔH= - 90.0 kJ·mol-1
CH3OH(g) ΔH= - 90.0 kJ·mol-1下列措施不利于提高CO平衡转化率的措施是 。(填正确答案标号)
| A.适当降低反应温度 |
| B.恒压条件下再充入a mol CO和2a mol H2 |
| C.恒容条件下再充入a mol CO和2a mol H2 |
| D.液化分离甲醇 |
您最近一年使用:0次
解题方法
7 . CO2加氢可合成低碳烯烃。CO2加氢合成C2H4发生的主要反应如下:
①CO2(g) + H2(g) ⇌CO(g) + H2O(g) ΔH1 = +41.3 kJ·mol-1
②2CO(g) + 4H2(g) ⇌C2H4(g) + 2H2O(g) ΔH2 = -210.5 kJ·mol-1
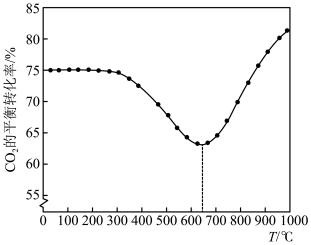
图是其他条件一定时,反应温度对CO2平衡转化率影响的曲线(已知:多步递进反应中,条件不同时,反应物转化率可能由不同步骤的反应决定)。下列说法错误的是
①CO2(g) + H2(g) ⇌CO(g) + H2O(g) ΔH1 = +41.3 kJ·mol-1
②2CO(g) + 4H2(g) ⇌C2H4(g) + 2H2O(g) ΔH2 = -210.5 kJ·mol-1
图是其他条件一定时,反应温度对CO2平衡转化率影响的曲线(已知:多步递进反应中,条件不同时,反应物转化率可能由不同步骤的反应决定)。下列说法错误的是

| A.温度高于约650°C时,以反应①为主 |
| B.温度从300°C升高到约650°C过程中,CO2平衡转化率增大 |
| C.增大压强(缩小容器体积),可以提高CO2的平衡转化率 |
| D.选择合适的催化剂,可以提高C2H4的产率 |
您最近一年使用:0次
名校
解题方法
8 . 能源问题是人类社会面临的重大课题,甲醇是一种可再生能源,具有开发应用的广阔前景,研究甲醇具有重要意义。
(1)利用工业废气中的CO2可制取甲醇,其反应为:CO2+3H2⇌CH3OH+H2O。
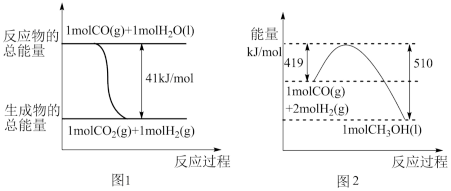
①常温常压下,已知反应的能量变化如图1、图2所示,由二氧化碳和氢气制备甲醇的热化学方程式为_____ 。
②为探究用CO2生产燃料甲醇的反应原理,现进行如下实验:在一恒温恒容密闭容器中,充入lmolCO2和3molH2,进行上述反应。测得CO2和CH3OH(g)的浓度随时间变化如图所示。从反应开始到平衡,v(H2)=_____ ;该温度下的平衡常数数值K=______ (保留两位有效数字);能使平衡体系中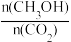 增大的措施有
增大的措施有_____ (任写一条)。

(2)工业上利用甲醇制备氢气的常用方法有两种。
①甲醇蒸汽重整法。主要反应为CH3OH(g)⇌CO(g)+2H2(g);设在容积为2.0L的密闭容器中充入0.60molCH3OH(g),体系压强为P1,在一定条件下达到平衡时,体系压强为P2,且P2/P1=2.2,则该条件下CH3OH的平衡转化率为_____ 。
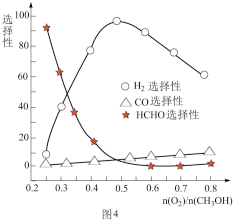
②甲醇部分氧化法。在一定温度下以Ag/CeO2—ZnO为催化剂时原料气比例对反应的选择性(选择性越大,表示生成的该物质越多)影响关系如图4所示,则当 =0.25时,CH3OH与O2发生的主要反应方程式
=0.25时,CH3OH与O2发生的主要反应方程式_____ 。在制备H2时最好控制 =
=_____ 。
(1)利用工业废气中的CO2可制取甲醇,其反应为:CO2+3H2⇌CH3OH+H2O。
①常温常压下,已知反应的能量变化如图1、图2所示,由二氧化碳和氢气制备甲醇的热化学方程式为

②为探究用CO2生产燃料甲醇的反应原理,现进行如下实验:在一恒温恒容密闭容器中,充入lmolCO2和3molH2,进行上述反应。测得CO2和CH3OH(g)的浓度随时间变化如图所示。从反应开始到平衡,v(H2)=
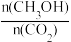 增大的措施有
增大的措施有
(2)工业上利用甲醇制备氢气的常用方法有两种。
①甲醇蒸汽重整法。主要反应为CH3OH(g)⇌CO(g)+2H2(g);设在容积为2.0L的密闭容器中充入0.60molCH3OH(g),体系压强为P1,在一定条件下达到平衡时,体系压强为P2,且P2/P1=2.2,则该条件下CH3OH的平衡转化率为
②甲醇部分氧化法。在一定温度下以Ag/CeO2—ZnO为催化剂时原料气比例对反应的选择性(选择性越大,表示生成的该物质越多)影响关系如图4所示,则当
 =0.25时,CH3OH与O2发生的主要反应方程式
=0.25时,CH3OH与O2发生的主要反应方程式 =
=
您最近一年使用:0次
2022-02-09更新
|
886次组卷
|
4卷引用:四川省南充市南部县第二中学2021-2022学年高二下学期3月月考化学试题
解题方法
9 . 我国提出2060年前实现碳中和,降低大气中CO2含量是当今世界重要科研课题之一,以CO2为原料制备甲烷、戊烷、甲醇等能源物质具有较好的发展前景。问答下列问题:
(1)CO2在固体催化表面加氢合成甲烷过程中发生以下两个反应:
主反应:CO2(g)+4H2(g)⇌CH4(g)+2H2O(g) ΔH1=-156.9kJ·mol-1
副反应:CO2(g)+H2(g)⇌CO(g)+H2O(g) ΔH2=+41.1kJ·mol-1
①已知2H2(g)+O2(g)=2H2O(g) ΔH3=-395.6kJ·mol-1,则CH4燃烧的热化学方程式CH4(g)+2O2(g)=CO2(g)+2H2O(g) ΔH=___________
②加氢合成甲烷时,通常控制温度为500℃左右,其原因为该温度下有较高的化学反应速率和___________
③500℃时,向1L恒容密闭容器中充入4molCO2和12molH2,初始压强为p,20min时主、副反应都达到平衡状态,测得c(H2O)=5mol·L-1,体系压强为 ,则0~20min内v(CH4)=
,则0~20min内v(CH4)=___________ mol·L-lmin-1,平衡时CH4选择性=___________ (CH4选择性=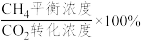 )。
)。
(2)我国科研人员将CO2和H2在Na-Fe3O4/HZSM-5催化下转变为汽油(C5~C11的烃),反应过程如下图所示。
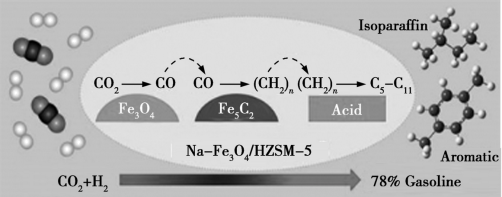
①若CO2在该条件下转化为戊烷(C5H12),则该反应的化学方程式为___________
②催化剂中的Fe3O4可用电解法制备。电解时以Fe做电极,电解质溶液为稀硫酸,其阳极反应式为___________
(3)甲醇催化制取乙烯的过程中发生如下反应:
反应1:3CH3OH⇌C3H6(g)+H2O(g);
反应2:2CH3OH(g)⇌C2H4(g)+2H2O(g)
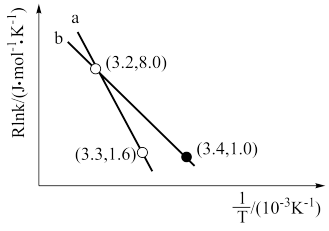
反应I的Arrhenius经验公式的实验数据如图中曲线a所示,已知Arhenius经验公式Rlnk= (Ea为活化能,k为速率常数,R和C为常数)。则该反应的活化能(10K)Ea=
(Ea为活化能,k为速率常数,R和C为常数)。则该反应的活化能(10K)Ea=___________ kJ·mol-1。当改变外界条件时,实验数据如图中的曲线b所示,则实验可能改变的外界条件是___________
(1)CO2在固体催化表面加氢合成甲烷过程中发生以下两个反应:
主反应:CO2(g)+4H2(g)⇌CH4(g)+2H2O(g) ΔH1=-156.9kJ·mol-1
副反应:CO2(g)+H2(g)⇌CO(g)+H2O(g) ΔH2=+41.1kJ·mol-1
①已知2H2(g)+O2(g)=2H2O(g) ΔH3=-395.6kJ·mol-1,则CH4燃烧的热化学方程式CH4(g)+2O2(g)=CO2(g)+2H2O(g) ΔH=
②加氢合成甲烷时,通常控制温度为500℃左右,其原因为该温度下有较高的化学反应速率和
③500℃时,向1L恒容密闭容器中充入4molCO2和12molH2,初始压强为p,20min时主、副反应都达到平衡状态,测得c(H2O)=5mol·L-1,体系压强为
 ,则0~20min内v(CH4)=
,则0~20min内v(CH4)=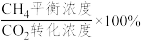 )。
)。(2)我国科研人员将CO2和H2在Na-Fe3O4/HZSM-5催化下转变为汽油(C5~C11的烃),反应过程如下图所示。

①若CO2在该条件下转化为戊烷(C5H12),则该反应的化学方程式为
②催化剂中的Fe3O4可用电解法制备。电解时以Fe做电极,电解质溶液为稀硫酸,其阳极反应式为
(3)甲醇催化制取乙烯的过程中发生如下反应:
反应1:3CH3OH⇌C3H6(g)+H2O(g);
反应2:2CH3OH(g)⇌C2H4(g)+2H2O(g)
反应I的Arrhenius经验公式的实验数据如图中曲线a所示,已知Arhenius经验公式Rlnk=
 (Ea为活化能,k为速率常数,R和C为常数)。则该反应的活化能(10K)Ea=
(Ea为活化能,k为速率常数,R和C为常数)。则该反应的活化能(10K)Ea=
您最近一年使用:0次
2022-02-02更新
|
895次组卷
|
4卷引用:四川省成都附属实验中学2021-2022学年高三下学期第一次模拟考试理科综合化学试题
四川省成都附属实验中学2021-2022学年高三下学期第一次模拟考试理科综合化学试题安徽省马鞍山市 2021-2022学年高三第一次教学质量监测理综化学试题(已下线)押江苏卷第18题 化学反应原理综合题 -备战2022年高考化学临考题号押题(江苏卷)(已下线)题型26 多反应体系中的化学平衡
解题方法
10 . 铅在有色金属产量中居第四位,全世界消费的铅中大约有80%~85%用于铅蓄电池,下面是废铅蓄电池预处理获得的铅膏回收制取PbCl2的工艺流程:

已知:①铅膏含铅组成表:
②PbCl2是白色结晶性粉末,微溶于冷水,易溶于热水、浓盐酸和氢氧化钠溶液。
③已知浸取时PbSO4可溶于盐酸与食盐水混合溶液生成 。
。
回答下列问题:
(1)铅膏浸取前通常需要研磨,目的是_______ 。
(2)“浸取”过程会产生混合气体,其成分是_______ 和少量Cl2,写出PbO2氧化盐酸产生Cl2的化学方程式_______ 。
(3)25℃时PbCl2固体在浓盐酸中存在平衡:PbCl2(s)+2Cl-(aq)
 (aq),从平衡移动角度分析浸取时加入饱和食盐水的目的是
(aq),从平衡移动角度分析浸取时加入饱和食盐水的目的是_______ 。
(4)铅膏浸取时,浓盐酸与水配比(浓盐酸与水的体积比)对铅浸出率的影响如下图1,温度对铅浸出率的影响如下图2。

①浸取时,最合理的浓盐酸与水配比和温度分别是:_______ ,_______ 。
②低于70℃时,随温度升高铅浸出率增大的原因可能是(写一点):_______ 。
(5)提高铅回收率,可将IV步滤液补加一定量盐酸后循环用于铅膏浸取,重复循环实验,所得结果如下:
循环实验铅浸出率、铅回收率及氯化铅纯度表
循环4次后产品PbCl2的纯度骤降,增加的杂质主要是钠盐(填化学式):_______ 。为了恢复PbCl2的纯度,可以在IV步滤液中加入CaCl2使杂质离子沉淀后再进行循环操作,请用离子方程式表示其除杂原理:_______ 。

已知:①铅膏含铅组成表:
| 物相 | PbO | PbO2 | PbSO4 | Pb | 总铅 |
| 含量/% | 15.89 | 4.86 | 33.74 | 34.03 | 76.05 |
③已知浸取时PbSO4可溶于盐酸与食盐水混合溶液生成
 。
。回答下列问题:
(1)铅膏浸取前通常需要研磨,目的是
(2)“浸取”过程会产生混合气体,其成分是
(3)25℃时PbCl2固体在浓盐酸中存在平衡:PbCl2(s)+2Cl-(aq)

 (aq),从平衡移动角度分析浸取时加入饱和食盐水的目的是
(aq),从平衡移动角度分析浸取时加入饱和食盐水的目的是(4)铅膏浸取时,浓盐酸与水配比(浓盐酸与水的体积比)对铅浸出率的影响如下图1,温度对铅浸出率的影响如下图2。

①浸取时,最合理的浓盐酸与水配比和温度分别是:
②低于70℃时,随温度升高铅浸出率增大的原因可能是(写一点):
(5)提高铅回收率,可将IV步滤液补加一定量盐酸后循环用于铅膏浸取,重复循环实验,所得结果如下:
循环实验铅浸出率、铅回收率及氯化铅纯度表
| 循环次数 | 0 | 1 | 2 | 3 | 4 |
| 铅浸出率/% | 99.5 | 99.5 | 99.4 | 99.5 | 99. 3 |
| 铅回收率/% | 85.4 | 93.5 | 95.8 | 97.1 | 98.2 |
| 氯化铅纯度/% | 99.4 | 99.3 | 99.2 | 99.1 | 96.1 |
您最近一年使用:0次



