名校
解题方法
1 . 钌 粉主要用于生产钌靶材,而钌靶材是生产计算机硬盘不可替代的材料。以钌废料(废料中钌主要以单质的形式存在,还含有Al、Cr、Cr、CO、Ti、Fe等杂质)制备高纯钌粉的流程如下:
粉主要用于生产钌靶材,而钌靶材是生产计算机硬盘不可替代的材料。以钌废料(废料中钌主要以单质的形式存在,还含有Al、Cr、Cr、CO、Ti、Fe等杂质)制备高纯钌粉的流程如下:
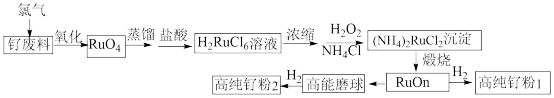
已知:i.钌在碱性条件下被氯气氧化为 ,
, 是有毒的挥发性物质,用盐酸吸收得到红色
是有毒的挥发性物质,用盐酸吸收得到红色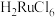 溶液,其中还含有少量
溶液,其中还含有少量 ;
;
ii.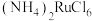 易溶于水,微溶于酒精。
易溶于水,微溶于酒精。
回答下列问题:
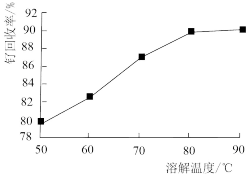
(1)钌废料在碱性条件下被氯气氧化的离子方程式为_______ ;钌废料氧化时,随着温度的升高,钌的回收率变化如图所示。综合考虑,确定氧化时的温度以_______ ℃为宜。
(2)用盐酸吸收蒸馏产物时发生主要反应的化学方程式是_______ 。
(3)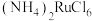 沉淀用乙醇洗涤而不用水洗涤的优点是
沉淀用乙醇洗涤而不用水洗涤的优点是_______ 。
(4)加入 的主要作用是
的主要作用是_______ ,同时又调节了溶液的 ,有利于沉淀反应的发生。流程中可以循环利用的物质
,有利于沉淀反应的发生。流程中可以循环利用的物质_______ 。
(5)煅烧的过程分为两步:第1步是氯钌酸铵分解生成钌单质和一种无毒的气体单质,同时有两种化合物生成;第2步是钌单质与氧气反应生成钌的氧化物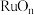 (
(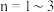 )。第1步的化学方程式是
)。第1步的化学方程式是_______ 。
 粉主要用于生产钌靶材,而钌靶材是生产计算机硬盘不可替代的材料。以钌废料(废料中钌主要以单质的形式存在,还含有Al、Cr、Cr、CO、Ti、Fe等杂质)制备高纯钌粉的流程如下:
粉主要用于生产钌靶材,而钌靶材是生产计算机硬盘不可替代的材料。以钌废料(废料中钌主要以单质的形式存在,还含有Al、Cr、Cr、CO、Ti、Fe等杂质)制备高纯钌粉的流程如下: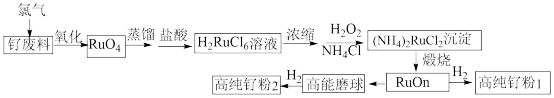
已知:i.钌在碱性条件下被氯气氧化为
 ,
, 是有毒的挥发性物质,用盐酸吸收得到红色
是有毒的挥发性物质,用盐酸吸收得到红色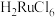 溶液,其中还含有少量
溶液,其中还含有少量 ;
;ii.
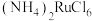 易溶于水,微溶于酒精。
易溶于水,微溶于酒精。回答下列问题:
(1)钌废料在碱性条件下被氯气氧化的离子方程式为

(2)用盐酸吸收蒸馏产物时发生主要反应的化学方程式是
(3)
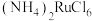 沉淀用乙醇洗涤而不用水洗涤的优点是
沉淀用乙醇洗涤而不用水洗涤的优点是(4)加入
 的主要作用是
的主要作用是 ,有利于沉淀反应的发生。流程中可以循环利用的物质
,有利于沉淀反应的发生。流程中可以循环利用的物质(5)煅烧的过程分为两步:第1步是氯钌酸铵分解生成钌单质和一种无毒的气体单质,同时有两种化合物生成;第2步是钌单质与氧气反应生成钌的氧化物
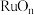 (
(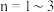 )。第1步的化学方程式是
)。第1步的化学方程式是
您最近一年使用:0次
2023-01-16更新
|
275次组卷
|
5卷引用:山东省济南市2022届高三3月高考模拟考试(一模)(工业流程题)
(已下线)山东省济南市2022届高三3月高考模拟考试(一模)(工业流程题)(已下线)湖北省七市(州)2023届高三3月联合统一调研测试化学试题变式题(工业流程题)山东省鄄城县第一中学2022-2023学年高三上学期期末考试化学试题山东省菏泽市郓城县实验中学2022-2023学年高三上学期期末考试化学试题河南省南阳市新野县第一高级中学校2023-2024学年高三上学期12月月考化学试题
解题方法
2 . 锰及其化合物用途广泛,以菱锰矿(主要成分为 ,还含有铁、镍、钴的碳酸盐以及
,还含有铁、镍、钴的碳酸盐以及 杂质)为原料生产金属锰和高品位
杂质)为原料生产金属锰和高品位 的工艺流程如图1所示。
的工艺流程如图1所示。

已知 时,部分物质的溶度积常数如表所示:
时,部分物质的溶度积常数如表所示:
(1)“溶浸”时,锰的浸出率与浸出时间的关系如图2所示。由图可知,所采用的最佳实验条件(温度、时间)为_______ 。

(2) 主要用于氧化
主要用于氧化_______ 。滤渣1中残余的 可加入葡萄糖-硫酸溶液处理,回收
可加入葡萄糖-硫酸溶液处理,回收 ,氧化产物为
,氧化产物为 ,写出反应的离子方程式:
,写出反应的离子方程式:_______ 。
(3)滤渣3的主要成分为_______ (填化学式,其中 、
、 均为
均为 价)。
价)。
(4)“沉锰”时 除了作沉淀剂外,还有
除了作沉淀剂外,还有_______ 作用;“沉锰”的关键操作有两点:①将 溶液加入
溶液加入 溶液中;②反应终点溶液
溶液中;②反应终点溶液 。如果①中颠倒试剂滴加顺序(反应
。如果①中颠倒试剂滴加顺序(反应 大于7),可能造成的后果是
大于7),可能造成的后果是_______ ;若反应终点溶液 小于7,可能的后果是
小于7,可能的后果是_______ 。
(5)以 作电极,
作电极,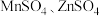 溶液为电解液,经过一系列步骤制得隐形战机涂料
溶液为电解液,经过一系列步骤制得隐形战机涂料 ,则电解时阳极生成
,则电解时阳极生成 的电极总反应式为
的电极总反应式为_______ 。
 ,还含有铁、镍、钴的碳酸盐以及
,还含有铁、镍、钴的碳酸盐以及 杂质)为原料生产金属锰和高品位
杂质)为原料生产金属锰和高品位 的工艺流程如图1所示。
的工艺流程如图1所示。
已知
 时,部分物质的溶度积常数如表所示:
时,部分物质的溶度积常数如表所示:| 物质 |  |  |  |  |  |  |  |
 | 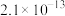 | 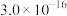 | 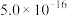 |  | 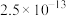 | 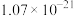 |  |

(2)
 主要用于氧化
主要用于氧化 可加入葡萄糖-硫酸溶液处理,回收
可加入葡萄糖-硫酸溶液处理,回收 ,氧化产物为
,氧化产物为 ,写出反应的离子方程式:
,写出反应的离子方程式:(3)滤渣3的主要成分为
 、
、 均为
均为 价)。
价)。(4)“沉锰”时
 除了作沉淀剂外,还有
除了作沉淀剂外,还有 溶液加入
溶液加入 溶液中;②反应终点溶液
溶液中;②反应终点溶液 。如果①中颠倒试剂滴加顺序(反应
。如果①中颠倒试剂滴加顺序(反应 大于7),可能造成的后果是
大于7),可能造成的后果是 小于7,可能的后果是
小于7,可能的后果是(5)以
 作电极,
作电极,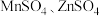 溶液为电解液,经过一系列步骤制得隐形战机涂料
溶液为电解液,经过一系列步骤制得隐形战机涂料 ,则电解时阳极生成
,则电解时阳极生成 的电极总反应式为
的电极总反应式为
您最近一年使用:0次
2023-01-14更新
|
311次组卷
|
3卷引用:广东省广州市2022届高三一模考试(工业流程题)
解题方法
3 . 氮化钼作为锂离子电池负极材料具有很好的发展前景。从废催化剂(主要成分为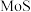 、
、 和
和 )中提取钒和钼工艺流程如下:
)中提取钒和钼工艺流程如下:

已知:①熔砂为对应金属元素的含氧酸盐( 、
、 等)
等)
② ,
,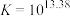 ;
;
③ 的溶解度(
的溶解度(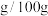 水):0.48(20℃)、1.32(40℃)、2.42(60℃)
水):0.48(20℃)、1.32(40℃)、2.42(60℃)
(1) 中
中 元素的化合价为
元素的化合价为_______ ,基态钒原子核外电子排布式为_______ 。
(2)“焙烧”中,将 和废催化剂磨成粉末从炉顶投料,空气从炉底鼓入,目的是
和废催化剂磨成粉末从炉顶投料,空气从炉底鼓入,目的是_______ 。焙烧生成的 、
、 气体经过
气体经过_______ 溶液(填“ 、
、 或
或 ”)处理后可用于“沉铝”工序。
”)处理后可用于“沉铝”工序。
(3)“沉铝”中铝元素恰好沉淀完全时滤液的 为
为_______ 。(通常认为溶液中离子浓度不大于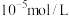 为沉淀完全)
为沉淀完全)
(4)“沉钒”中,下列说法正确的是_______。
(5)“沉钼”的离子方程式为_______ 。
(6)“沉钼”得到的四钼酸铵与六亚甲基四胺在一定条件下反应可制取氮化钼,晶胞如图所示。氮化钼的化学式为_______ ,氮原子周围距离最近的钼原子有_______ 个。若晶胞边长为 ,则晶体的密度为
,则晶体的密度为_______  。
。

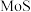 、
、 和
和 )中提取钒和钼工艺流程如下:
)中提取钒和钼工艺流程如下:
已知:①熔砂为对应金属元素的含氧酸盐(
 、
、 等)
等)②
 ,
,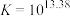 ;
;
③
 的溶解度(
的溶解度(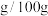 水):0.48(20℃)、1.32(40℃)、2.42(60℃)
水):0.48(20℃)、1.32(40℃)、2.42(60℃)(1)
 中
中 元素的化合价为
元素的化合价为(2)“焙烧”中,将
 和废催化剂磨成粉末从炉顶投料,空气从炉底鼓入,目的是
和废催化剂磨成粉末从炉顶投料,空气从炉底鼓入,目的是 、
、 气体经过
气体经过 、
、 或
或 ”)处理后可用于“沉铝”工序。
”)处理后可用于“沉铝”工序。(3)“沉铝”中铝元素恰好沉淀完全时滤液的
 为
为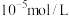 为沉淀完全)
为沉淀完全)(4)“沉钒”中,下列说法正确的是_______。
| A.低温有利于析出晶体 |
B.增加 的浓度能降低 的浓度能降低 的溶解度 的溶解度 |
| C.实际生产中,沉钒时间越长越好 |
| D.温度超过50℃,溶液中逸出的氨气增多 |
(6)“沉钼”得到的四钼酸铵与六亚甲基四胺在一定条件下反应可制取氮化钼,晶胞如图所示。氮化钼的化学式为
 ,则晶体的密度为
,则晶体的密度为 。
。
您最近一年使用:0次
解题方法
4 . 镓是我国战略储备金属之一,在电子通信、新能源、芯片、军工等领域有着重要应用。某废渣粉煤灰主要含有Al2O3、SiO2,还有少量的Fe2O3、Ga2O3,一种从中提取镓的工艺流程如图: 、GaO
、GaO 形式存在;
形式存在;
②常温下Al(OH)3(s)+OH-(aq) AlO
AlO (aq)+2H2O(l),平衡常数K=100.63。回答下列问题:
(aq)+2H2O(l),平衡常数K=100.63。回答下列问题:
(1)粉煤灰需“球磨”至40目筛子(孔径为0.425mm的漏筛)漏出再焙烧,目的是_____ 。
(2)“焙烧”时碳酸钠与SiO2反应的化学方程式为_____ 。
(3)“碱浸”时镓的浸出率随温度、时间变化如图所示,反应适宜的温度为_____ ,时间为____ 。_____ (填名称),过程中若要使铝元素在常温下恰好沉淀完全(含Al物质浓度恰好为10-5mol/L),计算此时溶液的c(OH-)=_____ (写出计算过程)。
(5)写出解析过程中GaO 被H2SO4解析为Ga3+的离子方程式:
被H2SO4解析为Ga3+的离子方程式:_____ 。

 、GaO
、GaO 形式存在;
形式存在;②常温下Al(OH)3(s)+OH-(aq)
 AlO
AlO (aq)+2H2O(l),平衡常数K=100.63。回答下列问题:
(aq)+2H2O(l),平衡常数K=100.63。回答下列问题:(1)粉煤灰需“球磨”至40目筛子(孔径为0.425mm的漏筛)漏出再焙烧,目的是
(2)“焙烧”时碳酸钠与SiO2反应的化学方程式为
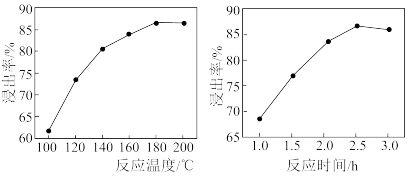
(3)“碱浸”时镓的浸出率随温度、时间变化如图所示,反应适宜的温度为
(5)写出解析过程中GaO
 被H2SO4解析为Ga3+的离子方程式:
被H2SO4解析为Ga3+的离子方程式:
您最近一年使用:0次
解题方法
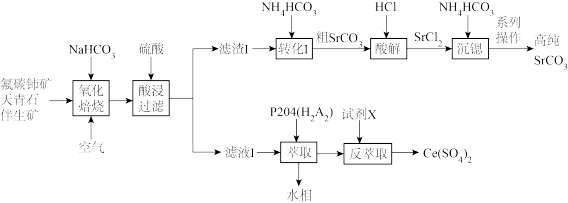
5 . 铈(Ce)是一种应用广泛的稀土元素,从氟碳铈矿(主要含CeFCO3、Fe2O3、SiO2)和天青石(主要含SrSO4、并含有少量Ba、Ca等杂质)伴生矿中回收铈,同时生产高纯碳酸锶(SrCO3)的一种生产工艺流程如图:
已知:①铈的常见价态是+3和+4价;
②碳酸氢铵受热易分解
(1)① 中Ce的化合价为
中Ce的化合价为_______ ;
②“氧化焙烧”时,Ce元素转化为CeO2,F元素转化为NaF,该过程中氧化剂与还原剂的物质的量之比为_______ 。
(2)焙烧温度是影响浸出率的关键因素之一,下图为不同焙烧温度对Ce和Sr浸出率的影响。
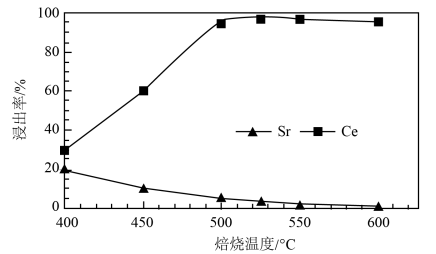
结合实际生产可知,“氧化焙烧”步骤应控制焙烧温度为_______ ,原因为_______ 。
(3)“沉锶”步骤中发生的离子反应方程式:_______ 。
(4)“萃取”步骤的原理为: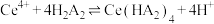 ,则试剂X为
,则试剂X为_______ 。

已知:①铈的常见价态是+3和+4价;
②碳酸氢铵受热易分解
(1)①
 中Ce的化合价为
中Ce的化合价为②“氧化焙烧”时,Ce元素转化为CeO2,F元素转化为NaF,该过程中氧化剂与还原剂的物质的量之比为
(2)焙烧温度是影响浸出率的关键因素之一,下图为不同焙烧温度对Ce和Sr浸出率的影响。

结合实际生产可知,“氧化焙烧”步骤应控制焙烧温度为
(3)“沉锶”步骤中发生的离子反应方程式:
(4)“萃取”步骤的原理为:
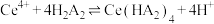 ,则试剂X为
,则试剂X为
您最近一年使用:0次
名校
解题方法
6 . 铜和三氧化二铁在工农业生产中用途广泛,用黄铜矿(主要成分为 ,其中
,其中 为+2价、
为+2价、 为+2价)制取铜和三氧化二铁的工艺流程如图所示:
为+2价)制取铜和三氧化二铁的工艺流程如图所示:
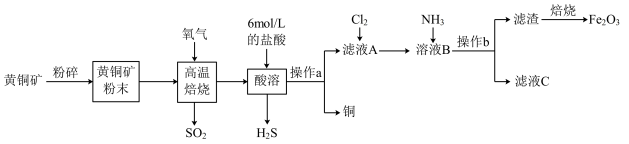
(1)将黄铜矿粉碎的目的是_______ 。
(2)高温熔烧时发生的反应是 ,当1
,当1
 参加反应时,反应中转移电子
参加反应时,反应中转移电子_______  。
。
(3)向滤液A中通入 的目的是
的目的是_______ 。
(4)向溶液B中通入 后发生反应的离子方程式为
后发生反应的离子方程式为_______ 。
(5)工业上用生物法处理 的原理为(硫杆菌作催化剂):
的原理为(硫杆菌作催化剂):

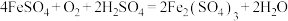
由图甲和图乙可知,使用硫杆菌的最佳条件为_______ ,若反应温度过高,反应速率下降,其原因是_______ 。

 ,其中
,其中 为+2价、
为+2价、 为+2价)制取铜和三氧化二铁的工艺流程如图所示:
为+2价)制取铜和三氧化二铁的工艺流程如图所示:
(1)将黄铜矿粉碎的目的是
(2)高温熔烧时发生的反应是
 ,当1
,当1
 参加反应时,反应中转移电子
参加反应时,反应中转移电子 。
。(3)向滤液A中通入
 的目的是
的目的是(4)向溶液B中通入
 后发生反应的离子方程式为
后发生反应的离子方程式为(5)工业上用生物法处理
 的原理为(硫杆菌作催化剂):
的原理为(硫杆菌作催化剂):
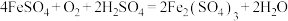
由图甲和图乙可知,使用硫杆菌的最佳条件为

您最近一年使用:0次
2022-11-22更新
|
177次组卷
|
4卷引用:山东省济南市2022届高三3月高考模拟考试(一模)(工业流程题)
(已下线)山东省济南市2022届高三3月高考模拟考试(一模)(工业流程题)四川省德阳市第五中学校2022-2023学年高二上学期期中考试化学试题四川省绵阳市南山中学实验学校2022-2023学年高二下学期2月月考化学试题四川省宾市叙州区第二中学校2023-2024学年高二上学期11月期中化学试题
名校
解题方法
7 . 金属铼(Re)广泛应用于国防、石油化工以及电子制造等领域,铼可通过还原高铼酸铵(NH4ReO4)制备。以钼精矿(主要成分为钼的硫化物和少量铼的硫化物)制取高铼酸铵的流程如下图所示。

回答下列问题:
(1)为了提高“焙烧”过程的效率,可以采取的措施为_______ (回答任意两点)。
(2)“焙烧”过程加入生石灰,有效解决了SO2的危害,则ReS2转化为Ca(ReO4)2的方程式为_______ 。
(3)“浸渣”的主要成分为_______
(4)“萃取”机理为:R3N+H++ReO =R3N·HReO4,则“反萃取”所用试剂X为
=R3N·HReO4,则“反萃取”所用试剂X为_______
(5)“反萃取”后,从NH4ReO4溶液中得到晶体的操作为_______ 、过滤、洗涤、干燥。
(6)NH4ReO4经过高温氢气还原即可获得铼粉,该反应的化学方程式为_______ 。
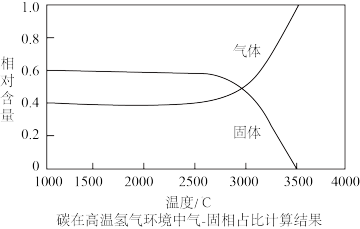
(7)经过上述反应后制备的铼粉中含有少量碳粉和铁粉(其熔沸点见表),在3500℃下,利用氢气提纯可得到纯度达99.995%的铼粉,请分析原因_______ 。

回答下列问题:
(1)为了提高“焙烧”过程的效率,可以采取的措施为
(2)“焙烧”过程加入生石灰,有效解决了SO2的危害,则ReS2转化为Ca(ReO4)2的方程式为
(3)“浸渣”的主要成分为
(4)“萃取”机理为:R3N+H++ReO
 =R3N·HReO4,则“反萃取”所用试剂X为
=R3N·HReO4,则“反萃取”所用试剂X为(5)“反萃取”后,从NH4ReO4溶液中得到晶体的操作为
(6)NH4ReO4经过高温氢气还原即可获得铼粉,该反应的化学方程式为
(7)经过上述反应后制备的铼粉中含有少量碳粉和铁粉(其熔沸点见表),在3500℃下,利用氢气提纯可得到纯度达99.995%的铼粉,请分析原因
| 物质 | 熔点(℃) | 沸点(℃) |
| Re | 3180 | 5900 |
| C | 3652 | 4827 |
| Fe | 1535 | 2750 |

您最近一年使用:0次
2022-11-18更新
|
537次组卷
|
4卷引用:山东省济南市2022届高三3月高考模拟考试(一模)(工业流程题)
(已下线)山东省济南市2022届高三3月高考模拟考试(一模)(工业流程题)湖北省高中名校联盟2022-2023学年高三上学期第二次联合测评化学试卷湖北大学附属中学2023届高三上学期第二次联合测评化学试题湖北省高中名校联盟2022-2023学年高三上学期11月月考化学试题
8 . 下列有关化学工业的叙述错误的是
A.工业制备硝酸的第一步反应是N2+O2 2NO 2NO |
| B.煤通过直接液化和间接液化可制得燃料和化工原料 |
| C.合成氨工业采用循环操作,目的是提高氮气和氢气的利用率 |
| D.玻璃是将石灰石、纯碱、石英砂在玻璃窑中高温熔融制得 |
您最近一年使用:0次
2022-11-18更新
|
725次组卷
|
4卷引用:热点情景汇编-专题二 科学、技术、社会、环境中的化学
(已下线)热点情景汇编-专题二 科学、技术、社会、环境中的化学湖北省高中名校联盟2022-2023学年高三上学期第二次联合测评化学试卷湖北大学附属中学2023届高三上学期第二次联合测评化学试题湖北省高中名校联盟2022-2023学年高三上学期11月月考化学试题
2022高二·上海·专题练习
名校
9 . 下列事实符合化学平衡移动原理的是
①Cl2在饱和食盐水中的溶解度比纯水中小
②降温有利于N2和H2反应生成NH3
③可以用浓氨水和浓氢氧化钠溶液或固体来制取氨气
④加催化剂有利于合成氨的反应
⑤工业上生产硫酸的过程中,使用过量的空气以提高二氧化硫的利用率
⑥500℃左右的温度比室温更有利于合成氨的反应
①Cl2在饱和食盐水中的溶解度比纯水中小
②降温有利于N2和H2反应生成NH3
③可以用浓氨水和浓氢氧化钠溶液或固体来制取氨气
④加催化剂有利于合成氨的反应
⑤工业上生产硫酸的过程中,使用过量的空气以提高二氧化硫的利用率
⑥500℃左右的温度比室温更有利于合成氨的反应
| A.①②③④⑤⑥ | B.①②③⑤ | C.①②③⑤⑥ | D.①②③④⑥ |
您最近一年使用:0次
2022高二·上海·专题练习
解题方法
10 . 工业上合成氨是在一定条件下进行如下反应:N2(g)+3H2(g) 2NH3(g) ΔH=-92.2kJ•mol-1,其部分工艺流程如图所示:
2NH3(g) ΔH=-92.2kJ•mol-1,其部分工艺流程如图所示:

反应体系中各组分的部分性质见表:
回答:
(1)写出该反应的化学平衡常数表达式:K=____ 。随着温度升高,K值____ (填“增大”“减小”或“不变”)。
(2)K值越大,表明____ (填字母)。
(3)在工业上采取气体循环的流程,即反应后通过把混合气体的温度降低到____ 使____ 分离出来;继续循环的气体是____ 。
 2NH3(g) ΔH=-92.2kJ•mol-1,其部分工艺流程如图所示:
2NH3(g) ΔH=-92.2kJ•mol-1,其部分工艺流程如图所示:
反应体系中各组分的部分性质见表:
| 气体 | 氮气 | 氢气 | 氨 |
| 熔点/℃ | -210.01 | -259.77 | -77.74 |
| 沸点/℃ | -195.79 | -252.23 | -33.42 |
(1)写出该反应的化学平衡常数表达式:K=
(2)K值越大,表明
| A.其他条件相同时N2的转化率越高 |
| B.其他条件相同时NH3的产率越大 |
| C.原料中N2的含量越高 |
| D.化学反应速率越快 |
您最近一年使用:0次



