2022高二·上海·专题练习
解题方法
1 . 合成氨反应通常控制在20~50MPa的压强和500℃左右的温度,且进入合成塔的氮气和氢气的体积比为1∶3,经科学测定,在相应条件下氮气和氢气反应所得氨的平衡浓度(体积分数)如表所示:
而实际从合成塔出来的混合气体中含有氨约为15%,这表明
| 20MPa | 60MPa | |
| 500℃ | 19.1 | 42.2 |
| A.表中所测数据有明显误差 |
| B.生产条件控制不当 |
| C.氨的分解速率大于预测值 |
| D.合成塔中的反应并未达到平衡 |
您最近一年使用:0次
2022-10-29更新
|
124次组卷
|
3卷引用:2.4.1 合成氨生产适宜条件的选择-【帮课堂】2022-2023学年高二化学同步精品讲义(沪科版2020选择性必修第一册)
(已下线)2.4.1 合成氨生产适宜条件的选择-【帮课堂】2022-2023学年高二化学同步精品讲义(沪科版2020选择性必修第一册)作业(十五) 化学反应条件的优化--工业合成氨第二章 第四节 化学反应的调控
2022高二·上海·专题练习
解题方法
2 . 在硫酸工业中,通过下列反应将SO2 氧化成SO3:2SO2(g)+O2(g)  2SO3(g) ΔH<0。
2SO3(g) ΔH<0。
已知催化剂是V2O5,在400℃-500℃左右时催化效果最好。下表为不同温度和压强下SO2的转化率:
试回答:
(1)根据化学理论和以上数据综合分析,为了使二氧化硫尽快地转化为三氧化硫,从化学反应速率的角度考虑,应该选择什么样的条件?______
(2)根据化学理论和以上数据综合分析,为了使二氧化硫尽量多地转化为三氧化硫,从化学反应限度的角度考虑,应该选择什么样的条件?______
(3)在实际生产中,选定450℃左右作为操作温度,其原因是什么?______
(4)根据表中的数据分析,制取SO3时采用的压强是多少?原因是什么?______
(5)在生产中,通入过量空气的目的是什么?______
(6)根据上述分析,实际工业生产中该反应应选择的条件是什么?______
 2SO3(g) ΔH<0。
2SO3(g) ΔH<0。已知催化剂是V2O5,在400℃-500℃左右时催化效果最好。下表为不同温度和压强下SO2的转化率:
| 压强 | 1×105 Pa | 1×106 Pa | 5×106 Pa | 1×107 Pa |
| 450℃时SO2的转化率 | 97.5% | 99.2% | 99.6% | 99.7% |
| 550℃时SO2的转化率 | 85.6% | 94.9% | 97.7% | 98.3% |
(1)根据化学理论和以上数据综合分析,为了使二氧化硫尽快地转化为三氧化硫,从化学反应速率的角度考虑,应该选择什么样的条件?
(2)根据化学理论和以上数据综合分析,为了使二氧化硫尽量多地转化为三氧化硫,从化学反应限度的角度考虑,应该选择什么样的条件?
(3)在实际生产中,选定450℃左右作为操作温度,其原因是什么?
(4)根据表中的数据分析,制取SO3时采用的压强是多少?原因是什么?
(5)在生产中,通入过量空气的目的是什么?
(6)根据上述分析,实际工业生产中该反应应选择的条件是什么?
您最近一年使用:0次
2022高二·上海·专题练习
解题方法
3 . 合成氨工业中,原料气(N2、H2及少量CO、NH3的混合气)在进入合成塔前常用醋酸二氨合铜(Ⅰ)溶液来吸收原料气中的CO ,其反应是[Cu(NH3)2]Ac+CO+NH3 [Cu(NH3)2]Ac·CO ΔH<0。
[Cu(NH3)2]Ac·CO ΔH<0。
(1)必须除去原料气中CO的原因为_______ 。
(2)醋酸二氨合铜(Ⅰ)溶液吸收CO的生产适宜条件应是_______ 。
(3)吸收CO后的醋酸二氨合铜溶液经过适当处理又可再生,恢复其吸收CO的能力以供循环使用。醋酸二氨合铜溶液再生的生产适宜条件应是_______ 。
 [Cu(NH3)2]Ac·CO ΔH<0。
[Cu(NH3)2]Ac·CO ΔH<0。(1)必须除去原料气中CO的原因为
(2)醋酸二氨合铜(Ⅰ)溶液吸收CO的生产适宜条件应是
(3)吸收CO后的醋酸二氨合铜溶液经过适当处理又可再生,恢复其吸收CO的能力以供循环使用。醋酸二氨合铜溶液再生的生产适宜条件应是
您最近一年使用:0次
2022-10-29更新
|
172次组卷
|
4卷引用:2.4.1 合成氨生产适宜条件的选择-【帮课堂】2022-2023学年高二化学同步精品讲义(沪科版2020选择性必修第一册)
(已下线)2.4.1 合成氨生产适宜条件的选择-【帮课堂】2022-2023学年高二化学同步精品讲义(沪科版2020选择性必修第一册)第四节 化学反应的调控(已下线)专题06 化学反应的方向及调控【考题猜想】(6大题型)-2023-2024学年高二化学期中考点大串讲(人教版2019选择性必修1)寒假作业(五)化学反应的方向和化学反应的调控经典题练
4 . 在2 L恒容密闭容器中充入1mol CO、2mol H2,在一定条件下发生如下反应:2H2(g)+CO(g) CH3OH(g) ΔH=-90.1kJ·mol-1;CO的平衡转化率与温度、压强之间的关系如图所示。下列推断正确的是
CH3OH(g) ΔH=-90.1kJ·mol-1;CO的平衡转化率与温度、压强之间的关系如图所示。下列推断正确的是
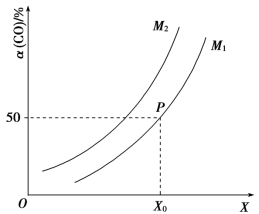
 CH3OH(g) ΔH=-90.1kJ·mol-1;CO的平衡转化率与温度、压强之间的关系如图所示。下列推断正确的是
CH3OH(g) ΔH=-90.1kJ·mol-1;CO的平衡转化率与温度、压强之间的关系如图所示。下列推断正确的是
| A.工业上,利用上述反应合成甲醇,温度越高越好 |
| B.图像中X代表压强,M1与M2代表不同温度,且M2<M1 |
| C.图像中P点代表的平衡常数K的数值为4 |
| D.若维持温度和容器容积不变,再充入1mol CO、2mol H2,达到平衡时CO的转化率不变 |
您最近一年使用:0次
2022-10-26更新
|
135次组卷
|
2卷引用:山东省临沂市平邑县第一中学2022-2023学年高二上学期10月月考化学试题
解题方法
5 . 氮化硼(BN)是一种重要的功能陶瓷材料,有广泛应用。以铁硼矿(主要成分有Mg2B2O5·H2O、Fe3O4,次要成分有Fe2O3、FeO、 CaO、Al2O3、 SiO2) 为原料制备氮化硼的流程如图所示:

已知:相关金属离子[c( Mn+)= 0.1mol ·l-1]形成氢氧化物沉淀的pH范围如下:
回答下列问题:
(1)用稀硫酸酸浸时,若其他条件不变,工业中采取下列措施能提高硼元素浸出率的有_______ (填序号)。
A.适当升高酸浸温度 B.适当加快搅拌速度 C.适当缩短酸浸时间
(2)滤渣1的主要成分为_______ 。
(3)加氨水过程中常常要加热,加热的目的是_______ 。
(4)从硫酸镁溶液中提取MgSO4·7H2O的操作包括_______ 、过滤、 洗涤、干燥。
(5)写出B2O3与氨气在高温下反应制备BN的化学方程式:_______
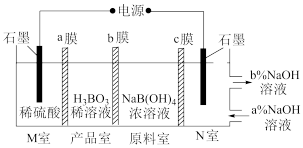
(6)H3BO3 (硼酸)还可以利用电解NaB(OH)4溶液的方法制备,工作原理如图所示,c为_______ (填“阴离子交换膜”或“阳离子交换膜”), 产品室中发生反应的离子方程式为_______ 。

已知:相关金属离子[c( Mn+)= 0.1mol ·l-1]形成氢氧化物沉淀的pH范围如下:
| 金属离子 | Fe3+ | Fe2+ | Al3+ |
| 开始沉淀的pH | 1.5 | 6.3 | 3.2 |
| 沉淀完全的pH | 2.8 | 8.3 | 5.0 |
(1)用稀硫酸酸浸时,若其他条件不变,工业中采取下列措施能提高硼元素浸出率的有
A.适当升高酸浸温度 B.适当加快搅拌速度 C.适当缩短酸浸时间
(2)滤渣1的主要成分为
(3)加氨水过程中常常要加热,加热的目的是
(4)从硫酸镁溶液中提取MgSO4·7H2O的操作包括
(5)写出B2O3与氨气在高温下反应制备BN的化学方程式:
(6)H3BO3 (硼酸)还可以利用电解NaB(OH)4溶液的方法制备,工作原理如图所示,c为

您最近一年使用:0次
2022-10-25更新
|
367次组卷
|
3卷引用:山东省潍坊高密市第三中学2022-2023学年高三上学期9月月考化学试题
解题方法
6 . 钛(Ti)及其合金具有密度小、质量轻、比强度高、耐腐蚀性等优点,被称为“全能金属”。
(1)工业上利用金红石(TiO2)制备金属钛的流程如下:

已知:TiO2转化为TiCl4有直接氯化法和碳氯化法。
i.直接氯化:TiO2(s)+ 2Cl2(g) = TiCl4(g)+O2(g) ∆H= +172 kJ·mol-1
ii.碳氯化:TiO2(s)+ 2Cl2(g)+2C(s)= TiCl4(g)+2CO(g) ∆H=- -51 kJ·mol-1
①已知:C的燃烧热为393.5 kJ·mol-1,则CO的燃烧热为_______ 。
②“碳氯化”的反应趋势远大于直接氯化,原因是_______ 。
③“碳氯化”过程中每生成1mol TiCl4,理论上转移电子数为_______ 。
④“还原”步骤中可使用金属Mg在1073~1173K及氩气保护下制取金属钛。相比于传统的氢气还原法(2500℃下,用H2作还原剂),请从物质转化与资源综合利用角度分析,用金属Mg还原的优点是_______ 。
(2)我国科学家研究出USTB工艺制取金属钛,其原理如图。

USTB法电解原理
①该方法使用具有导电性的TiO·TiC固溶体作阳极,碳钢作阴极,熔盐作电解质,电解时阳极发生的主要电极反应为_______ 。
②由于水对实验有严重影响,而熔盐CaCl2具有很强的吸水性,所以必须对CaCl2进行预处理。将装有CaCl2的坩埚置于电阻炉后,同时以1.5L/min的速度通入氩气,实验所得到的熔盐CaCl2重量随温度和时间的变化曲线如图所示。图中244℃时发生CaCl2脱除结晶水的反应。请结合图像分析,工业上一般在778℃时,将通入氩气的速度降至0.2L/min,其原因可能是_______ 。
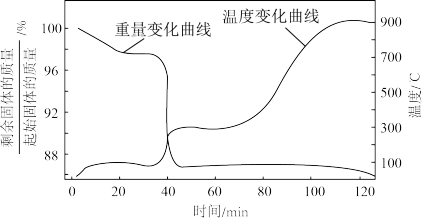
CaCl2综合热分析曲线图
(1)工业上利用金红石(TiO2)制备金属钛的流程如下:

已知:TiO2转化为TiCl4有直接氯化法和碳氯化法。
i.直接氯化:TiO2(s)+ 2Cl2(g) = TiCl4(g)+O2(g) ∆H= +172 kJ·mol-1
ii.碳氯化:TiO2(s)+ 2Cl2(g)+2C(s)= TiCl4(g)+2CO(g) ∆H=- -51 kJ·mol-1
①已知:C的燃烧热为393.5 kJ·mol-1,则CO的燃烧热为
②“碳氯化”的反应趋势远大于直接氯化,原因是
③“碳氯化”过程中每生成1mol TiCl4,理论上转移电子数为
④“还原”步骤中可使用金属Mg在1073~1173K及氩气保护下制取金属钛。相比于传统的氢气还原法(2500℃下,用H2作还原剂),请从物质转化与资源综合利用角度分析,用金属Mg还原的优点是
(2)我国科学家研究出USTB工艺制取金属钛,其原理如图。

USTB法电解原理
①该方法使用具有导电性的TiO·TiC固溶体作阳极,碳钢作阴极,熔盐作电解质,电解时阳极发生的主要电极反应为
②由于水对实验有严重影响,而熔盐CaCl2具有很强的吸水性,所以必须对CaCl2进行预处理。将装有CaCl2的坩埚置于电阻炉后,同时以1.5L/min的速度通入氩气,实验所得到的熔盐CaCl2重量随温度和时间的变化曲线如图所示。图中244℃时发生CaCl2脱除结晶水的反应。请结合图像分析,工业上一般在778℃时,将通入氩气的速度降至0.2L/min,其原因可能是

CaCl2综合热分析曲线图
您最近一年使用:0次
解题方法
7 . 铍是火箭、导弹、航空以及冶金工业中不可缺少的宝贵材料。以绿柱石[Be3Al2(SiO3)6]为原料制备两性金属铍的工艺流程如图所示。

回答下列问题:
(1)绿柱石中Be的化合价为_______ 。
(2)750℃烧结时,Na3FeF6仅与绿柱若中BeO作用生成易溶于水的Na2BeF4,则滤渣的主要成分是Fe2O3和_______ 。
(3)“水浸”时“粉碎”的目的是_______ 。
(4)加适量氢氧化钠溶液使铍元素完全转化为氢氧化铍沉淀,已知25℃时Ksp[Be(OH)2]=4×10-22,计算25℃时,饱和氢氧化铍溶液的pH=_______ (可用对数表示),“沉氟”的化学方程式为_______ 。
(5)镍作阴极、石墨作阳极,350~400℃电解NaCl—BeCl2熔融混合物得到金属铍,阳极反应式为_______ ;不能用该电解槽电解熔融氯化铍制金属铍的原因可能是_______ 。

回答下列问题:
(1)绿柱石中Be的化合价为
(2)750℃烧结时,Na3FeF6仅与绿柱若中BeO作用生成易溶于水的Na2BeF4,则滤渣的主要成分是Fe2O3和
(3)“水浸”时“粉碎”的目的是
(4)加适量氢氧化钠溶液使铍元素完全转化为氢氧化铍沉淀,已知25℃时Ksp[Be(OH)2]=4×10-22,计算25℃时,饱和氢氧化铍溶液的pH=
(5)镍作阴极、石墨作阳极,350~400℃电解NaCl—BeCl2熔融混合物得到金属铍,阳极反应式为
您最近一年使用:0次
名校
8 . 已知合成氨反应N2(g)+3H2(g) 2NH3(g) △H<0,工业上选择的适宜条件为:500℃、铁作催化剂、2×107~5×107Pa。下列说法正确的是
2NH3(g) △H<0,工业上选择的适宜条件为:500℃、铁作催化剂、2×107~5×107Pa。下列说法正确的是
 2NH3(g) △H<0,工业上选择的适宜条件为:500℃、铁作催化剂、2×107~5×107Pa。下列说法正确的是
2NH3(g) △H<0,工业上选择的适宜条件为:500℃、铁作催化剂、2×107~5×107Pa。下列说法正确的是| A.增大压强既加快反应速率,又有利于平衡向合成氨方向移动 |
| B.铁作催化剂既加快反应速率,又有利于平衡向合成氨方向移动 |
| C.升高温度既加快反应速率,又有利于平衡向合成氨方向移动 |
| D.将氨分离出来,既加快反应速率,又有利于平衡向合成氨方向移动 |
您最近一年使用:0次
2022-10-22更新
|
109次组卷
|
2卷引用:北京市顺义牛栏山第一中学2022-2023学年高二上学期10月月考化学试题
名校
9 . 哈伯工业合成氨的流程如图,为提高原料平衡转化率采取的措施是
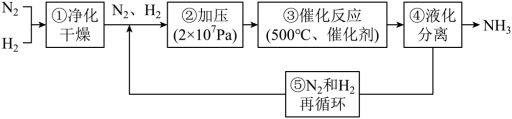

| A.①②③④⑤ | B.②③④⑤ | C.②④⑤ | D.②③④ |
您最近一年使用:0次
2022-10-21更新
|
233次组卷
|
18卷引用:第29练 化学反应的调控-2023年高考化学一轮复习小题多维练(全国通用)
(已下线)第29练 化学反应的调控-2023年高考化学一轮复习小题多维练(全国通用)黑龙江省齐齐哈尔市第八中学2022-2023学年高二上学期10月月考化学试题重庆市南川中学2022-2023学年高二上学期第一学月考试化学试题宁夏回族自治区银川一中2022-2023学年高二上学期期末考试化学试题广东省湛江市第二十一中学2022-2023学年高二上学期期中考试化学试题安徽省宣城市2018-2019学年高二下学期期末考试化学试题山西省长治市第二中学2019-2020学年高二上学期12月月考化学试题人教版(2019)高二选择性必修第一册 第二章 化学反应速率与化学平衡 第四节 化学反应的调控 方法帮山东省淄博市沂源县第二中学2020-2021学年高二下学期期中考试化学试题江西省九江市第一中学2021-2022学年高二上学期第一次月考化学试题山西省长治市第二中学校2021-2022学年高二上学期第一次月考化学试题山西省太原市2019-2020学年高二上学期期中测评化学试题天津市部分区2022-2023 学年高三上学期1月期末考试化学试题第二章 化学反应速率与化学平衡 第四节 化学反应的调控河南省濮阳市第一高级中学2023-2024学年高二上学期9月月考化学试题四川省内江市威远中学校2023-2024学年高二上学期期中考试化学试题四川省内江市威远中学校2023-2024学年高二上学期第二次月考(期中)化学试卷湖北省武汉市重点中学5G联合体2023-2024学年高二上学期期中考试化学试题
名校
解题方法
10 . 化学反应的调控对于工业生产具有积极意义,下列关于调控措施的说法错误的是
| A.硫酸工业中,在高温高压、催化剂作用下,可提高生产效益 |
B.硫酸工业中,为提高 的转化率,可通入稍过量的空气 的转化率,可通入稍过量的空气 |
C.工业合成氨,考虑催化剂的活性,选择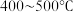 的反应温度 的反应温度 |
| D.工业合成氨,迅速冷却、液化氨气是为了使化学平衡向生成氨气的方向移动 |
您最近一年使用:0次
2022-10-13更新
|
360次组卷
|
2卷引用:辽宁省协作校2022-2023学年高二上学期第一次考试化学试题



