1 . 一定温度下,向2L恒容容器中充入 A和
A和 B,发生反应
B,发生反应 ,经过一段时间后达到平衡。反应过程中测定的部分数据如表,下列说法正确的是
,经过一段时间后达到平衡。反应过程中测定的部分数据如表,下列说法正确的是
 A和
A和 B,发生反应
B,发生反应 ,经过一段时间后达到平衡。反应过程中测定的部分数据如表,下列说法正确的是
,经过一段时间后达到平衡。反应过程中测定的部分数据如表,下列说法正确的是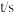 | 0 | 5 | 15 | 25 | 35 |
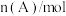 | 1.0 | 0.85 | 0.81 | 0.80 | 0.80 |
A.前5s的平均反应速率 |
| B.由题目信息可知,正反应为放热反应 |
C.保持温度不变,起始时向容器中充入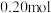 A、 A、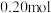 B和 B和 C,反应达平衡前 C,反应达平衡前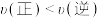 |
D.保持温度不变,起始时向容器中充入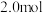 C,达平衡时,C的转化率等于80% C,达平衡时,C的转化率等于80% |
您最近一年使用:0次
2021-07-16更新
|
422次组卷
|
2卷引用:湖南省郴州市2020-2021学年高二下学期期末考试化学试题
解题方法
2 . 一定温度和催化剂存在的条件下发生反应:CO(g)+H2(g)⇌CO(g)+H2O(g),将不同物质的量的CO2(g)和H2(g)分别通入到同体积的恒容密闭容器中,得到如下两组数据:
下列说法不正确的是
| 实验组 | 温度/℃ | 起始量/mol | 平衡量/mol | 达到平衡所需时间/min | ||
| CO2 | H2 | CO | H2O | |||
| 1 | 650 | 3 | 6 | 1.2 | 1.2 | 5 |
| 2 | 900 | 4 | 2 | 1.0 | 1.0 | 3 |
A.650℃时,反应的平衡常数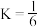 |
| B.该反应为吸热反应 |
C.实验1达到化学平衡,以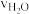 表示的化学反应速率为0.24 mol-1·L-1·min-1 表示的化学反应速率为0.24 mol-1·L-1·min-1 |
| D.保持900℃,向实验组2平衡后的体系中再加入4 mol CO2和2 mol H2后,达到新平衡所需时间小于3 min |
您最近一年使用:0次
解题方法
3 . 异丁烯为重要的化工原料,工业上可采用叔丁醇(TBA)气相脱水法制备高纯异丁烯产品,主要涉及以下反应:
反应1(主反应):
反应2(副反应):
(1)副反应产物 的系统命名为
的系统命名为___________ 。
(2)标准摩尔生成焓是指由稳态单质生成1mol该化合物的焓变,几种物质的标准生成焓如表,求反应1的
___________  。
。
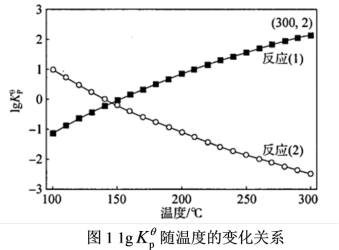
(3)根据,该脱水反应的标准平衡常数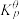 随温度的变化关系如图1所示,则反应2的
随温度的变化关系如图1所示,则反应2的
___________ 0(填“<”或“>”),向体积可变容器中充入1mol的叔丁醇,容器体积为1L,保持300℃100kPa条件,反应一段时间后达到平衡(忽略副反应),则
___________ (已知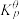 为以标准分压表示的平衡常数,各组分的标准分压
为以标准分压表示的平衡常数,各组分的标准分压 ,
, )。
)。
(4)理论计算反应条件对叔丁醇转化率的影响如图2、3所示,脱水反应温度 ℃时,N2/叔丁醇摩尔比对叔丁醇转化率有影响,试从平衡移动的角度分析充入N2的原因
℃时,N2/叔丁醇摩尔比对叔丁醇转化率有影响,试从平衡移动的角度分析充入N2的原因___________ 。根据图示该脱水反应适宜采用条件为 ℃,P=
℃,P=___________ MPa,N2/叔丁醇摩尔比=3/1。


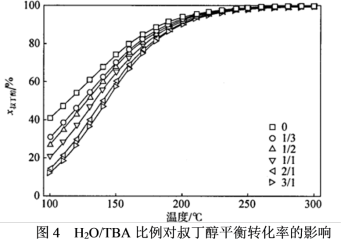
(5)已知工业原料叔丁醇中存在不同含量的水分,相同温度下不同初始原料中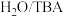 比例对叔丁醇平衡转化率的影响如图4所示,实际生产最佳工艺条件为
比例对叔丁醇平衡转化率的影响如图4所示,实际生产最佳工艺条件为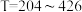 ℃,请从
℃,请从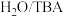 比例角度分析该条件下的优点
比例角度分析该条件下的优点___________ 。
反应1(主反应):

反应2(副反应):

(1)副反应产物
 的系统命名为
的系统命名为(2)标准摩尔生成焓是指由稳态单质生成1mol该化合物的焓变,几种物质的标准生成焓如表,求反应1的

 。
。| 组分 |  | 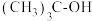 | 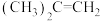 |
焓变/ | -241.83 | -339.21 | -17.1 |
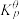 随温度的变化关系如图1所示,则反应2的
随温度的变化关系如图1所示,则反应2的

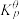 为以标准分压表示的平衡常数,各组分的标准分压
为以标准分压表示的平衡常数,各组分的标准分压 ,
,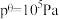 )。
)。
(4)理论计算反应条件对叔丁醇转化率的影响如图2、3所示,脱水反应温度
 ℃时,N2/叔丁醇摩尔比对叔丁醇转化率有影响,试从平衡移动的角度分析充入N2的原因
℃时,N2/叔丁醇摩尔比对叔丁醇转化率有影响,试从平衡移动的角度分析充入N2的原因 ℃,P=
℃,P=

(5)已知工业原料叔丁醇中存在不同含量的水分,相同温度下不同初始原料中
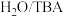 比例对叔丁醇平衡转化率的影响如图4所示,实际生产最佳工艺条件为
比例对叔丁醇平衡转化率的影响如图4所示,实际生产最佳工艺条件为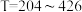 ℃,请从
℃,请从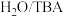 比例角度分析该条件下的优点
比例角度分析该条件下的优点
您最近一年使用:0次
解题方法
4 . Cl2是一种重要的化工原料,在生产和生活中应用十分广泛。
I∶地康法制取氯气的反应为4HCl+O2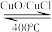 2Cl2+2H2O
2Cl2+2H2O
(1)已知400℃时反应物4molHCl(g)和1molO2 (g)总能量为akJ,生成物2molCl2 (g)和2molH2O (g)总能量为bkJ,其中a大于b。
①写出400℃时,地康法制取氯气的热化学方程式∶___________ 。
②下列有关地康法制取氯气说法正确的是___________ 。
A.使用催化剂或升高温度都可以提高活化分子百分数,从而缩短达到化学平衡的时间
B.催化剂可以降低正逆反应的活化能,从而改变反应的焓变
C.选择温度为400℃,主要考虑此温度下催化剂活性高,反应速率快
D.达到化学平衡时,正反应和逆反应的速率相等且为零
(2)保持恒温恒容条件,将物质的量之和为5mol的HCl和O2以不同的氯氧比[n(HCl])/n(O2)]进行反应,平衡时某反应物的转化率与氯氧比及不同温度的关系如图所示∶

①图中纵坐标表示___________ 的转化率(填“HCl”或“O2”)。
②图中T1、 T2的关系为∶ T1___________ T2(填 “>”、“<” 或“=”)。
③若容器容积为2L,则A点的平衡常数的值为___________ 。
II∶电解法是制备氯气的常用方法,离子交换膜法电解食盐水如上图。
①请写出阳极的电极反应式∶___________ 。
②离子交换膜法所选择的是交换膜___________ (填“阳离子”或“阴离子”)。
I∶地康法制取氯气的反应为4HCl+O2
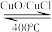 2Cl2+2H2O
2Cl2+2H2O(1)已知400℃时反应物4molHCl(g)和1molO2 (g)总能量为akJ,生成物2molCl2 (g)和2molH2O (g)总能量为bkJ,其中a大于b。
①写出400℃时,地康法制取氯气的热化学方程式∶
②下列有关地康法制取氯气说法正确的是
A.使用催化剂或升高温度都可以提高活化分子百分数,从而缩短达到化学平衡的时间
B.催化剂可以降低正逆反应的活化能,从而改变反应的焓变
C.选择温度为400℃,主要考虑此温度下催化剂活性高,反应速率快
D.达到化学平衡时,正反应和逆反应的速率相等且为零
(2)保持恒温恒容条件,将物质的量之和为5mol的HCl和O2以不同的氯氧比[n(HCl])/n(O2)]进行反应,平衡时某反应物的转化率与氯氧比及不同温度的关系如图所示∶

①图中纵坐标表示
②图中T1、 T2的关系为∶ T1
③若容器容积为2L,则A点的平衡常数的值为
II∶电解法是制备氯气的常用方法,离子交换膜法电解食盐水如上图。
①请写出阳极的电极反应式∶
②离子交换膜法所选择的是交换膜
您最近一年使用:0次
解题方法
5 . 在4月22日的领导人气候峰会上,习主席表示,中国将力争2030年前实现碳达峰、2060年前实现碳中和。其中 、
、 的捕集、利用与封存是我国能源研究领域的一个重要战略方向。请回答:
的捕集、利用与封存是我国能源研究领域的一个重要战略方向。请回答:
(1)室温下, 溶液呈碱性的原因是
溶液呈碱性的原因是___________ (用离子方程式表示)。
(2)已知: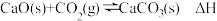
①
___________ 0(填或“<”、“=”或“<”)
②分别将20g、40g的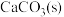 放入相同温度相同体积的真空密闭容器A和B中,一段时间后两者均达到平衡(
放入相同温度相同体积的真空密闭容器A和B中,一段时间后两者均达到平衡( 都未完全分解),则两容器中分解的
都未完全分解),则两容器中分解的 的物质的量关系:
的物质的量关系:
___________ 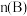 (填“>”、“=”或“<”)。
(填“>”、“=”或“<”)。
(3)利用二氧化碳加氢合成甲醇,既能缓解环境问题,又能解决能源危机。涉及以下主要反应:
反应Ⅰ: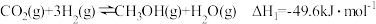
反应Ⅱ: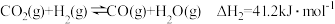
在不同压强下,按照 投料合成甲醇,实验测定
投料合成甲醇,实验测定 的平衡转化率和
的平衡转化率和 的平衡产率随温度的变化关系如下图所示
的平衡产率随温度的变化关系如下图所示
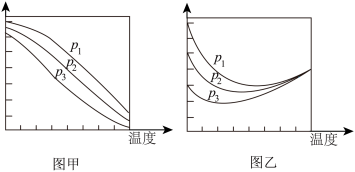
①下列说法正确的是___________
A.
B.图甲纵坐标表示 的平衡产率,图乙纵坐标表示
的平衡产率,图乙纵坐标表示 的平衡产率
的平衡产率
C.一定温度、压强下,寻找活性更高的催化剂,是提高 的平衡转化率的主要研究方向
的平衡转化率的主要研究方向
D.为了同时提高 的平衡转化率和
的平衡转化率和 的平衡产率,应选择低温、高压的反应条件
的平衡产率,应选择低温、高压的反应条件
②图乙中压强一定时,曲线随温度变化先降后升的原因是:___________ ;图乙中三条曲线在某温度时交于一点的原因是:___________
③在一定温度下,控制容器体积1L保持不变,测得 平衡转化率为60%,其中甲醇的选择性为
平衡转化率为60%,其中甲醇的选择性为 ,请计算该温度下反应Ⅰ的平衡常数K=
,请计算该温度下反应Ⅰ的平衡常数K=___________
(4)二氧化碳与氢气以1:3投料比合成甲醇常采用铜基催化剂,测得 随时间变化如图所示。研究发现,采用
随时间变化如图所示。研究发现,采用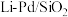 代替铜基催化剂在甲醇合成阶段有更佳的催化效果。在图中画出采用
代替铜基催化剂在甲醇合成阶段有更佳的催化效果。在图中画出采用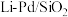 催化剂作用下,
催化剂作用下, 随时间变化的曲线
随时间变化的曲线___________ 。

 、
、 的捕集、利用与封存是我国能源研究领域的一个重要战略方向。请回答:
的捕集、利用与封存是我国能源研究领域的一个重要战略方向。请回答:(1)室温下,
 溶液呈碱性的原因是
溶液呈碱性的原因是(2)已知:
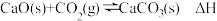
①

②分别将20g、40g的
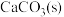 放入相同温度相同体积的真空密闭容器A和B中,一段时间后两者均达到平衡(
放入相同温度相同体积的真空密闭容器A和B中,一段时间后两者均达到平衡( 都未完全分解),则两容器中分解的
都未完全分解),则两容器中分解的 的物质的量关系:
的物质的量关系:
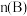 (填“>”、“=”或“<”)。
(填“>”、“=”或“<”)。(3)利用二氧化碳加氢合成甲醇,既能缓解环境问题,又能解决能源危机。涉及以下主要反应:
反应Ⅰ:
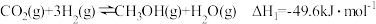
反应Ⅱ:
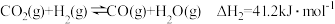
在不同压强下,按照
 投料合成甲醇,实验测定
投料合成甲醇,实验测定 的平衡转化率和
的平衡转化率和 的平衡产率随温度的变化关系如下图所示
的平衡产率随温度的变化关系如下图所示
①下列说法正确的是
A.

B.图甲纵坐标表示
 的平衡产率,图乙纵坐标表示
的平衡产率,图乙纵坐标表示 的平衡产率
的平衡产率C.一定温度、压强下,寻找活性更高的催化剂,是提高
 的平衡转化率的主要研究方向
的平衡转化率的主要研究方向D.为了同时提高
 的平衡转化率和
的平衡转化率和 的平衡产率,应选择低温、高压的反应条件
的平衡产率,应选择低温、高压的反应条件②图乙中压强一定时,曲线随温度变化先降后升的原因是:
③在一定温度下,控制容器体积1L保持不变,测得
 平衡转化率为60%,其中甲醇的选择性为
平衡转化率为60%,其中甲醇的选择性为 ,请计算该温度下反应Ⅰ的平衡常数K=
,请计算该温度下反应Ⅰ的平衡常数K=(4)二氧化碳与氢气以1:3投料比合成甲醇常采用铜基催化剂,测得
 随时间变化如图所示。研究发现,采用
随时间变化如图所示。研究发现,采用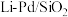 代替铜基催化剂在甲醇合成阶段有更佳的催化效果。在图中画出采用
代替铜基催化剂在甲醇合成阶段有更佳的催化效果。在图中画出采用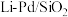 催化剂作用下,
催化剂作用下, 随时间变化的曲线
随时间变化的曲线
您最近一年使用:0次
6 . 金属铝有广泛的应用,有人对碳还原氧化铝制备铝进行了实验研究。在2.0 L真空密闭容器中稍过量石墨与1.0 mol Al2O3混合后加热,图1是体系压强随着加热时间变化的曲线图,图2是在不同的恒定温度下,反应达到平衡,冷却后容器内剩余固体中部分 含铝元素物质的物质的量随温度变化曲线图。

已知:1.01×105 Pa下Al熔点933 K,沸点2700 K;10 Pa下Al沸点低于1000 K,Al2O3和C沸点高于2000 K。
反应I:Al2O3(s)+3C(s) 2Al(s)+3CO(g) △H1=+1339.1 kJ·mol-1
2Al(s)+3CO(g) △H1=+1339.1 kJ·mol-1
反应II:2Al2O3(s)+9C(s) Al4C3(s)+6CO(g) △H2=+2249.5 kJ·mol-1
Al4C3(s)+6CO(g) △H2=+2249.5 kJ·mol-1
反应III:Al2O3(s)+Al4C3(s) 6Al(s)+3CO(g) △H3
6Al(s)+3CO(g) △H3
请回答下列问题:
(1)工业上电解法冶炼铝的化学方程式为___ 。
(2)△H3=___ 。
(3)图1中石墨与Al2O3混合物加热至150 min时容器内温度约为___ 。
(4)从反应自发性推测,实验室进行碳还原氧化铝制备铝的实验需要在真空容器中进行,可能的原因是___ 。
(5)由图2可得1650 K时,反应I的平衡常数K=___ 。
(6)下列说法不正确 的是___ 。
A.图1中约170 min后体系压强很快减小可能是反应I、II急剧发生,吸收了大量的热,容器内温度降低,导致反应I、II平衡向逆方向移动
B.图2显示约1650~1700 K之间是石墨与Al2O3反应制备Al的最佳温度
C.图2中T≥1700K时体系中一定还发生了其他副反应
D.综合分析可得,碳还原氧化铝制备铝比电解法成本更低,产率更高,适合大规模应用
(7)请在图3中画出温度在1450-1650 K之间2.0 L真空密闭容器中CO的浓度随温度变化曲线图___ 。


已知:1.01×105 Pa下Al熔点933 K,沸点2700 K;10 Pa下Al沸点低于1000 K,Al2O3和C沸点高于2000 K。
反应I:Al2O3(s)+3C(s)
 2Al(s)+3CO(g) △H1=+1339.1 kJ·mol-1
2Al(s)+3CO(g) △H1=+1339.1 kJ·mol-1反应II:2Al2O3(s)+9C(s)
 Al4C3(s)+6CO(g) △H2=+2249.5 kJ·mol-1
Al4C3(s)+6CO(g) △H2=+2249.5 kJ·mol-1反应III:Al2O3(s)+Al4C3(s)
 6Al(s)+3CO(g) △H3
6Al(s)+3CO(g) △H3请回答下列问题:
(1)工业上电解法冶炼铝的化学方程式为
(2)△H3=
(3)图1中石墨与Al2O3混合物加热至150 min时容器内温度约为
(4)从反应自发性推测,实验室进行碳还原氧化铝制备铝的实验需要在真空容器中进行,可能的原因是
(5)由图2可得1650 K时,反应I的平衡常数K=
(6)下列说法
A.图1中约170 min后体系压强很快减小可能是反应I、II急剧发生,吸收了大量的热,容器内温度降低,导致反应I、II平衡向逆方向移动
B.图2显示约1650~1700 K之间是石墨与Al2O3反应制备Al的最佳温度
C.图2中T≥1700K时体系中一定还发生了其他副反应
D.综合分析可得,碳还原氧化铝制备铝比电解法成本更低,产率更高,适合大规模应用
(7)请在图3中画出温度在1450-1650 K之间2.0 L真空密闭容器中CO的浓度随温度变化曲线图

您最近一年使用:0次
19-20高二下·江苏镇江·期中
名校
解题方法
7 . CO2的资源化利用能有效减少CO2排放,充分利用碳资源,化学反应中产生的气体多可使产生的固体更加多孔疏松。
(1) CaO可在较高温度下捕集CO2,在更高温度下将捕集的CO2释放利用,CaC2O4·H2O热分解可制备CaO,CaC2O4·H2O加热升温过程中固体的质量变化如图1。

图1
①写出400~600℃范围内分解反应的化学方程式___________ 。
②与CaCO3热分解制备的CaO相比,CaC2O4·H2O热分解制备的CaO具有更好的CO2捕集性能,其原因是___________ 。
(2)电解法转化CO2可实现CO2资源化利用。电解CO2制HCOOH的原理示意图如图2。

图2
①写出阴极CO2还原为HCOO-的的电极反应式___________ 。
②电解一段时间后,阳极区的KHCO3溶液浓度降低,其原因是___________ 。
(3) CO2催化加氢合成二甲醚是一种CO2转化方法,其过程中主要发生下列反应:
反应I:CO2(g)+ H2(g)=CO(g)+H2O(g) △H=41.2 kJ/mol
反应II:2CO2(g)+6H2(g)=CH3OCH3(g)+3H2O(g) △H=-122.5 kJ/mol
在恒压、CO2和H2的起始量一定的条件下,CO2平衡转化率和平衡时CH3OCH3的选择性随温度的变化如图3。

其中:CH3OCH3的选择性=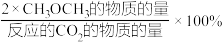
①温度高于300℃,CO2平衡转化率随温度升高而上升的原因是___________ 。
②220℃时,在催化剂作用下CO2与H2反应一段时间后,测得CH3OCH3的选择性为48%(图中A点)。不改变反应时间和温度,一定能提高CH3OCH3选择性的措施有___________ ,___________ 。(写两点)
(1) CaO可在较高温度下捕集CO2,在更高温度下将捕集的CO2释放利用,CaC2O4·H2O热分解可制备CaO,CaC2O4·H2O加热升温过程中固体的质量变化如图1。

图1
①写出400~600℃范围内分解反应的化学方程式
②与CaCO3热分解制备的CaO相比,CaC2O4·H2O热分解制备的CaO具有更好的CO2捕集性能,其原因是
(2)电解法转化CO2可实现CO2资源化利用。电解CO2制HCOOH的原理示意图如图2。

图2
①写出阴极CO2还原为HCOO-的的电极反应式
②电解一段时间后,阳极区的KHCO3溶液浓度降低,其原因是
(3) CO2催化加氢合成二甲醚是一种CO2转化方法,其过程中主要发生下列反应:
反应I:CO2(g)+ H2(g)=CO(g)+H2O(g) △H=41.2 kJ/mol
反应II:2CO2(g)+6H2(g)=CH3OCH3(g)+3H2O(g) △H=-122.5 kJ/mol
在恒压、CO2和H2的起始量一定的条件下,CO2平衡转化率和平衡时CH3OCH3的选择性随温度的变化如图3。

其中:CH3OCH3的选择性=
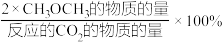
①温度高于300℃,CO2平衡转化率随温度升高而上升的原因是
②220℃时,在催化剂作用下CO2与H2反应一段时间后,测得CH3OCH3的选择性为48%(图中A点)。不改变反应时间和温度,一定能提高CH3OCH3选择性的措施有
您最近一年使用:0次
解题方法
8 . 碘水中存在可逆反应:I2(aq)+I-(aq) I
I (aq),为测定该反应的平衡常数K进行如下实验。
(aq),为测定该反应的平衡常数K进行如下实验。
实验i 测定平衡体系中I2和I 总浓度
总浓度

实验ii 测定饱和碘水中I2浓度

已知: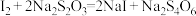 。
。
(1)碘量瓶是带磨口塞和水封槽的锥形瓶,盖上塞子后可以水封瓶口,常用于碘量分析本实验采用碘量瓶的目的是___________ 。
(2)滴定过程应使用___________ 滴定管。
(3)滴定过程,当溶液变为浅黄色时再加入淀粉溶液,滴定终点现象为___________ 。
(4)实验i和实验ii中I2浓度近似相等,则实验i剩余碘固体的质量___________ 实验ii(填“大于”、“小于”或“等于”)。
(5)实验测得平衡体系中c(I )=
)=___________ mol·L-1,平衡常数K=___________ (列表达式即可)
(6)下列关于实验分析的说法正确的是___________ (填标号)。
A.实验i的碘量瓶在使用前未烘干会影响实验结果
B.实验i应精准控制加入 溶液的体积
溶液的体积
C.实验ii吸取上层清液时,不慎吸入碘固体,则测得的K偏大
D.实验ii滴定终点时俯视读数,则测得的K偏大
(7)另外设计实验方案测定平衡常数K:取10.00 碘量瓶②中上层清液,加入10
碘量瓶②中上层清液,加入10
 萃取
萃取 并分液。用0.0050
并分液。用0.0050
 溶液分别滴定水层和有机层、消耗
溶液分别滴定水层和有机层、消耗 溶液的体积为
溶液的体积为
 和
和
 。试分析该方案是否可行,并说明理由
。试分析该方案是否可行,并说明理由___________ 。
 I
I (aq),为测定该反应的平衡常数K进行如下实验。
(aq),为测定该反应的平衡常数K进行如下实验。实验i 测定平衡体系中I2和I
 总浓度
总浓度
实验ii 测定饱和碘水中I2浓度

已知:
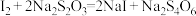 。
。(1)碘量瓶是带磨口塞和水封槽的锥形瓶,盖上塞子后可以水封瓶口,常用于碘量分析本实验采用碘量瓶的目的是
(2)滴定过程应使用
(3)滴定过程,当溶液变为浅黄色时再加入淀粉溶液,滴定终点现象为
(4)实验i和实验ii中I2浓度近似相等,则实验i剩余碘固体的质量
(5)实验测得平衡体系中c(I
 )=
)=(6)下列关于实验分析的说法正确的是
A.实验i的碘量瓶在使用前未烘干会影响实验结果
B.实验i应精准控制加入
 溶液的体积
溶液的体积C.实验ii吸取上层清液时,不慎吸入碘固体,则测得的K偏大
D.实验ii滴定终点时俯视读数,则测得的K偏大
(7)另外设计实验方案测定平衡常数K:取10.00
 碘量瓶②中上层清液,加入10
碘量瓶②中上层清液,加入10
 萃取
萃取 并分液。用0.0050
并分液。用0.0050
 溶液分别滴定水层和有机层、消耗
溶液分别滴定水层和有机层、消耗 溶液的体积为
溶液的体积为
 和
和
 。试分析该方案是否可行,并说明理由
。试分析该方案是否可行,并说明理由
您最近一年使用:0次
9 . 硫化氢(H2S)是一种有害气体,可用多种方法进行脱除。
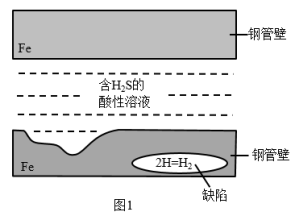
(1)含H2S的酸性溶液对钢管壁的危害如图1所示,钢管壁内部的缺陷处会积聚H2,产生的压力对管壁造成危害。缺陷处产生H2的微观过程可描述为_____
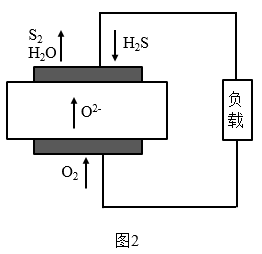
(2)一种转化H2S的燃料电池工作原理如图2所示。该电池工作时,负极的电极反应式为_______ 。
(3)一种脱除H2S回收硫磺工艺的两个阶段主要反应分别如下:
第一阶段: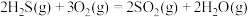
第二阶段:
该工艺需控制第一阶段与第二阶段参加反应的H2S的物质的量之比n1(H2S):n2(H2S)约为1:2。若n1(H2S):n2(H2S)过大,会导致_______ 。
(4)Fe2(SO4)3溶液脱除空气中H2S并再生的原理如图3所示。

①Fe2(SO4)3溶液脱除空气中H2S的总反应化学方程式为_______ 。
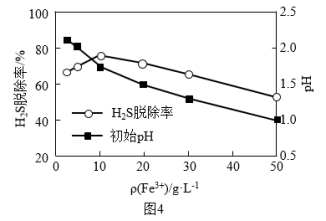
②将一定体积含H2S的空气匀速通入Fe2(SO4)3溶液中,反应相同时间,初始Fe3+浓度ρ(Fe3+)及其pH与H2S脱除率的关系如图4所示。当ρ(Fe3+)>10g·L-1,H2S脱除率下降的原因是_______ 。
(1)含H2S的酸性溶液对钢管壁的危害如图1所示,钢管壁内部的缺陷处会积聚H2,产生的压力对管壁造成危害。缺陷处产生H2的微观过程可描述为

(2)一种转化H2S的燃料电池工作原理如图2所示。该电池工作时,负极的电极反应式为

(3)一种脱除H2S回收硫磺工艺的两个阶段主要反应分别如下:
第一阶段:
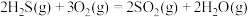
第二阶段:

该工艺需控制第一阶段与第二阶段参加反应的H2S的物质的量之比n1(H2S):n2(H2S)约为1:2。若n1(H2S):n2(H2S)过大,会导致
(4)Fe2(SO4)3溶液脱除空气中H2S并再生的原理如图3所示。

①Fe2(SO4)3溶液脱除空气中H2S的总反应化学方程式为
②将一定体积含H2S的空气匀速通入Fe2(SO4)3溶液中,反应相同时间,初始Fe3+浓度ρ(Fe3+)及其pH与H2S脱除率的关系如图4所示。当ρ(Fe3+)>10g·L-1,H2S脱除率下降的原因是

您最近一年使用:0次
名校
解题方法
10 . 锌冶炼过程中产生的锌渣主要成分为铁酸锌(ZnFe2O4)和二氧化硅,以及少量的铜、铁、锌的氧化物和硫化物。利用酸溶的方法可溶出金属离子,使锌渣得到充分利用。
(1)铁酸锌酸溶。铁酸锌难溶于水,其晶胞由A、B结构按照1∶1交替累积而成,如图所示。将铁酸锌粉末投入到1L1mol·L-1H2SO4中,保温80℃,匀速搅拌。浸出液中Fe3+和Zn2+的浓度随时间的变化如表所示。
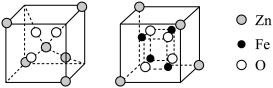
①B结构的化学式为___ 。
②铁酸锌和硫酸反应的离子方程式为___ 。
③酸溶时,溶出效率较高的金属离子是___ 。
(2)锌渣酸溶。将锌渣分别在SO2—1mol·L-1H2SO4、1mol·L-1H2SO4以及SO2—H2O三种体系中实验,均保持80℃,匀速搅拌,所得结果如图所示。已知:25℃时,Ksp(FeS)=6.3×10-17;Ksp(ZnS)=2.9×10-25;Ksp(CuS)=6.3×10-36;Ksp(Cu2S)=2.5×10-48;FeS和ZnS可溶于稀硫酸,CuS和Cu2S不溶于稀硫酸。
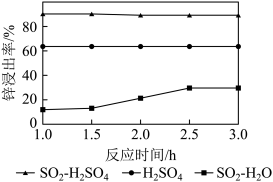
①在SO2—H2SO4体系中,Zn2+浸出率较高的原因是___ 。
②在SO2—H2SO4体系中,溶渣中Cu2S的质量增加,原因是___ 。
(1)铁酸锌酸溶。铁酸锌难溶于水,其晶胞由A、B结构按照1∶1交替累积而成,如图所示。将铁酸锌粉末投入到1L1mol·L-1H2SO4中,保温80℃,匀速搅拌。浸出液中Fe3+和Zn2+的浓度随时间的变化如表所示。

| 时间/h | 0.5 | 1.0 | 1.5 | 2.0 | 2.5 |
| c(Zn2+)/mol•L-1 | 0.10 | 0.11 | 0.15 | 0.21 | 0.21 |
| c(Fe3+)/mol•L-1 | 0.12 | 0.13 | 0.16 | 0.21 | 0.30 |
②铁酸锌和硫酸反应的离子方程式为
③酸溶时,溶出效率较高的金属离子是
(2)锌渣酸溶。将锌渣分别在SO2—1mol·L-1H2SO4、1mol·L-1H2SO4以及SO2—H2O三种体系中实验,均保持80℃,匀速搅拌,所得结果如图所示。已知:25℃时,Ksp(FeS)=6.3×10-17;Ksp(ZnS)=2.9×10-25;Ksp(CuS)=6.3×10-36;Ksp(Cu2S)=2.5×10-48;FeS和ZnS可溶于稀硫酸,CuS和Cu2S不溶于稀硫酸。

①在SO2—H2SO4体系中,Zn2+浸出率较高的原因是
②在SO2—H2SO4体系中,溶渣中Cu2S的质量增加,原因是
您最近一年使用:0次
2021-04-21更新
|
628次组卷
|
4卷引用:江苏省苏锡常镇四市2021届高三教学情况调研(一)化学试题
江苏省苏锡常镇四市2021届高三教学情况调研(一)化学试题(已下线)押江苏卷第15题 化学工业流程综合题 -备战2022年高考化学临考题号押题(江苏卷)江苏省南京市金陵中学2021-2022学年高三下学期3月学情调研化学试题江苏省泰州中学2023-2024学年高三上学期期初调研考试化学试题



