1 . 碳和碳的化合物在生产、生活中有重要作用,乙烯、甲醇、甲酸等都是重要的能源物质。
(1)已知几种反应的正反应活化能(E1)、逆反应活化能(E2)如表所示:
在相同条件下,起始反应最快的是_____ (填序号)。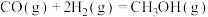 的
的
_____ 。
(2)甲醇水蒸气重整,总反应为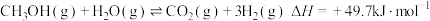 。
。
①若工业生产中在恒压容器中进行该反应,下列措施可提高CH3OH的平衡转化率的是_____ (填字母)。
a.原料气中掺入一定量惰性气体
b.升高温度
c.使用催化效率更高的催化剂
d.使用分子筛及时移走产生的氢气
②该过程中同时发生两个反应:
I.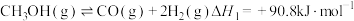
Ⅱ.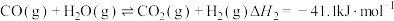
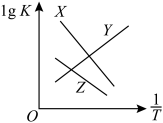
总反应、反应Ⅰ、反应Ⅱ的平衡常数对数lgK与 变化关系如图所示。图中X和Y、Z三条曲线中,表示反应Ⅰ的是
变化关系如图所示。图中X和Y、Z三条曲线中,表示反应Ⅰ的是_____ ,理由是_____ 。
③在恒容密闭容器中,充入一定量CH3OH(g)和H2O(g),同时发生反应Ⅰ、反应Ⅱ,实验测得不同温度下,平衡体系中H2的体积分数如图所示:
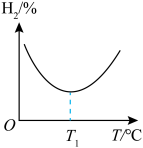
T1°C之后平衡体系中H2体积分数增大的原因是_____ 。
(3)CO2催化还原可以制备 和HCOOH:
和HCOOH:
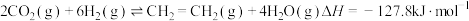 ;
;
 。
。
在一定温度下,在容积为1L的恒容密闭容器中充入1molCO2(g)和3molH2(g),同时发生了乙烯化和甲酸化反应,达到平衡时C2H4的选择性为40%,体系压强减小了22.5%。则CO2总转化率为_____ ,该温度下,甲酸化的平衡常数K=_____ (结果保留2位小数)。提示: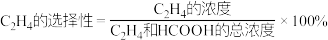
(1)已知几种反应的正反应活化能(E1)、逆反应活化能(E2)如表所示:
| 序号 | 化学反应 | E1/(kJ·mol-¹) | E2/(kJ·mol-¹) |
| ① | 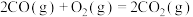 | 1954 | 2519 |
| ② | 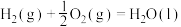 | 685 | 970 |
| ③ | 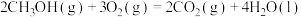 | 3526 | 4978 |
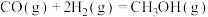 的
的
(2)甲醇水蒸气重整,总反应为
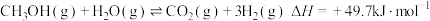 。
。①若工业生产中在恒压容器中进行该反应,下列措施可提高CH3OH的平衡转化率的是
a.原料气中掺入一定量惰性气体
b.升高温度
c.使用催化效率更高的催化剂
d.使用分子筛及时移走产生的氢气
②该过程中同时发生两个反应:
I.
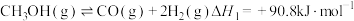
Ⅱ.
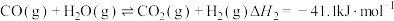
总反应、反应Ⅰ、反应Ⅱ的平衡常数对数lgK与
 变化关系如图所示。图中X和Y、Z三条曲线中,表示反应Ⅰ的是
变化关系如图所示。图中X和Y、Z三条曲线中,表示反应Ⅰ的是
③在恒容密闭容器中,充入一定量CH3OH(g)和H2O(g),同时发生反应Ⅰ、反应Ⅱ,实验测得不同温度下,平衡体系中H2的体积分数如图所示:

T1°C之后平衡体系中H2体积分数增大的原因是
(3)CO2催化还原可以制备
 和HCOOH:
和HCOOH: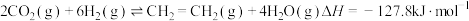 ;
; 。
。在一定温度下,在容积为1L的恒容密闭容器中充入1molCO2(g)和3molH2(g),同时发生了乙烯化和甲酸化反应,达到平衡时C2H4的选择性为40%,体系压强减小了22.5%。则CO2总转化率为
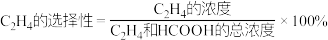
您最近一年使用:0次
2 . 重铬酸钾( )是实验室常用的强氧化剂,其溶液一般为橙色,由于被还原后生成
)是实验室常用的强氧化剂,其溶液一般为橙色,由于被还原后生成 而使得溶液变为绿色。已知溶液中存在平衡:
而使得溶液变为绿色。已知溶液中存在平衡: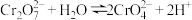 ,某化学兴趣小组的同学考虑到金属单质容易失电子,因此设计实验,研究重铬酸钾溶液与铁的反应情况,实验结果如表。
,某化学兴趣小组的同学考虑到金属单质容易失电子,因此设计实验,研究重铬酸钾溶液与铁的反应情况,实验结果如表。
下列说法错误的是
 )是实验室常用的强氧化剂,其溶液一般为橙色,由于被还原后生成
)是实验室常用的强氧化剂,其溶液一般为橙色,由于被还原后生成 而使得溶液变为绿色。已知溶液中存在平衡:
而使得溶液变为绿色。已知溶液中存在平衡: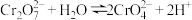 ,某化学兴趣小组的同学考虑到金属单质容易失电子,因此设计实验,研究重铬酸钾溶液与铁的反应情况,实验结果如表。
,某化学兴趣小组的同学考虑到金属单质容易失电子,因此设计实验,研究重铬酸钾溶液与铁的反应情况,实验结果如表。| 实验 | 现象 |
 | 一段时间后,培养皿中由铁珠向外依次呈现: Ⅰ区溶液澄清且绿色明显 Ⅱ区开始时溶液变黄,但随后出现紫色胶状沉淀 Ⅲ区溶液澄清且几乎无色 |
A.Ⅰ区溶液中的主要阳离子是 、 、 ,这是溶液绿色明显的主要原因 ,这是溶液绿色明显的主要原因 |
B.Ⅱ区出现紫色胶状沉淀是因为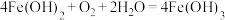 |
| C.Ⅲ区溶液几乎无色,主要是因为离子的扩散 |
D.Ⅱ区可能发生了 |
您最近一年使用:0次
2023-04-11更新
|
707次组卷
|
5卷引用:甘肃省武威第一中学2023-2024学年高三上学期第三次月考化学试题
甘肃省武威第一中学2023-2024学年高三上学期第三次月考化学试题(已下线)化学押题卷(三)(已下线)化学-2023年高考押题预测卷03(山东卷)(含考试版、全解全析、参考答案、答题卡)福建省龙岩市长汀县2023届高三下学期5月质量检测化学试题(已下线)专题05 化学实验基础-2023年高考化学真题题源解密(全国通用)
3 . 下列事实不能用勒夏特列原理解释的是
| A.采用排饱和食盐水的方法收集氯气 |
B.红棕色的 ,加压后颜色先变深后变浅 ,加压后颜色先变深后变浅 |
| C.高压更有利于合成氨 |
D.盛有 溶液与稀硫酸混合液的试管浸入热水时迅速变浑浊 溶液与稀硫酸混合液的试管浸入热水时迅速变浑浊 |
您最近一年使用:0次
2023-05-01更新
|
270次组卷
|
7卷引用:甘肃省张掖市高台县第一中学2023-2024学年高二上学期10月月考化学试题
名校
解题方法
4 . 下列事实不能用勒夏特列原理解释的是
A.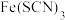 溶液中加入固体KSCN后颜色变深 溶液中加入固体KSCN后颜色变深 |
| B.使用新型催化剂可使氮气与氢气在常温常压下合成氨气 |
| C.用排饱和食盐水的方法收集氯气 |
| D.石灰石与稀盐酸在密闭瓶中反应结束后,打开瓶塞,溶液中有气泡产生 |
您最近一年使用:0次
2022-10-27更新
|
167次组卷
|
2卷引用:甘肃省平凉市第一中学2022-2023学年高二上学期第一次月考化学试题
名校
5 . 甲、乙、丙三瓶等体积的新制氯水,浓度均为0.1 mol∙L−1,如果在甲瓶中加入少量的CaCO3晶体(mmol),在乙瓶中加入少量CaSO3晶体(mmol),丙瓶不变,片刻后,甲、乙、丙三瓶溶液中HClO的物质的量的浓度大小关系是(溶液体积变化忽略不计)
| A.甲=乙>丙 | B.甲>丙>乙 | C.丙>甲>乙 | D.乙>丙>甲 |
您最近一年使用:0次
2021-11-07更新
|
264次组卷
|
2卷引用:甘肃省武威第六中学2022-2023学年高三上学期第三次过关考试化学试题
6 . 下列事实中,不能用勒夏特列原理解释的是
①Fe(SCN)3溶液中加入固体KSCN后颜色变深
②向稀盐酸中加入少量蒸馏水,盐酸中氢离子浓度降低
③实验室常用排饱和食盐水的方法收集氯气
④棕红色NO2加压后颜色先变深后变浅
⑤加入催化剂有利于合成氨的反应
⑥向MgCO3沉淀中滴加NaOH溶液可以得到Mg(OH)2沉淀
①Fe(SCN)3溶液中加入固体KSCN后颜色变深
②向稀盐酸中加入少量蒸馏水,盐酸中氢离子浓度降低
③实验室常用排饱和食盐水的方法收集氯气
④棕红色NO2加压后颜色先变深后变浅
⑤加入催化剂有利于合成氨的反应
⑥向MgCO3沉淀中滴加NaOH溶液可以得到Mg(OH)2沉淀
| A.②⑤ | B.①③⑤ | C.①②⑥ | D.②③④ |
您最近一年使用:0次
名校
7 . 温度为T时,向2.0L恒容密闭容器中充入1.0 molPCl5,反应PCl5(g) PCl3(g)+Cl2(g),经一段时间后达到平衡。反应过程中测定的部分数据见下表:
PCl3(g)+Cl2(g),经一段时间后达到平衡。反应过程中测定的部分数据见下表:
下列说法正确的是
 PCl3(g)+Cl2(g),经一段时间后达到平衡。反应过程中测定的部分数据见下表:
PCl3(g)+Cl2(g),经一段时间后达到平衡。反应过程中测定的部分数据见下表:| t/s | 0 | 50 | 150 | 250 | 350 |
| n(PCl3)/ mol | 0 | 0.16 | 0.19 | 0.20 | 0.20 |
| A.反应在前50 s的平均速率为v(PCl3)=0.0032 mol·L-1·s-1 |
| B.保持其他条件不变,若升高温度,平衡时,c(PCl3)=0.11 mol·L-1,则反应的△H<0 |
| C.相同温度下,起始时向容器中充入1.0molPCl5、0.20molPCl3和0.20molCl2,达到平衡前v(正)>v(逆) |
| D.相同温度下,起始时向容器中充入2.0molPCl3、2.0molCl2,达到平衡时,PCl3的物质的量大于0.4 mol |
您最近一年使用:0次
2021-11-01更新
|
385次组卷
|
4卷引用:甘肃省静宁县第一中学2021-2022学年高二上学期第一次月考(实验班)化学试题
甘肃省静宁县第一中学2021-2022学年高二上学期第一次月考(实验班)化学试题(已下线)2021年6月浙江高考化学试题变式题11-20山东省威海乳山市第一中学2022-2023学年高二下学期开学考试化学试题(已下线)浙江省温州市普通高中2023届高三下学期第二次适应性考试化学试题变式题(选择题11-16)
名校
8 . 在某一绝热恒容容器里,充入一定量NH3和CO2,只发生反应:2NH3(g)+CO2(g)  H2NCOONH4(s) ΔH=-159.47 kJ·mol-1,达到平衡状态后改变某一条件后发生下列变化能说明平衡一定向正反应方向移动的是
H2NCOONH4(s) ΔH=-159.47 kJ·mol-1,达到平衡状态后改变某一条件后发生下列变化能说明平衡一定向正反应方向移动的是
 H2NCOONH4(s) ΔH=-159.47 kJ·mol-1,达到平衡状态后改变某一条件后发生下列变化能说明平衡一定向正反应方向移动的是
H2NCOONH4(s) ΔH=-159.47 kJ·mol-1,达到平衡状态后改变某一条件后发生下列变化能说明平衡一定向正反应方向移动的是| A.正反应速率先增大后减小 | B.逆反应速率先不变后减小 |
| C.容器内温度降低 | D.某反应物的体积百分含量增大 |
您最近一年使用:0次
2021-10-21更新
|
163次组卷
|
2卷引用:甘肃省兰州市第二十七中学2022届高三上学期第一次月考化学试题
名校
解题方法
9 . 下列变化不能 用勒夏特列平衡移动原理释解的是
| A.工业生产硫酸的过程中使用适当过量的氧气,以提高二氧化硫的转化率 |
| B.红棕色的NO2加压后颜色先变深再变浅 |
| C.光照新制的氯水,溶液的酸性增强 |
| D.工业合成氨的反应,往往需要使用催化剂 |
您最近一年使用:0次
2021-01-28更新
|
574次组卷
|
3卷引用:甘肃省天水市第一中学2021-2022学年高二上学期第一学段考试化学(理)试题
甘肃省天水市第一中学2021-2022学年高二上学期第一学段考试化学(理)试题湖北省部分高中2020-2021学年高二上学期期中考试化学试题(已下线)2.3.2 影响化学平衡状态的因素-2021-2022学年高二化学课后培优练(人教版选修4)
10 . 在一定条件下,向2 L恒容密闭容器中加入2 mol X、1 mol Y。发生如下反应:2X(g)+Y 3Z(g);ΔH=-a kJ·mol-1(a>0)。经60 s达平衡,此时Y的物质的量为0.2 mol。下列说法错误的是( )
3Z(g);ΔH=-a kJ·mol-1(a>0)。经60 s达平衡,此时Y的物质的量为0.2 mol。下列说法错误的是( )
 3Z(g);ΔH=-a kJ·mol-1(a>0)。经60 s达平衡,此时Y的物质的量为0.2 mol。下列说法错误的是( )
3Z(g);ΔH=-a kJ·mol-1(a>0)。经60 s达平衡,此时Y的物质的量为0.2 mol。下列说法错误的是( )| A.用Z表示的化学反应速率为1.2 mol·L-1·min-1 |
| B.若再充入1 mol Z,重新达到平衡时,X的体积分数不变,则Y为气态 |
| C.达平衡后,实际放出的热量为b kJ,则b=a |
| D.若Y为气态,则使容器体积变为1 L,Z的物质的量不会增大 |
您最近一年使用:0次
2020-10-31更新
|
113次组卷
|
2卷引用:甘肃省庄浪县第一中学2020-2021学年高二上学期第二学段考试化学试题



