名校
解题方法
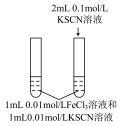
1 . 为探究浓度对化学平衡的影响,某同学进行如下实验:
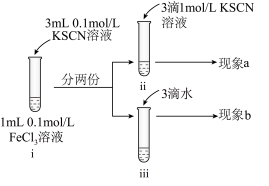
已知:i.中发生的化学反应为:
下列说法不正确 的是:

已知:i.中发生的化学反应为:

下列说法
| A.若i中加入KSCN溶液的体积改为2mL,不具有说服力,无法达到实验目的 |
| B.观察到现象a比现象b中红色更深,即可证明增加反应物浓度,平衡正向移动 |
| C.进行ii、iii对比实验的主要目的是防止由于溶液体积变化引起各离子浓度变化而干扰实验结论得出 |
| D.若将ii中加入试剂更换为3滴1mol/LKCl溶液,记为现象c,则平衡逆向移动,现象c比现象b红色更浅 |
您最近一年使用:0次
名校
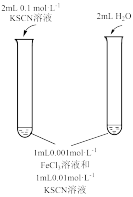
2 . 为探究浓度对化学平衡的影响,某同学进行如下实验:下列说法不正确 的是
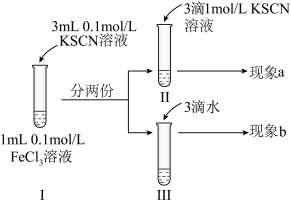

| A.该实验通过观察颜色变化以判断生成物浓度的变化 |
| B.观察到现象a比现象b中红色更深,即可证明增加反应物浓度,平衡正向移动 |
| C.进行II、III对比实验的主要目的是防止由于溶液体积变化引起各离子浓度变化而干扰实验结论得出 |
| D.若I中加入KSCN溶液的体积改为2mL也可以达到实验目的 |
您最近一年使用:0次
2020-07-09更新
|
270次组卷
|
7卷引用:北京市延庆区2019-2020学年高二下学期期末考试化学试题
北京市延庆区2019-2020学年高二下学期期末考试化学试题(已下线)第19讲 化学平衡 (练) — 2022年高考化学一轮复习讲练测(新教材新高考)湖南省长沙市长郡中学2021-2022学年高二上学期第一次月考化学试题(已下线)考向22 化学平衡状态 化学平衡的移动-备战2022年高考化学一轮复习考点微专题(已下线)第19讲 化学平衡(练)-2023年高考化学一轮复习讲练测(新教材新高考)河南省商丘名校联盟2022-2023学年高二上学期期中考试化学试题河南省兰考县第一高级中学2022-2023学年高二上学期期中考试化学试题
名校
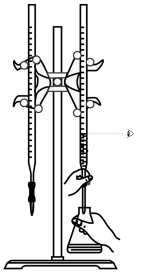
3 . 用下列仪器或装置(图中夹持装置略)进行相应实验,不能 达到实验目的的是
| A.测定锌与稀硫酸反应速率(计时器未画出) | B.证明温度对平衡的影响 | C.研究浓度对化学平衡的影响 | D.研究酸碱性对平衡移动的影响 |
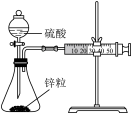 |  |  |  |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
名校
解题方法
4 . 用下列仪器或装置(部分夹持装置略)进行相应实验,能够达到实验目的的是
 |  | 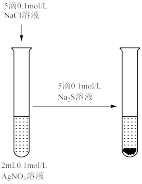 |  |
| A.用标准NaOH溶液滴定锥形瓶中的盐酸 | B.研究浓度对化学平衡的影响 | C.验证沉淀转化:AgCl转化为 | D.检验 溶液是否变质 溶液是否变质 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2023-01-04更新
|
205次组卷
|
2卷引用:北京市清华大学附属中学2022-2023学年高二上学期期末化学试题
名校
5 . 某小组探究含Cr元素的化合物间的转化,进行如下实验。
资料:
i.含Cr元素的常见粒子: (橙色)、
(橙色)、 (黄色)、CrO5(溶于水,蓝紫色,不稳定)、Cr3+(绿色)、Cr(OH)3(蓝灰色,难溶于水,可溶于强酸、强碱)、
(黄色)、CrO5(溶于水,蓝紫色,不稳定)、Cr3+(绿色)、Cr(OH)3(蓝灰色,难溶于水,可溶于强酸、强碱)、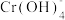 (亮绿色)。
(亮绿色)。
ii.H2O2在碱性环境中比在酸性环境中分解速率快。
iii.在碱性环境中,O2不能氧化+3价铬元素。
实验操作及现象如表:
(1)已知 (橙色)+H2O
(橙色)+H2O 2
2 (黄色)+2H+。请用化学平衡移动原理解释I中滴入稀硫酸后溶液橙色加深的原因:
(黄色)+2H+。请用化学平衡移动原理解释I中滴入稀硫酸后溶液橙色加深的原因:_____ 。
(2)I中,溶液由橙色变为绿色的总反应的离子方程式是_____ 。
(3)Ⅱ中,继续滴入NaOH溶液后,又有气泡生成的原因是_____ 。
(4)Ⅱ中,继续滴入NaOH溶液后,预测有Cr(OH)3沉淀生成,但实验时未观察到。
提出假设:在碱性环境中,+3价铬元素被H2O2氧化。
①甲同学设计实验证明假设成立:
取少量I中的绿色溶液,在滴入NaOH溶液前增加一步操作:______ 。然后滴入NaOH溶液,有蓝灰色沉淀生成,继续滴入NaOH溶液,沉淀溶解,溶液变为______ 色。
②乙同学进一步研究碱性环境对+3价铬元素的还原性或H2O2的氧化性的影响,设计如图实验。
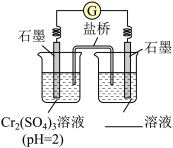
右侧烧杯的溶液中,氧化剂是_____ 。
开始时灵敏电流计指针不偏转,分别继续进行如下实验。
i.向左侧烧杯中滴入NaOH溶液,出现蓝灰色沉淀,继续缓慢滴入NaOH溶液,灵敏电流计指针向右偏转(电子从左向右运动),此时左侧的电极反应式为_____ 。
ii.向右侧烧杯中滴入NaOH溶液,有微小气泡生成,灵敏电流计指针向左偏转,左侧无明显变化。此时原电池中的总反应的化学方程式为_____ 。
(5)由上述实验, 与H2O2、
与H2O2、 与H2O2的氧化性强弱(填“>”或“<”):
与H2O2的氧化性强弱(填“>”或“<”):
酸性条件下,
_____ H2O2;碱性条件下, 
_____ H2O2。
资料:
i.含Cr元素的常见粒子:
 (橙色)、
(橙色)、 (黄色)、CrO5(溶于水,蓝紫色,不稳定)、Cr3+(绿色)、Cr(OH)3(蓝灰色,难溶于水,可溶于强酸、强碱)、
(黄色)、CrO5(溶于水,蓝紫色,不稳定)、Cr3+(绿色)、Cr(OH)3(蓝灰色,难溶于水,可溶于强酸、强碱)、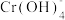 (亮绿色)。
(亮绿色)。ii.H2O2在碱性环境中比在酸性环境中分解速率快。
iii.在碱性环境中,O2不能氧化+3价铬元素。
实验操作及现象如表:
| 装置 | 步骤 | 操作 | 现象 |
 2mL0.0125mol•L-1K2Cr2O7溶液 | I | 先滴入稀硫酸至pH≈2,再滴入5滴5%H2O2溶液,振荡 | 溶液橙色加深。滴入H2O2溶液后迅速变为蓝紫色,有气泡生成。稍后,无明显气泡时,溶液由蓝紫色完全变为绿色 |
| Ⅱ | 继续缓慢滴入10滴2mol•L-1NaOH溶液,边滴,边振荡 | 又有气泡生成,溶液最终变为黄色 |
 (橙色)+H2O
(橙色)+H2O 2
2 (黄色)+2H+。请用化学平衡移动原理解释I中滴入稀硫酸后溶液橙色加深的原因:
(黄色)+2H+。请用化学平衡移动原理解释I中滴入稀硫酸后溶液橙色加深的原因:(2)I中,溶液由橙色变为绿色的总反应的离子方程式是
(3)Ⅱ中,继续滴入NaOH溶液后,又有气泡生成的原因是
(4)Ⅱ中,继续滴入NaOH溶液后,预测有Cr(OH)3沉淀生成,但实验时未观察到。
提出假设:在碱性环境中,+3价铬元素被H2O2氧化。
①甲同学设计实验证明假设成立:
取少量I中的绿色溶液,在滴入NaOH溶液前增加一步操作:
②乙同学进一步研究碱性环境对+3价铬元素的还原性或H2O2的氧化性的影响,设计如图实验。

右侧烧杯的溶液中,氧化剂是
开始时灵敏电流计指针不偏转,分别继续进行如下实验。
i.向左侧烧杯中滴入NaOH溶液,出现蓝灰色沉淀,继续缓慢滴入NaOH溶液,灵敏电流计指针向右偏转(电子从左向右运动),此时左侧的电极反应式为
ii.向右侧烧杯中滴入NaOH溶液,有微小气泡生成,灵敏电流计指针向左偏转,左侧无明显变化。此时原电池中的总反应的化学方程式为
(5)由上述实验,
 与H2O2、
与H2O2、 与H2O2的氧化性强弱(填“>”或“<”):
与H2O2的氧化性强弱(填“>”或“<”):酸性条件下,


您最近一年使用:0次
2023-01-07更新
|
408次组卷
|
4卷引用:北京市西城区2022-2023学年高二上学期1月期末考试化学试题
名校
解题方法
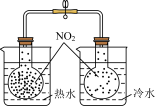
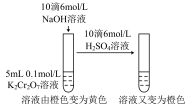
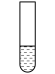
6 . 下列实验中,对现象的解释不正确 的是
| 选项 | A | B | C | D |
| 装置及操作 |  向右轻轻推动活塞压缩体积 | 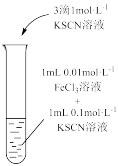 | 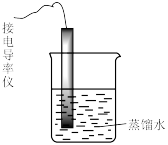 分别测定20℃和80℃蒸馏水的电导率 | 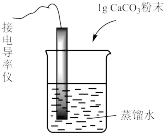 |
| 现象 | 气体红棕色先变深再变浅 | 溶液血红色加深 | 80℃蒸馏水的电导率大于20℃的 | 加入 粉末后电导率增大 粉末后电导率增大 |
| 解释 | 压强增大, 平衡先逆向移动,再正向移动 平衡先逆向移动,再正向移动 | 增大反应物浓度,  平衡正向移动 平衡正向移动 | 温度升高,水的电离平衡正向移动 |  在水中存在 在水中存在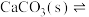  |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2023-01-06更新
|
933次组卷
|
13卷引用:北京海淀区2022-2023学年高二上学期期末考试化学试题
北京海淀区2022-2023学年高二上学期期末考试化学试题北京一零一中学2022-2023高二上学期期末考试化学试题北京市首都师范大学附属中学2022-2023学年高二上学期期末考试化学试题北京市顺义牛栏山第一中学2022-2023学年高二下学期3月月考化学试题北京市顺义牛栏山第一中学2023-2024学年高二上学期期中考试化学试题北京市第三十五中学2023-2024学年高二上学期期中考试化学试题 北京市第十三中学2023-2024学年高二上学期期中考试化学试题北京师范大学附属中学2023-2024学年高二上学期期中考试化学试卷北京市第五十中学2023-2024学年高二上学期12月月考化学试题北京交通大学附属中学第二分校2023-2024学年高二上学期12月月考化学试题河南省濮阳市第一高级中学2022-2023学年高二下学期期中质量检测化学试题四川省德阳市什邡中学2023-2024学年高二上学期11月期中考试化学试题天津市部分区2023-2024学年高二上学期期末练习化学试题
解题方法
7 . 某实验小组对FeCl3溶液与Na2SO3溶液的反应进行探究。
已知:铁氰化钾的化学式为K3[Fe(CN)6],用于检验Fe2+,遇Fe2+离子产生蓝色沉淀
【实验1】
(1)配制FeCl3溶液时,先将FeCl3溶于浓盐酸,再稀释至指定浓度。从化学平衡角度说明浓盐酸的作用:__________ 。
【探究现象i产生的原因】
(2)甲同学认为发生反应:2Fe3++3 +6H2O
+6H2O 2Fe(OH)3(胶体)+3H2SO3;他取少量红褐色溶液于试管中,继续滴加1mol/LNa2SO3溶液,发现溶液红褐色变深且产生刺激性气味的气体,该气体是
2Fe(OH)3(胶体)+3H2SO3;他取少量红褐色溶液于试管中,继续滴加1mol/LNa2SO3溶液,发现溶液红褐色变深且产生刺激性气味的气体,该气体是_______ (填化学式)。
(3)乙同学认为还发生了氧化还原反应。他取少许红褐色溶液于试管中,加入______ ,有白色沉淀产生,证明产物中含有 。
。
丙同学认为乙同学的实验不严谨,因为在上述过程中 可能被其它物质氧化。为了进一步确认
可能被其它物质氧化。为了进一步确认 被氧化的原因,丙同学设计了实验2。
被氧化的原因,丙同学设计了实验2。
【实验2】用如图装置(a、b均为石墨电极)进行实验。闭合开关后灵敏电流计指针偏转。
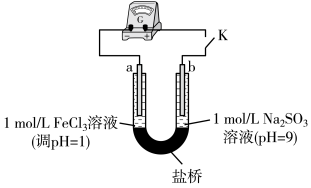
(4)实验2中正极的电极反应式为______ 。丙同学又用铁氰化钾溶液检验正极的产物,观察到有蓝色沉淀产生。他得出的结论是___________ 。
【解释现象ii产生的原因】
(5)综合上述结果,请从平衡移动角度解释,现象ii产生的原因为___________________ 。
已知:铁氰化钾的化学式为K3[Fe(CN)6],用于检验Fe2+,遇Fe2+离子产生蓝色沉淀
【实验1】
| 装置 | 实验现象 |
 | 现象i:一开始溶液颜色加深,由棕黄色变为红褐色。 现象ii:一段时间后溶液颜色变浅,变为浅黄色。 |
【探究现象i产生的原因】
(2)甲同学认为发生反应:2Fe3++3
 +6H2O
+6H2O 2Fe(OH)3(胶体)+3H2SO3;他取少量红褐色溶液于试管中,继续滴加1mol/LNa2SO3溶液,发现溶液红褐色变深且产生刺激性气味的气体,该气体是
2Fe(OH)3(胶体)+3H2SO3;他取少量红褐色溶液于试管中,继续滴加1mol/LNa2SO3溶液,发现溶液红褐色变深且产生刺激性气味的气体,该气体是(3)乙同学认为还发生了氧化还原反应。他取少许红褐色溶液于试管中,加入
 。
。丙同学认为乙同学的实验不严谨,因为在上述过程中
 可能被其它物质氧化。为了进一步确认
可能被其它物质氧化。为了进一步确认 被氧化的原因,丙同学设计了实验2。
被氧化的原因,丙同学设计了实验2。【实验2】用如图装置(a、b均为石墨电极)进行实验。闭合开关后灵敏电流计指针偏转。

(4)实验2中正极的电极反应式为
【解释现象ii产生的原因】
(5)综合上述结果,请从平衡移动角度解释,现象ii产生的原因为
您最近一年使用:0次
解题方法
8 . 某实验小组同学做电解CuCl2溶液实验,发现电解后 (电极未从溶液中取出)阴极上析出的铜会消失。为探究铜“消失”的原因,该小组同学用不同电解质溶液(足量)、在相同时间内进行如下实验。
已知:① ②
② (无色)③
(无色)③ ;黄色
;黄色
下列分析不正确 的是
| 装置 |
| |
| 序号 | 电解质溶液 | 实验现象(电解后) |
| I |  溶液 溶液 | 溶液仍呈蓝色,附着的铜层无明显变化 |
| II | 稀 溶液 溶液 | 溶液由蓝色开始变为浅黄绿色,2min后溶液变浑浊 |
| III | 浓 溶液 溶液 | 溶液由绿色逐渐变为深黄绿色(略黑),附着的铜层变薄 |
 ②
② (无色)③
(无色)③ ;黄色
;黄色下列分析
A.电解后 溶液的 溶液的 减小,原因是 减小,原因是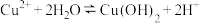 |
B.浓 溶液呈绿色原因是 溶液呈绿色原因是 增大, 增大,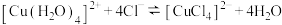 平衡正向移动 平衡正向移动 |
C.II中溶液变浑浊,推测难溶物为 |
D.III中溶液变为深黄绿色,推测原因是 ,溶液中 ,溶液中 增大 增大 |
您最近一年使用:0次
名校
9 . 某实验小组对 溶液与
溶液与 溶液的反应进行探究。
溶液的反应进行探究。
【实验】
(1)配制 溶液时,先将
溶液时,先将 溶于浓盐酸,再稀释至指定浓度。从化学平衡角度说明浓盐酸的作用:
溶于浓盐酸,再稀释至指定浓度。从化学平衡角度说明浓盐酸的作用:_______ 。
(2)探究现象i产生的原因:
甲同学认为发生反应: ,进行实验证实。他取少量红褐色溶液于试管中,用一束光照射,在垂直于光束方向观察到
,进行实验证实。他取少量红褐色溶液于试管中,用一束光照射,在垂直于光束方向观察到_______ ;向试管中继续滴加1mol/L 溶液,发现溶液红褐色变深且产生刺激性气味的气体,该气体是
溶液,发现溶液红褐色变深且产生刺激性气味的气体,该气体是_______ (填化学式)。
(3)探究现象ii产生的原因:
①乙同学认为还发生了氧化还原反应,其离子方程式为_______ ;他取少许红褐色溶液于试管中,加入_______ ,有白色沉淀产生,证明产物中含有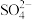 。
。
②丙同学认为乙同学的实验不严谨,因为在上述过程中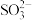 可能被其它物质氧化。为了进一步确认
可能被其它物质氧化。为了进一步确认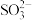 被
被 氧化,丙同学设计的实验方案是
氧化,丙同学设计的实验方案是_______ 。
(4)综合上述结果,请从化学反应速率和化学反应限度角度解释,现象i和ii产生的原因为_______ 。
 溶液与
溶液与 溶液的反应进行探究。
溶液的反应进行探究。【实验】
| 装置 | 实验现象 |
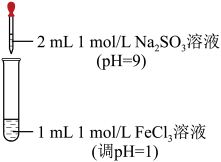 | 现象ⅰ:一开始溶液颜色加深,由棕黄色变为红褐色。 现象ⅱ:一段时间后溶液颜色变浅,变为浅黄色。 |
 溶液时,先将
溶液时,先将 溶于浓盐酸,再稀释至指定浓度。从化学平衡角度说明浓盐酸的作用:
溶于浓盐酸,再稀释至指定浓度。从化学平衡角度说明浓盐酸的作用:(2)探究现象i产生的原因:
甲同学认为发生反应:
 ,进行实验证实。他取少量红褐色溶液于试管中,用一束光照射,在垂直于光束方向观察到
,进行实验证实。他取少量红褐色溶液于试管中,用一束光照射,在垂直于光束方向观察到 溶液,发现溶液红褐色变深且产生刺激性气味的气体,该气体是
溶液,发现溶液红褐色变深且产生刺激性气味的气体,该气体是(3)探究现象ii产生的原因:
①乙同学认为还发生了氧化还原反应,其离子方程式为
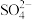 。
。②丙同学认为乙同学的实验不严谨,因为在上述过程中
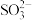 可能被其它物质氧化。为了进一步确认
可能被其它物质氧化。为了进一步确认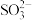 被
被 氧化,丙同学设计的实验方案是
氧化,丙同学设计的实验方案是(4)综合上述结果,请从化学反应速率和化学反应限度角度解释,现象i和ii产生的原因为
您最近一年使用:0次




