名校
解题方法
1 . 足量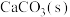 在水中的溶解过程如下:
在水中的溶解过程如下:
 ,该悬浊液达到平衡后,下列叙述
,该悬浊液达到平衡后,下列叙述不正确 的是
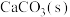 在水中的溶解过程如下:
在水中的溶解过程如下:
 ,该悬浊液达到平衡后,下列叙述
,该悬浊液达到平衡后,下列叙述A.升高温度,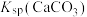 减小 减小 |
B.加少量水稀释,上述平衡正向移动, 不变 不变 |
C.向悬浊液中加入少量 固体, 固体, 减小 减小 |
D.向悬浊液中滴入盐酸, ,导致平衡正向移动 ,导致平衡正向移动 |
您最近一年使用:0次
2023-07-31更新
|
472次组卷
|
2卷引用:浙江省台州市2022-2023学年高三上学期第一次教学质量评估化学试题
2 . NO的处理与减排是烟气污染物控制的重点和难点,相关研究引起了国内外的广泛关注。
(1)理论上可采用加热使NO分解的方法处理: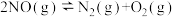 ,反应的部分数据如下表:
,反应的部分数据如下表:
通过计算得出高于7089℃时反应无法自发进行,试判断b____ 0(填“<”、“>”或“=”);反应的平衡常数表达式为____ ;实际反应时发现加热至600℃时NO仍没有明显分解,试解释原因___ 。
(2)科学家发现活性炭表面的有机结构可以被强氧化剂氧化成酚羟基、羧基(均可表示为C—OH,其电离平衡可表示为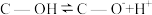 ),这些官能团可以使活性炭表面活性化,有利于NO的吸附。不同氧化剂的预氧化与吸附原理可表示为(未配平):
),这些官能团可以使活性炭表面活性化,有利于NO的吸附。不同氧化剂的预氧化与吸附原理可表示为(未配平):
预氧化: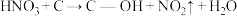
预氧化:
预氧化:
吸附: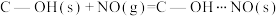
NO吸附实验分别在25℃和55℃下进行,将一定比例的 与NO混合气体在10 MPa恒压下,以相同速率持续通入到等量的、不同预氧化试剂处理的活性炭中(图象中“原始-C”表示未经处理的活性炭),获得两个温度下“NO捕获率-通气时间”的变化图:
与NO混合气体在10 MPa恒压下,以相同速率持续通入到等量的、不同预氧化试剂处理的活性炭中(图象中“原始-C”表示未经处理的活性炭),获得两个温度下“NO捕获率-通气时间”的变化图:
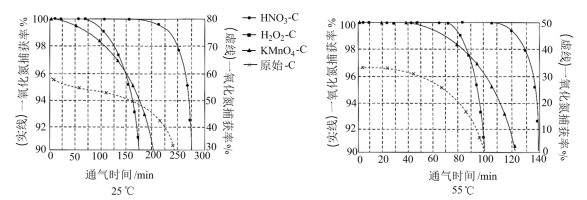
已知:NO捕获率=
请回答:
①下列描述正确的是_______
A.25℃下原始-C在通气约175分钟后吸附效果超过了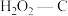
B.若其他条件不变,增大混合气体中 物质的量分数,吸附平衡会逆向移动
物质的量分数,吸附平衡会逆向移动
C.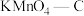 在实验中吸附效果不佳,可能是活性炭表面孔隙被堵塞
在实验中吸附效果不佳,可能是活性炭表面孔隙被堵塞
D.由图象可知升温有利于吸附平衡正向移动,故吸附过程的
②其他条件不变,55℃下增大烟气中水蒸气含量后,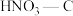 的NO捕获率会迅速降低,通气1小时后为40%,70 min后吸附到达平衡。请在对应图象中用虚线画出通气1小时后至吸附平衡为止NO捕获率的变化曲线
的NO捕获率会迅速降低,通气1小时后为40%,70 min后吸附到达平衡。请在对应图象中用虚线画出通气1小时后至吸附平衡为止NO捕获率的变化曲线____________ 。
③相比其他预氧化试剂处理的活性炭,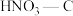 吸附效果更佳,有研究者认为可能是
吸附效果更佳,有研究者认为可能是 引入了
引入了 ,增强了活性炭的表面活性。试利用勒夏特列原理予以解释
,增强了活性炭的表面活性。试利用勒夏特列原理予以解释_______ 。
(1)理论上可采用加热使NO分解的方法处理:
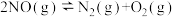 ,反应的部分数据如下表:
,反应的部分数据如下表:项目 |
|
| 正反应活化能 | 逆反应活化能 |
数据/ | a | b | 728 | 910 |
通过计算得出高于7089℃时反应无法自发进行,试判断b
(2)科学家发现活性炭表面的有机结构可以被强氧化剂氧化成酚羟基、羧基(均可表示为C—OH,其电离平衡可表示为
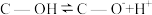 ),这些官能团可以使活性炭表面活性化,有利于NO的吸附。不同氧化剂的预氧化与吸附原理可表示为(未配平):
),这些官能团可以使活性炭表面活性化,有利于NO的吸附。不同氧化剂的预氧化与吸附原理可表示为(未配平):预氧化:
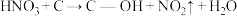
预氧化:

预氧化:

吸附:
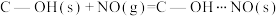
NO吸附实验分别在25℃和55℃下进行,将一定比例的
 与NO混合气体在10 MPa恒压下,以相同速率持续通入到等量的、不同预氧化试剂处理的活性炭中(图象中“原始-C”表示未经处理的活性炭),获得两个温度下“NO捕获率-通气时间”的变化图:
与NO混合气体在10 MPa恒压下,以相同速率持续通入到等量的、不同预氧化试剂处理的活性炭中(图象中“原始-C”表示未经处理的活性炭),获得两个温度下“NO捕获率-通气时间”的变化图:
已知:NO捕获率=

请回答:
①下列描述正确的是
A.25℃下原始-C在通气约175分钟后吸附效果超过了
B.若其他条件不变,增大混合气体中
 物质的量分数,吸附平衡会逆向移动
物质的量分数,吸附平衡会逆向移动C.
 在实验中吸附效果不佳,可能是活性炭表面孔隙被堵塞
在实验中吸附效果不佳,可能是活性炭表面孔隙被堵塞D.由图象可知升温有利于吸附平衡正向移动,故吸附过程的

②其他条件不变,55℃下增大烟气中水蒸气含量后,
 的NO捕获率会迅速降低,通气1小时后为40%,70 min后吸附到达平衡。请在对应图象中用虚线画出通气1小时后至吸附平衡为止NO捕获率的变化曲线
的NO捕获率会迅速降低,通气1小时后为40%,70 min后吸附到达平衡。请在对应图象中用虚线画出通气1小时后至吸附平衡为止NO捕获率的变化曲线③相比其他预氧化试剂处理的活性炭,
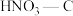 吸附效果更佳,有研究者认为可能是
吸附效果更佳,有研究者认为可能是 引入了
引入了 ,增强了活性炭的表面活性。试利用勒夏特列原理予以解释
,增强了活性炭的表面活性。试利用勒夏特列原理予以解释
您最近一年使用:0次
解题方法
3 . H2S催化分解过程中通入CO2、CH4会发生如下反应,下列说法不正确 的是
A.CH4(g)+CO2(g) 2H2(g)+2CO(g)压缩容器体积,平衡转化率将增大 2H2(g)+2CO(g)压缩容器体积,平衡转化率将增大 |
B.H2S(g)+CO2(g) H2O(g)+COS(g)通入CO2,将促进反应的进行 H2O(g)+COS(g)通入CO2,将促进反应的进行 |
C.已知2H2S(g)+CH4(g) 4H2(g)+CS2(g) △H>0,则该反应在高温下易自发 4H2(g)+CS2(g) △H>0,则该反应在高温下易自发 |
D.2H2S(g) 2H2(g)+S(g) △H>0 2H2(g)+S(g) △H>0 |
您最近一年使用:0次
14-15高三上·浙江台州·阶段练习
4 . 砷(As)广泛分布于自然界,其原子结构示意图是 。
。
(1)砷位于元素周期表中_______ 族,其气态氢化物的稳定性比NH3 _______ (填“强”或“弱”)。
(2)砷的常见氧化物有As2O3和As2O5,其中As2O5热稳定性差。根据下图写出As2O5分解为As2O3的热化学方程式:_______ 。

(3)砷酸盐可发生如下反应:AsO +2I-+2H+⇌AsO
+2I-+2H+⇌AsO +I2+H2O。如图装置中,C1、C2是石墨电极。
+I2+H2O。如图装置中,C1、C2是石墨电极。
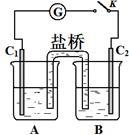
①A中盛有棕色的KI和I2的混合溶液,B中盛有无色的Na3AsO4和Na3AsO3的混合溶液,当连接开关K,并向B中滴加浓盐酸时发现灵敏电流计G的指针向右偏转。此时C2上发生的电极反应是_______ 。
② 一段时间后,当电流计指针回到中间“0”位时,再向B中滴加过量浓NaOH溶液,可观察到电流计指针_______ (填“不动”、“向左偏”或“向右偏”)。
(4)利用(3)中反应可测定含As2O3和As2O5的试样中的各组分含量(所含杂质对测定无影响),过程如下:
① 将试样溶于NaOH溶液,得到含AsO 和AsO
和AsO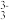 的混合溶液。As2O5与NaOH溶液反应的离子方程式是
的混合溶液。As2O5与NaOH溶液反应的离子方程式是_______ 。
② 上述混合液用0.02500 mol·L-1的I2溶液滴定,消耗I2溶液20.00 mL。滴定完毕后,使溶液呈酸性,加入过量的KI,析出的I2又用0.1000 mol·L-1的Na2S2O3溶液滴定,消耗Na2S2O3溶液30.00 mL。(已知2Na2S2O3+I2=Na2S4O6+2NaI)试样中As2O5的质量是_______ g。
 。
。(1)砷位于元素周期表中
(2)砷的常见氧化物有As2O3和As2O5,其中As2O5热稳定性差。根据下图写出As2O5分解为As2O3的热化学方程式:

(3)砷酸盐可发生如下反应:AsO
 +2I-+2H+⇌AsO
+2I-+2H+⇌AsO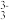 +I2+H2O。如图装置中,C1、C2是石墨电极。
+I2+H2O。如图装置中,C1、C2是石墨电极。
①A中盛有棕色的KI和I2的混合溶液,B中盛有无色的Na3AsO4和Na3AsO3的混合溶液,当连接开关K,并向B中滴加浓盐酸时发现灵敏电流计G的指针向右偏转。此时C2上发生的电极反应是
② 一段时间后,当电流计指针回到中间“0”位时,再向B中滴加过量浓NaOH溶液,可观察到电流计指针
(4)利用(3)中反应可测定含As2O3和As2O5的试样中的各组分含量(所含杂质对测定无影响),过程如下:
① 将试样溶于NaOH溶液,得到含AsO
 和AsO
和AsO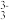 的混合溶液。As2O5与NaOH溶液反应的离子方程式是
的混合溶液。As2O5与NaOH溶液反应的离子方程式是② 上述混合液用0.02500 mol·L-1的I2溶液滴定,消耗I2溶液20.00 mL。滴定完毕后,使溶液呈酸性,加入过量的KI,析出的I2又用0.1000 mol·L-1的Na2S2O3溶液滴定,消耗Na2S2O3溶液30.00 mL。(已知2Na2S2O3+I2=Na2S4O6+2NaI)试样中As2O5的质量是
您最近一年使用:0次
11-12高二上·湖南长沙·期中
名校
5 . 下列化学反应中:Ag++Fe2+  Ag(固)+Fe3+(正反应放热)为使平衡体系析出更多的银,可采取的措施是
Ag(固)+Fe3+(正反应放热)为使平衡体系析出更多的银,可采取的措施是
 Ag(固)+Fe3+(正反应放热)为使平衡体系析出更多的银,可采取的措施是
Ag(固)+Fe3+(正反应放热)为使平衡体系析出更多的银,可采取的措施是| A.常温下加压 | B.增加Fe3+的浓度 |
| C.增加Fe2+的浓度 | D.移去一些析出的银 |
您最近一年使用:0次
2018-12-19更新
|
177次组卷
|
6卷引用:2012届浙江省台州市高三上学期期末质量评估化学试卷
(已下线)2012届浙江省台州市高三上学期期末质量评估化学试卷(已下线)2011-2012学年湖南省望城一中高二上学期期中考试化学试卷江西省高安二中2018-2019学年高二上学期期中考试化学试题黑龙江省哈尔滨市尚志市尚志中学2019-2020学年高二上学期第三次月考化学试题黑龙江省绥化市安达市第七中学2019-2020学年高二下学期期中考试化学试题广东省第二师范学院番禺附属中学2019-2020学年高二下学期期中段考化学试题
名校
6 . 下列事实不能用勒夏特列原理解释的是
A.氯水中有平衡:Cl2+H2O HCl+HClO,当加入AgNO3溶液后,溶液颜色变浅 HCl+HClO,当加入AgNO3溶液后,溶液颜色变浅 |
B.对CO(g)+NO2(g) CO2(g)+NO(g),平衡体系增大压强可使颜色变深 CO2(g)+NO(g),平衡体系增大压强可使颜色变深 |
C.对2NO2(g)  N2O4(g) △H<0, 升高温度平衡体系颜色变深 N2O4(g) △H<0, 升高温度平衡体系颜色变深 |
| D.SO2催化氧化成SO3的反应,往往加入过量的空气 |
您最近一年使用:0次
2016-12-09更新
|
228次组卷
|
6卷引用:浙江省台州市五校2020届高三10月联考化学试题